Использование комбинированного подхода - ограничения питательных веществ и химиотерапии - при карциноме легких Льюис
Автор: Коршунов Дмитрий Афанасьевич, Климов Игорь Александрович, Кондакова Ирина Викторовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.17, 2018 года.
Бесплатный доступ
Цель исследования - изучить влияние периодического ограничения питательных веществ в комбинации с химиотерапией метотрексатом на развитие карциномы легких Льюиса у мышей. Материал и методы. Эксперимент выполнен на мышах линии C57BL/6j. Взрослым мышам инокулировали в мышцу бедра живые клетки LLC. Полное голодание проходило в две стадии: два раза (по двое суток) с перерывом в сутки. В лечении использовали метотрексат (МТХ) по схеме ограничения питательных веществ в самостоятельной форме и на фоне ограничения питательных веществ. Препарат вводили животным внутрибрюшинно в максимально переносимой дозе. Эффективность лечения оценивали по торможению роста опухоли (ТРО), уровню торможения метастазов в легких (ТМ) и кинетическому индексу роста опухоли (ИР). Результаты. В группе с ограничением питательных веществ конечное ТРО достигало 34 %, леченных МТХ - 27 %, при комбинации - 46 %. Индекс ТМ в группе животных, леченных МТХ, достигал 90 %, а на фоне ограничения питательных веществ - 70 %. В группе животных, подвергшихся ограничению питательных веществ, ТМ не отличался от значения в контрольной группе. Кинетический индекс ИР составил 0,7 для групп с ограничением питательных веществ и при комплексном лечении, при монотерапии МТХ составлял 0,81. Общетоксическое действие МТХ на организм сказалось на снижении массы тела - на 27 %. При ограничении питательных веществ и на его фоне с применением МТХ масса тела снижалась на 13 % и 17 % соответственно. Заключение. Метотрексат сдерживал рост опухолевых клеток, однако терапевтический эффект нивелировался токсическим действием препарата на организм животных. Длительное ограничение питательных веществ тормозило рост первичной опухоли, при возврате на нормальное питание рост опухоли быстро возобновлялся. Применение химиопрепарата на фоне ограничения питательных веществ увеличивало его противоопухолевое действие на первичный очаг, снижало токсические проявления, но уменьшало его антиметастатическую активность на 20 %.
Метотрексат, дифференциальное напряжение
Короткий адрес: https://sciup.org/140254160
IDR: 140254160 | УДК: 616.24-006.6:615.28(092.8). | DOI: 10.21294/1814-4861-2018-17-1-38-44
Текст научной статьи Использование комбинированного подхода - ограничения питательных веществ и химиотерапии - при карциноме легких Льюис
Химиотерапия является одним из основных способов лечения широкого диапазона злокачественных новообразований [1]. Ее стратегия в основном ориентирована на поражение генетического аппарата злокачественных клеток [2]. Изначально считалось, что химиопрепараты обладают избирательностью в отношении опухолевых клеток, однако нормально делящиеся клетки ткани также подвергаются серьезным повреждениям. Побочные эффекты химиопрепаратов множественны и включают в себя миелосупрессию, усталость, рвоту, диарею, нефро-, кардио- и гепатотоксичность, в некоторых случаях даже бесплодие и смерть [1].
Для снижения побочных эффектов были созданы химиопротекторы: амифостин (снижает гематотоксичность ДНК-связывающих препаратов), глутатион (антиоксидант), месна (антидот препаратов алкилирующего типа действия) и дек-сразоксан (кардиопротектор). Исследования этих химиопротекторов показали, что они обеспечивали защиту от препаратов для определенных тканей, но без увеличения безрецидивной или общей выживаемости, отчасти потому, что они также обеспечивали защиту раковым клеткам или обладают отсроченной токсичностью [3].
Ряд исследований показал, что длительное сокращение потребления калорий без истощения
уменьшает процент выхода спонтанных опухолей и задерживает у грызунов прогрессирование в различных опухолях [4–7]. При низкокалорийной длительной диете у приматов наблюдалось снижение заболеваемости и смертности от рака [8]. Исследования при низкокалорийной длительной диете у людей показали снижение метаболических и гормональных факторов, связанных с риском для формирования онкозаболеваний [9–12]. Однако клиническое применение длительных лечебных диет имеет ряд сложностей. В частности, они вызывают неприемлемую потерю веса у онкологических больных [13]. В экспериментах на мышах было показано, что краткосрочное ограничение питательных веществ (ОПВ) столь же эффективно, как низкокалорийная длительная диета, так как оно замедляет рост опухоли без потери массы тела [14–16]. Еще более важно, что чувствительность к химиотерапии при краткосрочном ОПВ отличается у нормальных соматических и раковых клеток. У нормальных клеток недостаток питательных веществ выключает пути, способствующие росту, и перераспределяет энергию на репаративные процессы, которые, в свою очередь, повышают устойчивость к химиотерапии [17, 18]. В противоположность этому опухолевые клетки не способны активировать эту защитную реакцию из-за неконтролируемой активации путей роста под влиянием онкогенных мутаций. В результате того, что опухолевым клеткам требуется активное поступление питательных веществ для обеспечения повышенного метаболизма, короткие периоды ОПВ повышают их чувствительность к химиотерапии [14–16]. Описанное явление различного ответа нормальных и опухолевых клеток при ОПВ называется дифференциальным напряжением [14, 15, 19, 20].
Хорошо известна связь между ожирением и заболеваемостью раком. Существует несколько объяснений этого явления, среди которых фигурирует стимуляция опухолевого роста за счет гормонов жировой ткани, избыточной доступности питательных веществ, в частности глюкозы, необходимой для анаэробного гликолиза в опухолевых клетках [21, 22]. Следовательно, ОПВ может являться дополнительным фактором для повышения эффективности как химиотерапии, так и переносимости цитостатиков.
Целью исследования являлось изучение влияния длительного ограничения питательных веществ, состоящего из двух краткосрочных стадий, на развитие карциномы легких Льюиса и эффективность химиотерапии метотрексатом.
Материал и методы
Эксперимент выполнен на мышах линии C57BL/6j (самцы) массой 25–30 г, полученных из питомника НИИ фармакологии и регенеративной медицины имени Е.Д. Гольдберга. Животные на- ходились в виварии временного содержания Томского НИИ онкологии при температуре 20–21ºС и влажности воздуха 55–60 %, при световом режиме «день:ночь» – 1:1, на стандартном рационе питания и свободном доступе к воде. Исследования проводили с соблюдением правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ Р 51000.3 96 и ГОСТ Р 51000.4 96), международных рекомендаций «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Strasburg, 1986 г.).
Для перевивки эпидермоидной карциномы Льюис (LLC) всем животным единовременно инокулировали в мышцу бедра по 1,5 млн опухолевых клеток LLC в 0,2 мл 0,9 % NaCl. Использовали четвертый пассаж после разморозки с метастазированием в легкие в 100 % случаев. Объем бедра определяли с 3-х суток штангенциркулем Horse power (Тайвань) по методу Шрека [22].
Полное ОПВ проводили в модифицированном режиме 2–1–2: два раза (по двое сут) с перерывом в 1 сут, в течение которых животные получали полноценное сбалансированое питание. Во время ОПВ животные имели свободный доступ к воде. Также на 3 и 4-е сут мыши получали по 1 г обезжиренного творога для уменьшения деградации пищеварительного тракта. В лечении использовали метотрексат (МТХ, Эбеве Фарма, Австрия) по схеме ОПВ в самостоятельной форме и на фоне ОПВ. Препарат вводили внутрибрюшинно в максимально переносимой дозе 1,5 мг/кг в сут. Лечение животных начинали с 6-х сут от момента инокуляции опухолевых клеток. Контрольные животные получали физиологический раствор в таком же объеме. Животных выводили из опыта на 21-е сут эксперимента при токсической дозе золетила (VIRBAC, Франция).
Торможение роста опухоли (ТРО) вычисляли по формулам:
SK-Son NK-Non
TPOV=--------x 100 %, TPOM=--------x 100 %, e N где Sк – средний объем опухоли в контрольной группе; Sоп – средний объем опухоли в опытной группе; Nк – средняя масса опухоли в контрольной группе; Nоп – средняя масса опухоли в опытной группе [24].
Уровень торможения метастазов (ТМ) в легких рассчитывали по формуле
MK — Mon
TM =----------- x 100%,
MK где Мк – средняя масса метастазов в легких контрольной группы; Моп – средняя масса метастазов в легких опытной группы [24].
Кинетический индекс роста опухоли (ИР) оценивали по формуле
ИР = Sэ/Sк, где Sэ – площадь под кинетической кривой роста опухоли в подопытной, а Sк – в контрольной группе [25].
Статистическую обработку данных проводили с помощью пакета прикладных программ Statistica 6.0. Для оценки значимости различий между независимыми выборками при распределении, отличном от нормального, применяли критерий Манна – Уитни. Различия считались значимыми при p<0,05.
Результаты и обсуждение
На первом этапе исследования была проведена оценка влияния ОПВ и МТХ на общее состояние животных и их массу тела (рис. 1). Модификация схемы ОПВ в два этапа была введена для возможности проведения курсовой химиотерапии на фоне эффектов ОПВ, так как курсовое введение препарата позволяет пролонгировать терапевтическое окно и уменьшает разовую дозу высокотоксического препарата. Диапазон 2–1–2 был обусловлен тем, что для линии мышей, использованной в эксперименте, оптимальным вариантом оказались 2 сут полного ОПВ. При 3-суточном ОПВ выживаемость падала до 50 %, после 4-х сут погибали все животные. При этом такой вариант попеременного ОПВ с потреблением пищи является нормой в естественных условиях обитания животных. Очевидно, что в контрольной группе после ОПВ масса тела восстанавливалась практически полностью в течение суток, а мыши, получавшие МТХ в периоды ОПВ, начинали восстанавливать свою массу только на 4-е сут после последнего введения. Такой замедленный и продолжительный эффект связан с особенностями механизма действия химиопрепарата. Предварительный анализ действия МТХ показал, что токсические проявления (ухудшение общего состояния и снижение массы тела) начинались через 3 сут с момента введения препарата, а восстановление до нормального состояния занимало 7 сут. Не совсем ясен механизм такого замедленного действия, так как препарат практически полностью выводится из организма в неизмененном виде с мочой в течение суток, и лишь незначительное количество полиглутаминированных производных удерживается в тканях длительное время [26, 27]. Возможно, этот эффект связан с поражением регенерирующих клеток ЖКТ. Из литературы известно, что период жизни энтероцитов составляет 72 ч [28]. Так как МТХ действует на активно делящиеся клетки, то в результате отмирания устаревшего пула клеток и снижения притока нового пула в кишечнике нарушаются механизмы пристеночного пищеварения.
На момент выведения животных из эксперимента (21-е сут) масса опухоли в нелеченной группе животных (контроль) достигла 8 г, что соответствовало 30 % массы тела животного. Необходимо отметить, что масса опухоли превышала суммарную массу печени, сердца, почек и селезенки в 3,2 раза. На момент терапии (7–12-е сут) в легких мышей обнаруживались мелкозернистые метастазы в пределах 20 образований. На 21-е сут количество метастазов в легких животных контрольной группы уже колебалось в диапазоне 60–80, их общая масса достигала 145 мг, при средней массе интактного легкого 155 мг.
Пролонгированное действие МТХ обеспечивало эффективное торможение роста первичной опухоли и особенно процесса метастазирования (табл. 1). Торможение роста метастазов в легких было зафиксировано только в группах, пролеченных МТХ, индекс ТМ у животных, леченных только МТХ, достигал 90 %, а на фоне ОПВ он снижался до 70 %.
Ограничение питательных веществ обеспечивало эффективное ТРО (в виде стабилизации),
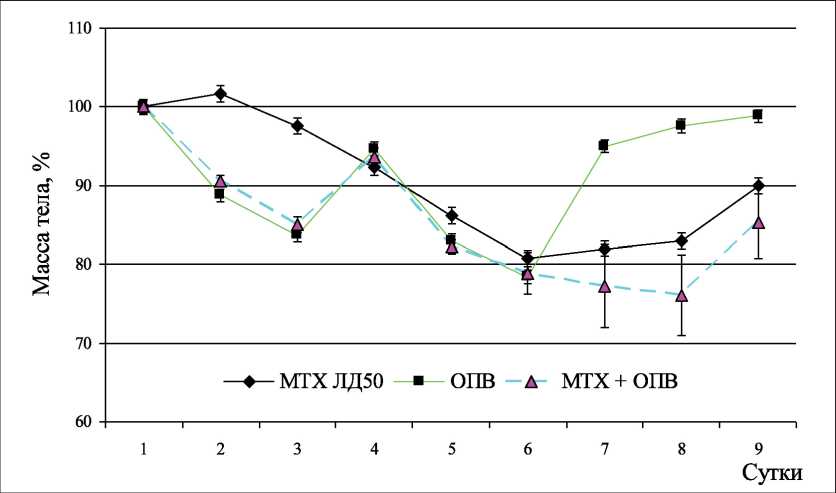
Рис. 1. Изменение массы тела мышей на фоне ограничения питательных веществ и под влиянием МТХ относительно изначальной массы тела
Таблица 1
Влияние вида лечения на торможение роста и метастазирования первичной опухоли (относительные показатели по сравнению с контрольной группой)
|
Метод лечения ТРОV, % ТРОМ, % ТМ, % |
ИР |
|
ОПВ (n=6) 34 ± 5,11,3 26 ± 2,81,3 -6 ± 1,13 Метотрексат (n=6) 27 ± 4,11,2 36 ± 3,71,2 89 ± 9,81,2 Метотрексат + ОПВ (n=6) 46 ± 5,11,2,3 38 ± 4,51,2 67 ± 8,71,2,3 |
0,721,3 0,811,2 0,701,3 |
Примечание: 1 – различия статистически значимы по сравнению с показателями контрольной группы (р<0,05), 2 – различия статистически значимы по сравнению с показателями группы ОПВ (р<0,05), 3 – различия статистически значимы по сравнению с показателями группы животных, получавших метотрексат (р<0,05).
но прогрессирование опухолевого роста быстро восстанавливалось после окончания периода ОПВ. Индекс ТМ в этой группе не отличался от контрольной группы, ТРОM на конец эксперимента снижался до 26 %, когда ТРОV через сутки после лечения был 36 %.
Торможение опухолевого процесса и метастазирования при лечении МТХ определялось комплексным воздействием. Влияние цитостатика на рост опухоли было обусловлено, на наш взгляд, не столько терапевтическим эффектом препарата, сколько его общетоксическим действием на организм. Состояние животных, пролеченных МТХ, на момент выведения из эксперимента, было критическим, кахексия достигала предельного значения, равного 27 % (рис. 2). Известно, что после снижения массы тела на 30 % животное погибает в течение суток. Наименьшую кахексию имели животные в группах с ОПВ (рис. 2). В этих группах также отмечалось значительно лучшее общее состояние животных по сравнению с контрольной группой и состоянием мышей, пролеченных МТХ. В интактных группах с ОПВ и без ОПВ наблюдался прирост массы тела на 8 и 22 % соответственно (рис. 2).
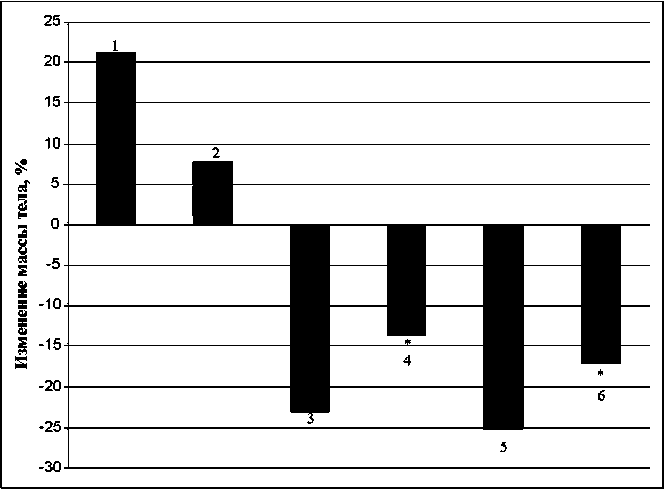
Рис. 2. Изменение массы тела мышей с учетом массы опухоли к 21-м сут. Примечание: 1 – норма, 2 – ОПВ, 3 – контроль, 4 – лечение ОПВ, 5 – лечение МТХ, 6 – комплексное лечение МТХ с ОПВ. * – различия статистически значимы по сравнению с контрольной группой (р<0,01)
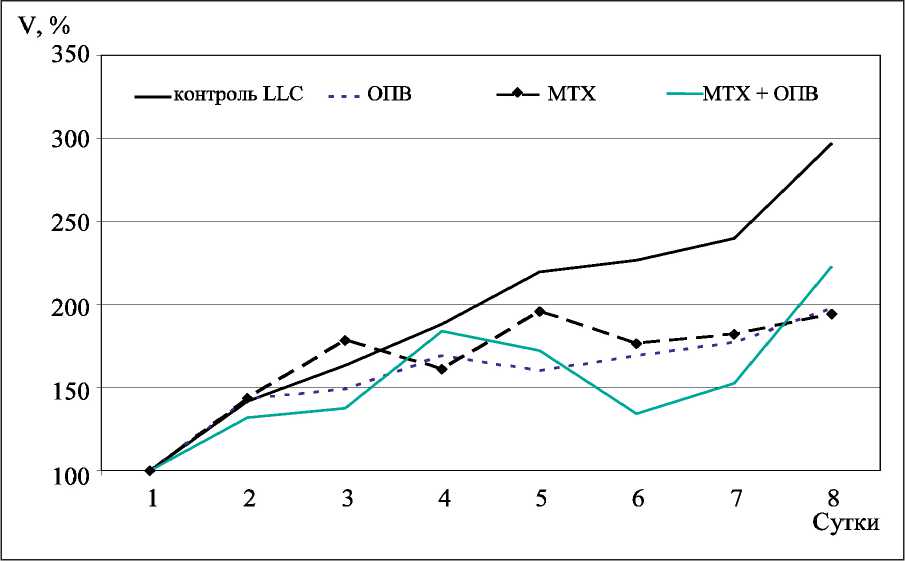
Рис. 3. Изменение объема опухоли в бедре животного. На 1, 2, и 4, 5-е сут животные ограничивались в поступлении питательных веществ. С 6-х сут животных переводили на обычное питание
Индекс ИР, отражающий выраженность противоопухолевого действия препарата, не отличался в группах животных с ОПВ и с МТХ на фоне ОПВ (табл. 1). Характер графика роста опухоли в этих группах все же имел отличия (рис. 3). В группе с ОПВ наблюдалась «стабилизация» роста первичной опухоли и графическая кривая была представлена в виде «плато». При совместном применении ОПВ и МТХ график носил волнообразный характер, а набольший пик «регрессии» отмечался во второй стадии ОПВ.
Список литературы Использование комбинированного подхода - ограничения питательных веществ и химиотерапии - при карциноме легких Льюис
- Chabner B.A., Roberts Jr.T.G. Timeline: chemotherapy and the war on cancer. Nat Rev Cancer. 2005 Jan; 5 (1): 65-72. DOI: 10.1038/nrc1529
- Гервас П.А., Литвяков Н.В., Попова Н.О., Добродеев А.Ю., Тарасова А.С., Юмов Е.Л., Иванова Ф.Г., Черемисина О.В., Афанасьев С.Г.,Гольдберг В.Е., Чердынцева Н.В. Проблемы и перспективы совершенствования молекулярно-генетической диагностики для назначения таргетных препаратов в онкологии. Сибирский онкологический журнал. 2014; 2: 46-55.
- Links M., Lewis C. Chemoprotectants: a review of their clinical pharmacology and therapeutic efficacy. Drugs. 1999 Mar; 57 (3): 293-308.
- De Lorenzo M.S., Baljinnyam E., Vatner D.E., Abarzua P., Vatner S.F., Rabson A.B. Caloric restriction reduces growth of mammary tumors and metastases. Carcinogenesis. 2011 Sep; 32 (9): 1381-7. DOI: 10.1093/carcin/bgr107
- Mulrooney T.J., Marsh J., Urits I., Seyfried T.N., Mukherjee P. Influence of caloric restriction on constitutive expression of NF-kappaB in an experimental mouse astrocytoma. PLoS One. 2011 Mar 30; 6(3): e18085. DOI: 10.1371/journal.pone.0018085


