Использование ксеногенных тестикулярных антигенов в индукции противоопухолевых реакций
Автор: Селедцова Г.В., Доржиева А.Б., Иванова И.П., Селедцов В.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.22, 2023 года.
Бесплатный доступ
Тестикулярные антигены (ТАГ) в норме экспрессируются только клетками тканей яичка и плаценты, иммунная система организма человека толерантна к ТАГ, но при нарушении целостности оболочек яичка эти антигены (АГ), попадая в кровоток, индуцируют в организме появление аутоиммунных реакций, направленных на элиминацию их из организма. При развитии онкологического процесса ТАГ начинают экспрессироваться клетками опухолей печени, молочной железы, поджелудочной железы, кишечника, легкого, поэтому индукция иммунологического распознавания этих АГ может сопровождаться формированием противоопухолевых реакций в организме. Для повышения иммуногенности ТАГ в работе мы использовали ксеногенный ТАГ, полученный из тестикул барана. использование бараньих ТАГ оправдано тем фактом, что ТАГ - эволюционно консервативные молекулы, следствием этого является высокая степень гомологии между дифференцировочными антигенами человека и животных. Цель исследования - оценка продолжительности жизни мышей-опухоленосителей и параметров клеточного иммунитета при различных вариантах иммунизации мышей ТАГ барана. Материал и методы. исследование выполнено на мышах С57BL/6. Эффективность терапевтической или профилактической вакцинации ксеногенными (по отношению к мышам) бараньими ТАГ исследовали по изменению продолжительности жизни мышей-опухоленосителей меланомы В16 и карциномы LLC. Формирование иммунных реакций оценивали по пролиферативной способности спленоцитов отвечать на вакцинальные и контрольные АГ (набор MTT-assay kit (cell proliferation), Abcam) и по продукции ими IFN-gamma и IL-10 (ELISA с помощью наборов компании Cloud-Clone Corp.).
Тестикулярный антиген, противоопухолевый иммунитет, ксеногенная вакцинация
Короткий адрес: https://sciup.org/140303548
IDR: 140303548 | УДК: 616-006:575.117.2:615.37]-092.9 | DOI: 10.21294/1814-4861-2023-22-6-111-120
Текст научной статьи Использование ксеногенных тестикулярных антигенов в индукции противоопухолевых реакций
Разработка эффективных препаратов с селективным противоопухолевым действием представляется проблематичной по причине схожести биохимических процессов, протекающих в нормальных и опухолевых клетках [1]. Вместе с тем, клетки тканей организма и опухолевые клетки различаются своими поверхностными структурами [2, 3]. Все опухолеассоциированные антигены разделяются на две группы. Первая группа включает в себя вирусные и мутантные антигены, вторая группа ‒ дифференцировочные антигены, которые экспрессируются как на клетках здоровых тканей, так и на опухолевых клетках [4]. Так называемые тестикулярные антигены (ТАГ), продукты MAGEA1, MAGE-A3, MAGE-A4, NY-ESO-1, PRAME, CT83, SSX2 и других генов – специфичные для сперматозоидов белки, которые могут быть связаны с мембраной клетки и находиться в растворимой форме в пределах тканей яичка, оболочки которого непроницаемы для миграции клеток. ТАГ практически не экспрессируются нормальными клетками, исключение составляют клетки яичка и плаценты. В норме организм человека толерантен к ТАГ, но при нарушении целостности оболочек яичка эти АГ, попадая в кровоток, индуцируют в организме появление аутоиммунных реакций, направленных на элиминацию их из организма. Многими исследователями показано, что ТАГ высоко экспрессируются в клетках опухоли печени, молочной железы, поджелудочной железы, кишечника, легких и др. [5–7]. Исходя из этого, для индукции специфических противоопухолевых реакций и генерации опухолеспецифичных TAГ in vivo в настоящее время разрабатываются ДНК, мРНК и пептидные вакцины [8]. Несмотря на многообещающие результаты доклинических исследований, противоопухолевая эффективность вакцин на основе TAГ в клинических испытаниях ограничена, что может быть частично объяснено их слабой иммуногенностью, низкой эффективностью процессов доставки и презентации антигена, а также супрессорным опухолевым микроокружением, подавляющим иммунные реакции. Использование ксеногенного варианта ТАГ в качестве вакцины будет способствовать усилению иммуногенности материала и нацелено на формирование эффекторного звена иммунитета, направленного на ТАГ, представленные на собственных опухолевых клетках. Возможность использования ксеногенных ТАГ обосновывается следующими соображениями. Характерной особенностью генов TAГ является высокая внутри- и межвидовая гомология. Так, в геномах человека, приматов и грызунов идентифицирована гомология генов семейства MAGE, SSX, идентичность ортологических последовательностей которых составляла 40–80 % [9]. Экспериментальные данные свидетельствуют о том, что иммунизация организма ксеногенными аналогами эндогенных молекул может приводить к индукции иммунологических реакций к собственным АГ, к которым организм исходно толерантен.
Цель исследования ‒ оценка продолжительности жизни мышей-опухоленосителей и параметров клеточного иммунитета при различных вариантах иммунизации мышей ТАГ барана.
Материал и методы
Животные
Мыши линии С57BL/6 получены из питомника НИИФиРМ им. Е.Д. Гольдберга, Томский НИМЦ.
Характеристика опухолевых линий
Карцинома LLC
Культура клеток состоит из полиморфных клеток, большинство которых имеет округлую форму. Значительная часть клетки занята ядром с крупными ядрышками и крупными конденсированными зернами хроматина. Фигуры митозов наблюдаются в 36,7 % клеток. Цитоплазма не гомогенная. В ДНК определено наличие генов mage А-1, GP100, тирозиназы, her2/neu, раково-эмбрионального антигена, на мембране клеток определены рецепторы тирозиназы и GP100.
Меланома В16
Культура представлена двумя типами клеток: эпителиоидные – 23,3 %, фибробластоподобные – 76,7 %. Эпителиоидные клетки имеют полиморфное строение, ядерно-цитоплазматическое соотношение смещено в сторону цитоплазмы. Хроматин в ядре слабо конденсирован, распределен равномерно. Фигур митоза не наблюдается. Цитоплазма не гомогенная. Фибробластоподобные клетки имеют полиморфное строение. Значительная часть клетки занята ядром с мелкоконденсированными зернами хроматина. Фигуры митоза наблюдаются крайне редко. 43,5 % клеток содержат пигмент. В ДНК определено наличие генов mage А-1, GP100, тирозиназы, her2/neu, раково-эмбрионального антигена , на мембране клеток определены рецепторы Her2/neu, тирозиназы и GP100.
Опухолевые линии поддерживались пассированием in vitro в среде RPMI 1640 c добавлением 10 % сыворотки плодов коров, L-глютамина в условиях 100 % влажности и содержанием 5 % СО2. Рост опухолей в виде солидных образований фиксировался при введении 1×105 клеток/мышь подкожно.
В качестве вакцинальных АГ использованы:
-
1. Ксеногенный (по отношению к мышам) ТАГ барана, сингенный (мышиный ТАГ), спле-ноциты барана
-
2. Антигены, приготовленные из опухолевых линий LLC и В16
Клетки яичка и селезенки были выделены из кусочков ткани в охлажденную среду с использованием стеклянного гомогенизатора, недиссоциированные клеточные конгломераты удаляли центрифугированием. Клетки фиксировали 1 % раствором параформальдегида в течение 15 мин, трижды отмывали центрифугированием от консерванта, подсчитывали клеточность и хранили в замороженном состоянии. Для экспериментов образцы размораживали и использовали в концентрации 5×106 клеток/мышь в 200 мкл физиологического раствора.
Клетки опухолевых линий были зафиксированы 1 % раствором параформальдегида и заморожены. После разморозки использовались в экспериментах в различных концентрациях.
Терапевтический вариант вакцинации (привитие опухоли, затем вакцинация)
Мышам прививали 105 кл/мышь клетки карциномы LLC или меланомы В16. На 7-й и 14-й день после введения опухолевых клеток проводили вакцинацию мышей различными видами АГ (ксеногенный, сингенный) путем введения 2,5 млн вакцинальных клеток в область паховых лимфоузлов с двух сторон (5 млн клеток/мышь), далее фиксировали продолжительность жизни. В каждой группе было по 10 мышей.
Профилактический вариант вакцинации (вакцинация, затем привитие опухоли)
Мышей вакцинировали 2 раза с периодичностью в 7 дней различными видами АГ (ксеногенный, сингенный) путем введения вакцинальных клеток в область паховых лимфоузлов (5 млн клеток/мышь). Через 28 дней после начала вакцинации мышам вводили подкожно 105 кл/мышь клетки карциномы LLC или меланомы В16 и далее фиксировали продолжительность жизни. В каждой группе было по 10 мышей.
Для исследования параметров иммунитета в различных экспериментальных ситуациях и после инокуляции опухолевых клеток линий В16 и LLC мышам на 14-е сут у них забирались селезенка и сыворотка крови. Клеточную суспензию получали из селезенки методом мягкого выдавливания из кусочков ткани в охлажденную среду с использованием стеклянного гомогенизатора, недиссоциированные клеточные конгломераты осаждали путем отстаивания в течение 2–3 мин. Собранный надосадок 2-кратно отмывали центрифугированием, полученную фракцию клеток разводили средой RPMI в концентрации 1–2×106/мл и использовали в тестах.
Пролиферативный тест
Клетки селезенки (106/мл) культивировали в присутствии 5 мгк/мл КонА и АГ, полученного из клеток опухолевых линий LLC и B16 в концентрации 1×106 кл/мл и 2×106 кл/мл в течение 72 ч. По окончании культивирования планшеты центрифугировали 5 мин при 1000 g, 4 °C, затем удаляли надосадок и в каждую лунку добавляли 50 мкл МТТ-реагента (набор MTT-assay kit (cell proliferation), Abcam). После культивирования в течение 3 ч в условиях CO2-инкубатора к пробам добавляли растворитель МТТ. Через 15 мин пребывания планшета на орбитальном шейкере степень окрашивания лунок регистрировали на планшетном ридере при длине волны 490 нм и выражали в оптических единицах – о.е. Интенсивность окрашивания была пропорциональна количеству живых клеток в лунках.
Определение концентрации IFN-gamma и IL-10
Цитокины были измерены в сыворотке крови экспериментальных мышей методом ELISA с помощью наборов компании Cloud-Clone Corp. согласно инструкции производителя.
Статистическая обработка результатов
Представленные в статье данные получены в условиях одного эксперимента, количество образцов или животных (n) указано в подписи к рисунку. Результаты исследования подтверждены в двух экспериментах по выживанию мышей в условиях терапевтической вакцинации и в 3 однотипных экспериментах в условиях профилактической вакцинации. Эксперименты in vitro повторяли 2 раза. Статистическую обработку результатов проводили с помощью программы Graph prism 8, используя непараметрические критерии Манна–Уитни. Анализ выживаемости мышей проводился методом Каплана–Мейера, достоверность отличий показателей выживаемости регистрировалась с помощью long-rank (Mantel–Cox) test.
Результаты
Трудность лечения злокачественных новообразований (ЗНО) в основном связана с проблемой эффективного распознавания организмом опухолевых клеток, которые по структуре мало чем отличаются от клеток здоровых тканей. Во взрослом здоровом организме дифференцировочные ТАГ, экспрессирующиеся только в клетках яичка, являются специфическими маркерами опухолей разного генеза и играют важную роль в поддержании высокой ростовой и инвазивной активности опухолевых клеток. Согласно нашей гипотезе, при иммунизации ксеногенными ТАГ у мышей будут формироваться иммунные реакции, направленные не только на вводимый АГ, но и перекрестным образом на имеющиеся в организме опухолевые клетки, если они несут на своей поверхности какие-либо ТАГ. Для этого параметры иммунитета были исследованы у вакцинированных ксеногенными (по отношению к линии мышей) ТАГ барана. Мышей вакцинировали 2 раза, с интервалом в 7 дней (рис. 1). Через 14 дней после последней иммунизации у мышей забирали селезенки и спленоциты культивировали 72 ч в присутствии АГ, полученного из клеток опухолевых линий В16 и LLC в двух концентрациях: 1×105 кл/ лунка и 2×105 кл/лунка (или без них в контроле). В качестве неспецифического активатора был использован конканавалин А (КонА). Зарегистрировано достоверное увеличение пролиферации клеток селезенки в ответ на все используемые варианты опухолевых АГ. Высота ответа была сравнима с неспецифической стимуляцией митогеном КонА. Таким образом, вакцинация мышей ТАГ барана приводит к формированию в организме животного популяции лимфоцитов, перекрестным образом реагирующих на опухолевые АГ. В следующей серии экспериментов, представленных на рис. 2 и 3, мышей вакцинировали 2 раза с интервалом в 7 дней ксеногенными (обозначение группы В на рис. 2 и 3) и сингенными ТАГ (обозначение группы С на рис. 2 и 3). Контролем вакцинации служила группа мышей, которым вводили физиологический раствор (группа А на рис. 2 и 3). Через 14 дней после последней вакцинации мышам прививали клетки опухолевых линий LLC (рис. 2) и В16 (рис. 3). Для оценки влияния опухолевого процесса на величину и перекрестную реактивность иммунного ответа мышей выводили из эксперимента на 14-й день после введения опухолевых клеток и оценивали пролиферацию спленоцитов на опухолевые АГ, полученные из В16 и LLC, для чего спленоциты культивировали 72 ч в присутствии АГ в концентрациях 1×105 кл/лунка и 2×105 кл/лунка (или без них в контроле). С помощью такого экспериментального
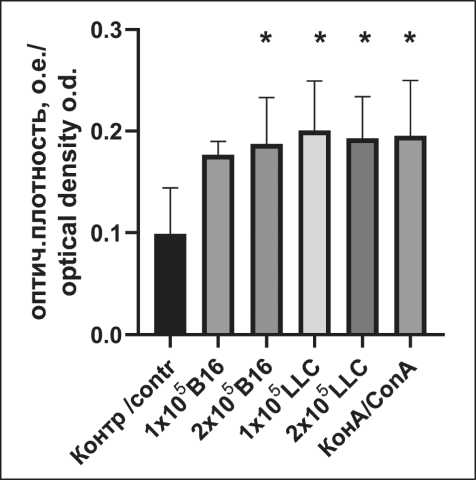
Рис. 1. Пролиферативный ответ спленоцитов мышей (n=5), полученных от предварительно вакцинированных тестикулярными АГ барана животных.
В качестве АГ – В16 и LLC в 1×106 кл/мл и 2×106 кл/мл и неспецифический стимулятор – КонА (5 мг\мл). * – р<0,05. Примечание: рисунок выполнен авторами
Fig. 1. Proliferative response of splenocytes obtained from mice (n=5) pre-vaccinated with ram TAGs. B16 and LLC cells in different concentrations (1×106 cells/mL and 2×106 cells/mL) and non-specific activator – ConA (5 mg/mL).
* – р<0.05. Note: created by the authors
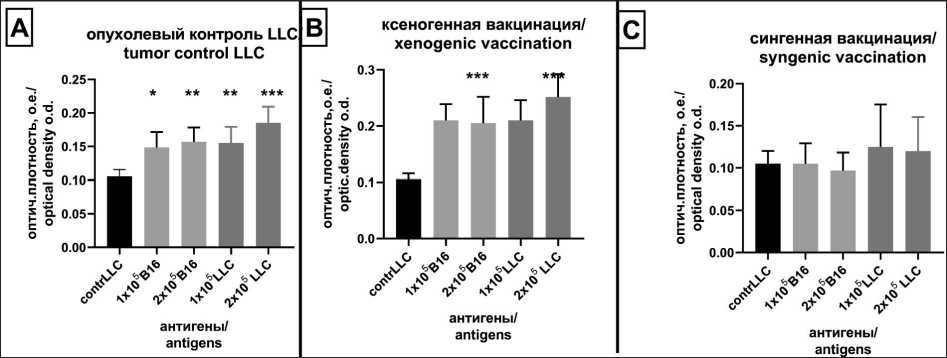
Рис. 2. Пролиферация лимфоцитов селезенки мышей (n=6), полученных от носителей карциномы LLC (А) через 14 дней после введения опухолевых клеток в режиме профилактического варианта вакцинации. Профилактическая вакцинация ксеногенными (В) и сингенными (С) ТАГ. Контроль – без добавления АГ. Антигены, полученные из клеток опухолевых линий В16 и LLC в концентрациях 1×106 кл/мл и 2×106 кл/мл. * – р<0,05, ** – р<0,005, *** – р<0,0001. Примечание: рисунок выполнен авторами
Fig. 2. Proliferation of mice splenocytes obtained from LLC tumor-bearing mice (n=6) 14 days after administration of tumor cells in the prophylactic vaccination mode (A). Prophylactic vaccination with xenogenic (B) and syngenic (C) TAG. Control: without addition of AG. Antigens were obtained from В16 and LLC tumor cells and added in an amount of 1×106 cells/mL and 2×106 cells/mL.
* – р<0.05, ** – р<0.005, *** – р<0.0001. Note: created by the authors
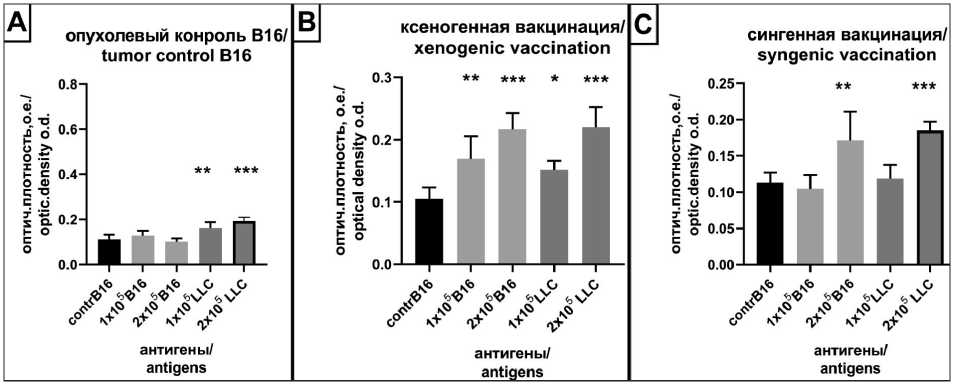
Рис. 3. Пролиферация лимфоцитов селезенки мышей (n=6), полученных от носителей меланомы В16 (А) через 14 дней после введения опухолевых клеток в режиме профилактического варианта вакцинации. Профилактическая вакцинация ксеногенными (В) и сингенными (С) тестикулярными АГ. Контроль – без добавления АГ. Антигены, полученные из клеток опухолевых линий В16 и LLC в концентрациях 1×106 кл/мл и 2×106 кл/мл. * – р<0,05, ** – р<0,005, *** – р<0,0001.
Примечание: рисунок выполнен авторами
Fig. 3. Proliferation mice splenocytes obtained from B16 tumor-bearing mice (n=6) 14 days after administration of tumor cells in the prophylactic vaccination mode (A). Prophylactic vaccination with xenogenic (B) and syngenic (C) TAG. Control: without addition of AG.
Antigens were obtained from В16 and LLC tumor cells and added in an amount of 1×106 cells/mL and 2×106 cells/mL.
* – р<0.05, ** – р<0.005, *** – р<0.0001. Note: created by the authors
подхода мы исследовали параметры клеточного иммунитета в условиях начала развития опухолевой болезни. Обнаружено достоверное увеличение пролиферативной активности спленоцитов в ответ на опухолевые АГ у мышей с карциномой LLC, которые не были иммунизированы (контроль LLC-0,1 о.е., при добавлении АГ: + 1×105 В16-0,14 о.е. (р=0,004), + 2×105 В16-0,15 о.е. (р=0,002), + 1×105 LLC-0,15 о.е. (р=0,004), + 2×105 LLC-0,19 о.е. (р=0,002). Спленоциты, полученные от предварительно вакцинированных ксеногенными ТАГ мышей, также отвечали пролиферацией в ответ на разные концентрации АГ, ответ достоверно отличался от неиммунизированного опухолевого контроля (контроль LLC-0,1 о.е., при добавлении АГ: + 1×105 В16-0,2 о.е. (р=0,002), + 2×105 В16-0,2 о.е.
(р=0,002), + 1×105 LLC-0,23 о.е. (р=0,004), + 2×105 LLC-0,26 о.е. (р=0,002). Интенсивность пролиферативного ответа спленоцитов при ксеногенной вакцинации была выше ответа, зафиксированного в условиях сингенной вакцинации, и в сравнении с ответом спленоцитов неиммунизированного опухолевого контроля (рис. 2). Аналогичная картина пролиферативного ответа зарегистрирована в модели мышей-носителей В16 (рис. 3). Нужно отметить, что у контрольных мышей-носителей опухолей LLC и В16 зафиксировано наличие в селезенке популяции лимфоцитов, реагирующей на опухолевые АГ, что говорит об иммуногенности прививаемых опухолевых клеток. Таким образом, было доказано, что при иммунизации мышей ксеногенным (но не сингенным!) ТАГ формируется популяция
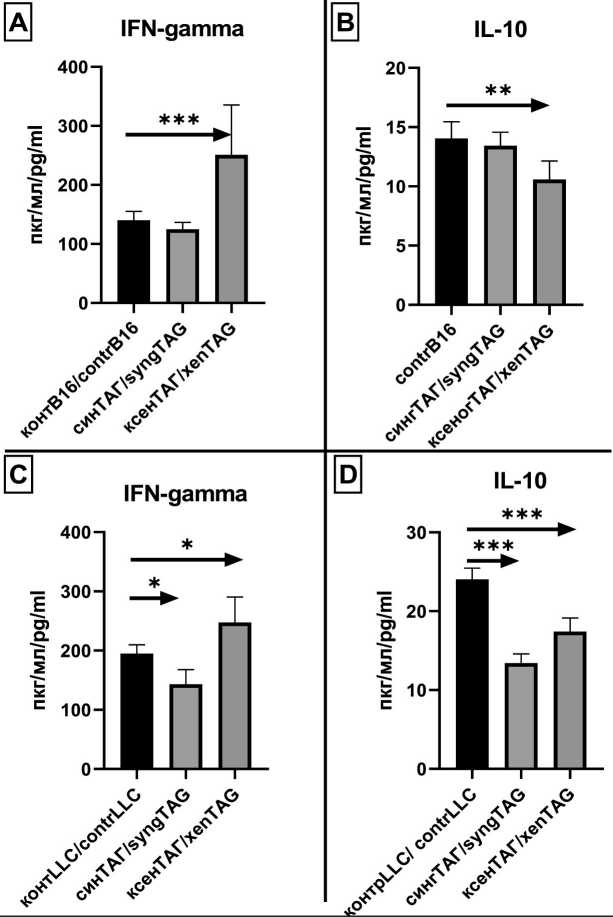
Рис. 4. Концентрация IFN-gamma и IL-10 в сыворотке крови мышей (n=6), подвергшихся профилактическому варианту вакцинации тестикулярной вакциной мышей с последующим введением клеток меланомы В16 (А, В) и карциномы LLC (C, D). Забор сыворотки на 14-е сут после введения опухолевых клеток. * – р<0,05, ** – р<0,005, *** – р<0,0001.
Примечание: рисунок выполнен авторами
Fig. 4. Concentration of IFN-gamma and IL-10 in blood serum of В16 melanoma (A, B) and LLC (C, D) mice (n=6) treated with prophylactic TAG vaccination. Serum sampling on day 14 after administration of tumor cells.
* – р<0.05, ** – р<0.005, *** – р<0.0001. Note: created by the authors лимфоцитов, которая реагирует перекрестным образом на опухолевые АГ по вторичному типу, и в организме вакцинированных мышей индуцируются реакции, позволяющие защищать животных от развития сингенных опухолей или способствующие замедлению роста опухолевой массы. В условиях ксеногенной вакцинации у опухоленосителей В16 и LLC (рис. 4) в сыворотке крови мышей, полученной на 14-е сут эксперимента, определена концентрация IFN-gamma и IL-10. Зафиксирован достоверно повышенный уровень IFN-gamma как у мышей-опухоленосителей В16 (рис. 4А), так и у мышей-опухоленоситей LLC (рис. 4С). Значения IFN-gamma у мышей-опухоленосителей в сингенном варианте вакцинации не были повышены. Отмечено также достоверное снижение продукции IL-10 в ксеногенном варианте предварительной иммунизации (рис.
дни/days
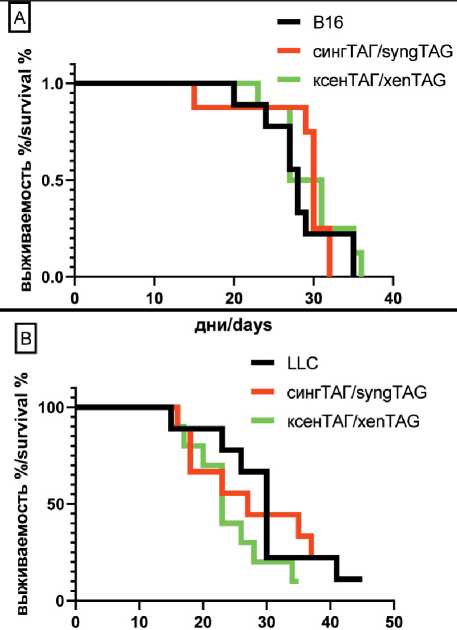
Рис. 5. Выживаемость мышей-опухоленосителей меланомы В16 (А) и карциномы LLC (В) в режиме терапевтической вакцинации. Мышам вводили клетки опухолевых линий В16 или LLC подкожно в концентрации 105 кл/ мышь. Через неделю с интервалом в 7 дней мышей дважды вакцинировали ксеногенным (ксеног ТАГ ) или сингенным (сингенн ТАГ) тестикулярным АГ п/к в 2 точки (5 млн клеток/мышь), далее фиксировали продолжительность жизни мышей. В контрольной группе мышей (В16 и LLC) вакцинации не проводилось.
В каждой группе было по 10 мышей.
Примечание: рисунок выполнен авторами
Fig. 5. Survival of B16 melanoma (A) and LLC (B) tumor- bearing mice with therapeutic vaccination. Mice were subcutaneously injected with of B16 or LLC cells at a concentration of 105 cells/ mouse. A week later, at a 7-day interval, mice were subcutaneously vaccinated twice with xenogenous (xenogenic TAG) or syn-genic (syngeneTAG) testicular AG at 2 points (5mln cells/mouse), then the lifespan of the mice was recorded. No vaccination was performed in the mouse control group (B16 and LLC). There were 10 mice in each group.
Note: created by the authors
4В, D). Сингенный вариант вакцинации мышей с LLC даже сопровождался достоверным снижением концентрации IFN-gamma и IL-10 ниже значений, зафиксированных у мышей-опухоленосителей без вакцинации. Далее представлены результаты исследования in vivo по оценке продолжительности жизни мышей-опухоленосителей, иммунизированных ТАГ в терапевтическом и профилактическом варианте исследования на двух моделях опухолей-меланомы В16 и карциномы LLC. Терапевтический вариант иммунизации подразумевает следующие манипуляции: мышам вводят опухолевые клетки и через 14 дней начинают иммунизацию. Результат иммунизации оценивают по изменению продолжительности жизни мышей-опухоленосителей. На рис. 5 представлена кривая выживаемости мышей с привитой им карциномой LLC или меланомой В16.
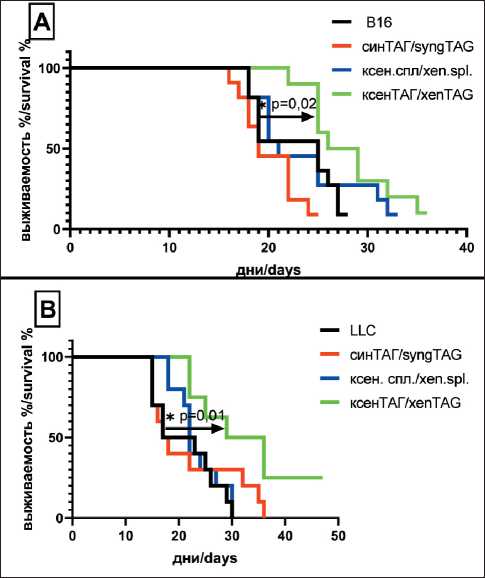
Рис. 6. Выживаемость мышей-опухоленосителей меланомы В16 (А) и карциномы LLC (В) в режиме профилактической вакцинации. Мышей вакцинировали ксеногенным (ксеног ТАГ), сингенным (сингеннТАГ) тестикулярным АГ и АГ, полученным из клеток селезенки барана (ксеног. спленоциты) 2 раза с интервалом в 7 дней п/к в 2 точки (5 млн клеток/мышь), через 14 дней после последней вакцинации мышам вводили клетки опухолевых линий В16 или LLC п/к в концентрации 105 кл/ мышь, далее фиксировали продолжительность жизни. В контрольной группе мышей (В16 и LLC) вакцинации не проводилось. В каждой группе было по 10 мышей,
* – р<0,05. Примечание: рисунок выполнен авторами
Fig. 6. Survival of B16 (A) and LLC (B) tumor-bearing mice with prophylactic vaccination. Mice were vaccinated with xenogenous (xenog TA), syngenic (syngennTA) testicular AG and AG derived from ram spleen cells (xenog.splenocytes) 2 times with an interval of 7 days in 2 points (5mln cells/mouse), 14 days after the last vaccination, mice were injected with B16 or LLC cells subcutaneously at a concentration of 105 cells/mouse, then the lifespan was fixed. No vaccination was performed in the mouse control group
(B16 and LLC). There were 10 mice in each group, * – р<0,05. Note: created by the authors
Процесс иммунизации мышей ТАГ ксеногенного или сингенного происхождения не повлиял на продолжительность жизни мышей-опухоленосителей LLC и В16. На рис. 6 представлены кривые выживаемости мышей-опухоленосителей меланомы В16 (А) и карциномы LLC(В), полученные в результате выполнения профилактического варианта вакцинации мышей. В качестве контрольных АГ были использованы клетки селезенки барана и клетки яичка мышей. Наиболее значимые результаты были получены в модели карциномы LLC. При вакцинации ксеногенными ТАГ продолжительность жизни мышей-опухоленосителей LLC достоверно увеличилась на 60 % (медиана жизни мышей-опухоленосителей – 20 дней, при введении ксеногенных ТАГ – 32,2 дня). Изменения продолжительности жизни мышей контрольных групп и невакцинированных опухоленосителей не зарегистрировано. Обнаружено достоверное увеличение продолжительности жизни и у мышей-опухоленосителей меланомы В16, однако это увеличение продолжительности жизни было не столь значительным.
Обсуждение
Заключение
Иммунизация ксеногенным ТАГ может приводить к формированию протективного противоопухолевого ответа, направленного перекрестным образом на собственные опухоль-ассоциированные АГ, что проявляется терапевтическим эффектом, выражающимся в увеличении продолжительности жизни мышей-опухоленосителей.
Список литературы Использование ксеногенных тестикулярных антигенов в индукции противоопухолевых реакций
- Christof T., Baritaki S., Falzone L., Libra M., Zaravinos A. Current Perspectives in Cancer Immunotherapy. Cancers (Basel). 2019; 11(10): 1472. https://doi.org/10.3390/cancers11101472.
- Quail D.F., Joyce J.A. Microenvironmental regulation of tumor progression and metastasis. Nat Med. 2013; 19(11): 1423-37. https://doi.org/10.1038/nm.3394.
- Klemm F., Joyce J.A. Microenvironmental regulation of therapeutic response in cancer. Trends Cell Biol. 2015; 25(4): 198-213. https://doi.org/10.1016/j.tcb.2014.11.006.
- Gordeeva O. Cancer-testis antigens: Unique cancer stem cell biomarkers and targets for cancer therapy. Semin Cancer Biol. 2018; 53: 75-89. https://doi.org/10.1016/j.semcancer.2018.08.006.
- Gjerstorff M.F., Andersen M.H., Ditzel H.J. Oncogenic cancer/testis antigens: prime candidates for immunotherapy. Oncotarget. 2015; 6(18): 15772-87. https://doi.org/10.18632/oncotarget.4694.
- Strioga M.M., Darinskas A., Pasukoniene V., Mlynska A., Ostapenko V., Schijns V. Xenogeneic therapeutic cancer vaccines as breakers of immune tolerance for clinical application: to use or not to use? Vaccine. 2014; 32(32): 4015-24. https://doi.org/10.1016/j.vaccine.2014.05.006.
- Salmaninejad A., Zamani M.R., Pourvahedi M., Golchehre Z., Hosseini Bereshneh A., Rezaei N. Cancer/Testis Antigens: Expression, Regulation, Tumor Invasion, and Use in Immunotherapy of Cancers. Immunol Invest. 2016; 45(7): 619-40. https://doi.org/10.1080/08820139.2016.1197241.
- Ren S., Zhang Z., Li M., Wang D., Guo R., Fang X., Chen F. Cancer testis antigen subfamilies: Attractive targets for therapeutic vaccine (Review). Int J Oncol. 2023; 62(6): 71. https://doi.org/10.3892/ijo.2023.5519.
- Plaen E.D., Backer O.D., Arnaud D., Bonjean B., Chomez P., Martelange V., Avner P., Baldacci P., Babinet C., Hwang S.Y., Knowles B., Boon T. A New Family of Mouse Genes Homologous to the Human MAGE Genes. Genomics. 1999; 55(2): 176-84. https://doi.org/10.1006/geno.1998.5638.
- Zhang X., Cui H., Zhang W., Li Z., Gao J. Engineered tumor cellderived vaccines against cancer: The art of combating poison with poison. Bioact Mater. 2022; 22: 491-517. https://doi.org/10.1016/j.bioactmat.2022.10.016.
- Welters M.J., van der Sluis T.C., van Meir H., Loof N.M., van Ham V.J., van Duikeren S., Santegoets S.J., Arens R., de Kam M.L., Cohen A.F., van Poelgeest M.I., Kenter G.G., Kroep J.R., Burggraaf J., Melief C.J., van der Burg S.H. Vaccination during myeloid cell depletion by cancer chemotherapy fosters robust T cell responses. Sci Transl Med. 2016; 8(334). https://doi.org/10.1126/scitranslmed.aad8307.
- Mazzarella L., Duso B.A., Trapani D., Belli C., D’Amico P., Ferraro E., Viale G., Curigliano G. The evolving landscape of ‘nextgeneration’ immune checkpoint inhibitors: A review. Eur J Cancer. 2019; 117: 14-31. https://doi.org/10.1016/j.ejca.2019.04.035.
- Mariathasan S., Turley S.J., Nickles D., Castiglioni A., Yuen K., Wang Y., Kadel E.E., Koeppen H., Astarita J.L., Cubas R., Jhunjhunwala S., Banchereau R., Yang Y., Guan Y., Chalouni C., Ziai J., Şenbabaoğlu Y., Santoro S., Sheinson D., Hung J., Giltnane J.M., Pierce A.A., Mesh K., Lianoglou S., Riegler J., Carano R.A.D., Eriksson P., Höglund M., Somarriba L., Halligan D.L., van der Heijden M.S., Loriot Y., Rosenberg J.E., Fong L., Mellman I., Chen D.S., Green M., Derleth C., Fine G.D., Hegde P.S., Bourgon R., Powles T. TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature. 2018; 554(7693): 544-8. https://doi.org/10.1038/nature25501.
- You G., Kim Y., Lee J.H., Song J., Mok H. Exosome-modifed PLGA microspheres for improved internalization into dendritic cells and macrophages. Biotechnol Bioproc E. 2020; 25(4): 521-7. https://doi.org/10.1007/s12257-020-0008-7.
- Palena C., Schlom J. Vaccines against human carcinomas: strategies to improve antitumor immune responses. J Biomed Biotechnol. 2010. https://doi.org/10.1155/2010/380697.
- Seledtsov V.I., Shishkov A.A., Seledtsova G.V. Xenovaccinotherapy for cancer, current cancer treatment - Novel Beyond Conventional Approaches, Öner Özdemir (Ed.). InTech. 2011. 416-28. https://doi.org/10.5772/23671.
- Kraśko J.A., Žilionytė K., Darinskas A., Dobrovolskienė N., Mlynska A., Riabceva S., Zalutsky I., Derevyanko M., Kulchitsky V., Karaman O., Fedosova N., Symchych T.V., Didenko G., Chekhun V., Strioga M., Pašukonienė V. Post-operative unadjuvanted therapeutic xenovaccination with chicken whole embryo vaccine suppresses distant micrometastases and prolongs survival in a murine Lewis lung carcinoma model. Oncol Lett. 2018; 15(4): 5098-104. https://doi.org/10.3892/ol.2018.7950.
- Huang C.P., Wu C.C., Shyr C.R. Combination of novel intravesical xenogeneic urothelial cell immunotherapy and chemotherapy enhances antitumor efcacy in preclinical murine bladder tumor models. Cancer Immunol Immunother. 2021; 70(5): 1419-33. https://doi.org/10.1007/s00262-020-02775-6.
- Usha L., Klapko O., Edassery S. Xenogeneic fbroblasts inhibit the growth of the breast and ovarian cancer cell lines in co-culture. Neoplasma. 2021; 68(6): 1265-71. https://doi.org/10.4149/neo_2021_210226N252.


