Использование лабораторного метода определения адренореактивности при сочетанных нарушениях функций тазовых органов у детей
Автор: Никитин Сергей Сергеевич, Казак Лилия Романовна, Ширяева Анна Николаевна, Долгова Валентина Юрьевна, Шевченко Нина Григорьевна, Чудецкая Светлана Александровна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 2 (123), 2012 года.
Бесплатный доступ
У детей с сочетанными нарушениями функций тазовых органов (гиперактивный мочевой пузырь и запоры) исследование состояния вегетативной нервной системы представляет определенные трудности. Наряду с общепринятыми методиками внедрен разработанный Р. И. Стрюк и И. Г. Длусской лабораторный метод определения адренореактивности организма. У детей данная методика использована впервые. Предложены нормативные показатели и выявлен высокий уровень активности симпатической нервной системы у детей с сочетанными нарушениями функций тазовых органов.
Дети, гиперактивный мочевой пузырь, запоры, сочетанные нарушения функций тазовых органов, адрено-реактивность
Короткий адрес: https://sciup.org/14750101
IDR: 14750101 | УДК: 617-053.2
Текст научной статьи Использование лабораторного метода определения адренореактивности при сочетанных нарушениях функций тазовых органов у детей
Нарушения акта мочеиспускания и функции толстой кишки в детском возрасте – довольно распространенная и не всегда быстро поддающаяся лечению проблема. В возрастной группе 4–7 лет нарушения акта мочеиспускания встречаются у 20 % детского населения, а при достижении 14-летнего возраста их остается 2 % [2]. В среднем от 8 до 14 % детей всех возрастов страдают нарушениями акта мочеиспускания, в 80 % наблюдений их причиной является гиперактивный мочевой пузырь [14]. Запоры с энкопрезом или без него наблюдаются у 3 % дошкольников и у 1–2 % школьников. У 95 % детей, обратившихся по поводу запоров, не выявляется органического заболевания [5], [20]. В понятие «гиперактивный мочевой пузырь» (ГАМП) входят такие симптомы, как энурез, императивные позывы, императивное неудерживание мочи и поллакиурия [2], [9]. Дети с симптомами ГАМП обращаются за медицинской помощью к врачам различного профиля, точки зрения которых по поводу одних и тех же расстройств мочеиспускания не всегда совпадают. Это касается этиопатогенеза, терминологии, объема обследования, последо- вательности применения диагностических методов, трактовки полученных данных, формулирования заключения и, что является наиболее важным, фармакотерапии ГАМП. Поскольку этиология и патогенез ГАМП до конца не ясны, лечение является симптоматическим и направлено на увеличение резервуарной функции мочевого пузыря и угнетение незаторможенных сокращений детрузора в фазу накопления. Для этих целей используется большое число препаратов: М-холинолитики (дриптан, детрузитол, спазмекс, солифенацин), альфа1-адреноблокато-ры (кардура, дальфаз), а также пикамилон, пантогам, финибут, мезокарб, пирацетам, минирин, аминокислоты (таурин, глицин) и др. Показания к применению указанных препаратов в конкретной клинической ситуации сплошь и рядом носят неопределенный характер. Традиционно препаратами первого ряда являются М-холино-литики, поскольку именно функцией М-холи-норецепторов определяются такие свойства мочевого пузыря, как способность поддерживать постоянное низкое давление и возможность накапливать определенный объем. Но тем не ме-
нее анализ применения антимускариновой терапии не оставляет сомнений в том, что проблема фармакологического лечения ГАМП далека от окончательного решения. ГАМП у детей является следствием гипоталамо-гипофизарной дисфункции. Следовательно, в его происхождении, помимо парасимпатической, не исключено участие симпатической нервной системы. Основной мишенью для симпатической нервной системы является сосудистая система мочевого пузыря. Имеются сообщения о вовлечении сосудистой системы в патогенез ГАМП у детей и обоснование его лечения альфа1-адреноблокаторами [1], [2], [3], [4], [7], [15], [17], [18], [19], [21]. Вероятно, что спазм сосудов микроциркуляторного русла и вызванная им ишемия детрузора нарушают функцию холинорецепторов и обусловливают появление дезадаптации и снижение функционального объема мочеиспускания.
В настоящее время стали появляться работы об участии симпатической гиперактивности и в формировании хронического колостаза [5].
В связи с тем что почти у половины детей ГАМП сочетается с запорами, представляется логичным, что и при ГАМП, и при хронических запорах первичной является симпатическая гиперактивность. Для уточнения данной гипотезы особый интерес представляет исследование вегетативной нервной системы (ВНС) у детей с сочетанными нарушениями функций тазовых органов.
Во взрослой практике известен достаточно точный лабораторный метод определения адренореактивности организма, который применяется преимущественно в кардиологической практике, но пока еще не получил широкого распространения. Это экспресс-метод определения адренореактивности организма – исследование адренореактивности мембран эритроцитов (АРМ), который разработан и внедрен Р. И. Стрюк и И. Г. Длусской в 1995 году [12]. Авторы, обследуя достаточно большую группу здоровых пациентов старше 18 лет, сделали вывод, что границей физиологической нормы АРМ является показатель 2–20 усл. ед., причем он стабилен в условиях привычного режима труда и отдыха. Выполнялись различные тесты в группах здоровых людей и лиц, страдающих гипертонической болезнью. Так, при проведении психоэмоциональных тестов показано, что величина АРМ, возрастая, адекватно отражает активность симпатоадреналовой системы, что подтверждается прямыми положительными корреляциями между частотой сердечных сокращений, артериальным давлением и АРМ. Показана связь между синдромом ранней реполяризации желудочков сердца (СРРЖ) и АРМ: у пациентов с СРРЖ показатель АРМ в среднем выше нормы и составляет 34,3 усл. ед. Заслуживает внимания исследование АРМ в условиях операционного стресса. Авторы исследовали пульс, артериальное давление и АРМ при проведении дистанционной литотрипсии у пациен- тов с мочекаменной болезнью. По полученным результатам АРМ (6–75 усл. ед.) пациентов разделили на 3 группы (1-я – АРМ до 20 усл. ед., 2-я – 20–40 усл. ед., 3-я – более 40 усл. ед.); соответственно, показатели пульса и артериального давления в 3-й группе исходно выше, чем в 1-й и 2-й. Отмечено, что выраженность психоэмоциональных реакций, гиперемия кожи, мышечная дрожь, а также экстрасистолия нарастали по мере увеличения показателя АРМ, и если в 1-й группе экстрасистолы отмечены у 25 % пациентов, то в 3-й группе – практически у всех. При этом в 3-й группе нарушения сердечного ритма носили сложный характер: встречались политопные и групповые экстрасистолы. Таким образом, показана прогностическая роль АРМ в развитии аритмий в условиях психоэмоционального стресса. Представляет интерес прогностическая значимость АРМ у больных с острым коронарным синдромом. Так, у пациентов с инфарктом миокарда при низкой АРМ высока вероятность развития осложнений или рецидива заболевания вследствие высокой чувствительности адренорецепторов к катехоламинам. При нестабильной стенокардии низкие показатели АРМ, напротив, являются благоприятным прогностическим критерием, косвенно указывая на роль других механизмов, исключающих значение высокой активности симпатоадреналовой системы [12]. Эту методику определения адренореактивности организма мы решили использовать у детей с сочетанными нарушениями функций тазовых органов как дополнение к общепринятым способам определения состояния ВНС.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Определение адренореактивности лабораторным методом выполнено 80 детям 4–15 лет (44 мальчика, 36 девочек). Из них 54 ребенка – это дети с сочетанными нарушениями функций тазовых органов, 26 детей составили контрольную группу. Дети с сочетанными нарушениями функций тазовых органов обследованы всесторонне: проведено урологическое, проктологическое и неврологическое обследование, в том числе исследование вариабельности сердечного ритма, при котором у всех детей группы выявлено гиперактивное состояние симпатической нервной системы. Дети контрольной группы – практически здоровые дети, им выполнялось исследование вариабельности сердечного ритма, при котором получены нормальные результаты, указывающие на хорошие адаптационные возможности сердечно-сосудистой системы.
Опишем методику определения адренореактивности. Метод основан на факте, что адреномиметики и адреноблокаторы, связываясь с адренорецепторами эритроцитов человека, изменяют степень гипоосмотического гемолиза. Сущность метода заключается в количественной оценке степени ингибирования гипоосмотичес-кого гемолиза эритроцитов в присутствии адреноблокатора. В контрольной пробе эритроциты в гипоосмотической среде частично гемолизируются, степень гемолиза измеряют колориметрическим способом. В опытной пробе, содержащей в гипоосмотической среде адреноблокатор, эритроциты гемолизируются в меньшей степени вследствие связывания адреноблокатора клеточными рецепторами. Поэтому после осаждения центрифугированием негемолизированных клеток надосадочный слой в опытной пробе окрашен слабее, чем в контрольной [12].
Этапы определения адренореактивности организма по величине АРМ (по [12])
|
Реактивы и этапы проведения анализа |
Контрольная проба, мл |
Опытная проба, мл |
||
|
Номер пробирки |
||||
|
1 |
2 |
3 |
4 |
|
|
Буферный раствор |
2,5 |
2,5 |
2,5 |
2,5 |
|
Раствор адреноре-активного вещества |
– |
– |
0,1 |
0,1 |
|
Дистиллированная вода |
0,1 |
0,1 |
– |
– |
|
Перемешать |
||||
|
Образец крови, разбавленной 1 : 1 |
0,05 |
0,05 |
0,05 |
0,05 |
Перемешать без пенообразования Инкубировать 15 минут при комнатной температуре Перемешать без пенообразования Инкубировать 15 минут при комнатной температуре Центрифугировать 10 минут при 1500 об./мин.
Надосадочный слой переносят в кювету фо- тометра и измеряют величину оптической плотности контрольных и опытных проб против физиологического раствора при длине волны 540
(500–560) нм в кювете с толщиной поглощающего свет слоя 10 или 5 мм. Величину АРМ рассчитывают по формуле:
E 01 + E 02
E K 1 + E K 2
АРМ
х 100 % ,
где АРМ – величина показателя адренореактивности, усл. ед.; Е01 и Е02 – оптические плотности опытных проб, ед. опт. плотн.; Ек1 и Ек2 – оптические плотности контрольных проб, ед. опт. плотн.
Повышение осморезистентности эритроцитов под влиянием адреноблокаторов можно связать с регуляцией Na/Н+- и Na/К+-обмена клетки. Ингибирование осмолиза эритроцитов зависит от количества функционально активных адренорецепторов на поверхности клеток и указывает на их адренореактивность. Эритроциты, отражая общие закономерности изменений мембранных и клеточных структур под действием катехоламинов, могут считаться адекватной моделью системных проявлений активности симпатоадреналовой системы [6], [8], [10], [11], [12], [13]. Это послужило основанием считать адренореактивность эритроцитов системным показателем адренореактивности организма.
Метод оценки адренореактивности организма по влиянию адреноблокатора на осморезистент- ность эритроцитов имеет следующие достоинства. Прежде всего он прост: определение АРМ с параллельными пробами у одного обследуемого выполняется одним лаборантом за 50 минут, серия анализов для 5 обследуемых – за 1,5 часа. Не требуется сложного оборудования и дорогостоящих реактивов. Результаты хорошо воспроизводимы: случайная погрешность метода, то есть различия между парными (параллельными определениями) составляет 0,33 ед. в группе со средней величиной АРМ 12,2 ед. (при расчете погрешности (S) по формуле: S =
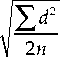
где d –
различие между параллельными определениями при n = 10 [12]).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данная методика у детей вообще и с сочетанными нарушениями функций тазовых органов в частности ранее описана не была. В нашей клинике определение адренореактивности мембран эритроцитов включено в программу обследования детей с сочетанными нарушениями функций тазовых органов с конца 2009 года. В нашей контрольной группе показатель адренореактивности составил 9,41 (1,5–18,8). Это позволяет предположить, что у детей норма АРМ практически не отличается от таковой у взрослых. У детей с сочетанными нарушениями функций тазовых органов показатель адренореактивности составил 49,73 (15,9–121,9) усл. ед. Дети с аритмиями и синдромом ранней реполяризации желудочков из исследования были исключены в связи с тем, что авторами методики показаны исходно высокие уровни АРМ у данной категории людей, а также с тем, что при наличии нарушений ритма сердца не проводилось исследование вариабельности сердечного ритма и возможности сопоставить результаты исследования симпатической нервной системы не было. Половых различий в контрольной группе и в группе детей с сочетанными нарушениями функций тазовых органов не отмечено: у мальчиков контрольной группы показатель адренореактивности составил 9,37 (1,5–18,8) усл. ед., у девочек – 9,46 (1,6–15,26) усл. ед., а в группе детей с сочетанными нарушениями функций тазовых органов у мальчиков показатель бета-адренореактивности – 49,04 (17,5– 104) усл. ед., у девочек – 50,6 (15–121,9) усл. ед.
Как видно из представленных данных, у детей с сочетанными нарушениями функций тазовых органов максимальные показатели АРМ превышают значения у взрослых. На основании полученных результатов можно предполагать наличие высокого уровня активности симпатической нервной системы у детей с сочетанными нарушениями функций тазовых органов, что в целом укладывается в современные представления о патогенезе тазовых нарушений, однако метод еще требует уточнения после увеличения количества наблюдений. Но в любом случае при сопоставлении с другими методами исследования вегетативной нервной системы у детей с сочетанными нарушениями функций тазовых органов удается получить схожие данные: высокая активность симпатического отдела вегетативной нервной системы при исследовании вариабельности сердечного ритма и низкие показатели тазового кровотока по данным реопельвиографии.
Таким образом, данная методика представляется пригодной для использования у детей. Складывается впечатление о ее высокой информативности в отношении диагностики симпатической гиперактивности при сочетанных нарушениях функций тазовых органов. Возможно, что на данном этапе изучения патогенеза сочетанных нарушений функций тазовых органов у детей полученные результаты исследования будут небольшим дополнением в пользу подтверждения гипотезы о наличии симпатической гиперактивности в широком смысле, одним из проявлений которой являются нарушения функций тазовых органов. В настоящее время методика
Р. И. Стрюк и И. Г. Длусской нами использована у детей с сочетанными нарушениями функций тазовых органов, но ее следует изучить и в отношении других патологических состояний.
ВЫВОДЫ
-
1. Определение АРМ у детей с сочетанными нарушениями функций тазовых органов является информативным исследованием симпатической нервной системы.
-
2. В качестве нормативных показателей АРМ у детей можно принять 1,5–18,8 усл. ед.
-
3. Результаты исследования АРМ у детей с сочетанными нарушениями функций тазовых органов позволяют подтвердить гипотезу о наличии симпатической гиперактивности у данной категории больных.
-
4. В совокупности с другими методами исследования вегетативной нервной системы определение АРМ может быть рекомендовано к применению у детей с дисфункциями тазовых органов; следствием этого должен стать правильный выбор лечебной тактики.
Список литературы Использование лабораторного метода определения адренореактивности при сочетанных нарушениях функций тазовых органов у детей
- Вишневский Е. Л. Диагностика и лечение нейрогенных дисфункций мочевого пузыря у детей//Педиатрия. 1997. № 3. С. 42-44.
- Вишневский Е. Л. Гиперактивный мочевой пузырь//Пленум правления Российского общества урологов. Тюмень, 24-27 мая 2005 г. Тюмень, 2005. С. 322-343.
- Вишневский Е. Л., Джерибальди О. А. Лечение гиперактивного мочевого пузыря у детей альфа-адрено-блокатором кардурой//Пленум правления Российского общества урологов. Тюмень, 24-27 мая 2005 г. Тюмень, 2005. С. 371.
- Вишневский Е. Л., Джерибальди О. А. Роль нарушения пузырного кровообращения в патогенезе ГАМП у детей//Пленум правления Российского общества урологов. Тюмень, 24-27 мая 2005 г. Тюмень, 2005. С. 370.
- Ленюшкин А. И., Ким Л. А., Рыжов Е. А., Цапкин А. Е. Эволюция взгляда на этиопатогенез хронических запоров у детей//Детская хирургия. 2009. № 6. С. 48-50.
- Лукьянова Л. Д., Курлаев С. Н. О роли норадреналина в регуляции окислительного метаболизма миокарда крыс с разной резистентностью к гипоксии//Бюллетень экспериментальной биологии и медицины. 1992. № 12. С. 586-588.
- Никитин С. С., Бережанская Т. И., Елагина Р. А. Новые направления диагностики и лечения нейрогенных дисфункций мочевого пузыря у детей//Медицинский академический журнал. 2005. Т. 5. № 2., прил. 6. С. 163-165.
- Постнов Ю. В. О мембранной концепции первичной артериальной гипертонии (к развитию представлений о природе гипертонической болезни)//Кардиология. 1985. № 10. С. 63-71.
- Пугачев А. Г., Кудрявцев Ю. В., Павлов А. Ю., Князькина О. М. Гиперактивный мочевой пузырь и морфологические изменения его слизистой оболочки у детей//Пленум правления Российского общества урологов. Тюмень, 24-27 мая 2005 г. Тюмень, 2005. С. 397-398.
- Сапрыгин Д. Б., Серов Р. А., Каштэлян Л. С. и др. Реализуется ли повреждающее действие катехоламинов на миокард через гиперстимуляцию бета-адренорецепторов?//Бюллетень экспериментальной биологии и медицины.1984. № 8. С. 175-177.
- Свиридова Е. В., Щеголева Т. И., Бахова Л. К., Васильев И. М. Молекулярно-клеточные аспекты прогноза течения острого инфаркта миокарда//Кардиология. 1993. Т. 33. № 11. С. 58-60.
- Стрюк Р. И., Длусская И. Г. Адренореактивность и сердечно-сосудистая система. М.: Медицина, 2003. С. 15-24.
- Ульянинский Л. С. Эмоциональный стресс и экстракардиальная регуляция//Физиологический журнал. 1994. Т. 80. № 2. С. 23-33.
- Урофлоуметрия. Справочное издание/Е. Л. Вишневский, Д. Ю. Пушкарь, О. Б. Лоран, В. В. Данилов, А. Е. Вишневский. М.: Печатный Город, 2004. 220 с.
- Ягафарова Р. К., Зубань О. Н. Альфа-адреноблокаторы (дальфаз) при нарушении резервуарной функции мочевого пузыря//Урология. 2001. № 3. С. 23-26.
- Allen J., Rasmussen H. Some effects of vasoactive hormones on the mammalian red blood cells//Prostaglandines in cellular biology. N. Y, 1972. P. 27-51.
- Athanasopoulos A., Gyfopoulos K. Combination treatment with an (α-blocker plus an anticholinergic for bladder outlet obstruction: a prospective, randomized, controlled study)//J. Urol. 2003. Vol. 169. P. 2253-2256.
- Cain M. P., Wu S. D., Austin P. F., Herndon C. D. Alpha blocker therapy for children with dysfunctional voiding and urinary retention//J. Urol. 2003. Vol. 170. P. 1514-1515.
- Golebiewski A. Selective α-blockers for treating dysfunctional voiding in children//XV ESPU Congress. Regenburg, 2004.
- Idiopathic constipation and soiling in children. Ann Arbor (MI)//University of Michigan Health System. 1997. Vol. 5.
- Petersen Th., Husted P. Sidenius Prazosin treatment of neurourological patients with detrusor hyperreflexia and bladder empting disability//Scand. J. Urol. Nephrol. 1989. Vol. 23. № 3. P. 189-194.


