Использование метода спектроскопии поверхностного внутреннего отражения для диагностики зерна кукурузы (Zea mays L.)
Автор: Раденови А.Н., Максимов Г.В., Курамшина Г.М., Шутова В.В., Хао Дж., Дели Н.С., Сечанский М.Д., Попови А.С., Баюк-Богданови Д.В., Радосавлеви М.М., Павлов Ю.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Физические методы исследований
Статья в выпуске: 5 т.57, 2022 года.
Бесплатный доступ
Инфракрасная (ИК) спектроскопия и спектроскопия комбинационного рассеяния (КР) - современные методы, на основе которых успешно формируются биотехнологические подходы, позволяющие проводить генетический и функциональный анализ отдельных органов и тканей растений на молекулярном уровне. В представленной работе с помощью спектроскопии поверхностного внутреннего отражения (ПВО), которая представляет собой модификацию ИК-спектроскопии, впервые зарегистрированы и выявлены различия в содержании и конформации биомолекул в гомогенатах целого зерна гибридов кукурузы ZP 735 и его компонентов (эндосперм, перикарп, зародыш). Нашей целью была разработка методологии спектроскопии поверхностного внутреннего отражения для идентификации органических молекул, их содержания и конформации в семени кукурузы и его тканях. Объектом исследования служили зерна гибрида кукурузы ( Zea mays L.) ZP 735 (оригинатор - Maize Research Institute, Zemun Polje, г. Белград, Сербия). Методом случайной выборки было отобрано 30 зерен. Для получения ПВО-спектров образцы целых зерен и их частей (эндосперма, перикарпа и зародыша) измельчали, гомогенизировали и помещали в специальную ячейку прибора. Для регистрации ПВО-спектров использовали спектрометр (Nicolet™ iS20 FTIR Spectro-meter, «Thermo Scientific», США) с алмазом (diamond ATR crystal, «Thermo Scientific», США), для анализа спектров - пакет программ («Thermo Scientific», США). ПВО-спектры сопоставляли в библиотеке данных программы Advanced ATR correction Algorithm. Метод ПВО-спектроскопии основан на отражении пучка света на границе раздела двух фаз: фазы кристалла с высоким показателем преломления, входящего в состав прибора ПВО, и фазы исследуемого образца с более низким показателем преломления. В процессе измерения луч света проникает на небольшую глубину в фазу образца, где частично поглощается. При последующих облучениях образца это явление повторяется, и в результате регистрируется ПВО-спектр. Доказано, что в диапазоне от 400 см-1 до 4000 см-1 ПВО-спектры целого зерна, эндосперма, перикарпа и зародыша гибрида ZP 735 были аналогичны полученным ранее ИК-спектрам зерна, что свидетельствует о возможности использования нового метода для технологий молекулярной селекции. Расположение полос ПВО-спектра характеризует различные формы колебаний валентных связей функциональных групп органических молекул семени, что позволяет идентифицировать не только наличие определенных молекул, но и их конформацию. Доказано, что с помощью анализа амплитуды полос ПВО-спектра (максимальная амплитуда интенсивности и высокая амплитуда интенсивности) в тканях семени можно контролировать изменение содержания ряда органических соединений: протеинов, липидов, сахаров, сложных эфиров, амидов, кетонов, альдегидов, карбоновых кислот, простых эфиров, фенолов, спиртов, ароматических углеводородов, ациклических соединений, алкенов, алканов и алкинов. Полученные результаты важны для тестирования наличия в зерне необходимых органических соединений или изменения их конформации в процессе селекции. К важным преимуществам метода ПВО-пектроскопии по сравнению с ИК-спектроскопией относятся, с одной стороны, сохранение нативности объекта (возможность проведения исследования без фиксации или окрашивания) и простая пробоподготовка, с другой - эффективная оценка содержания и конформации молекул с высокой чувствительностью (разрешение порядка 1,0 см-1). Реализация разработанной методики для формирования технологии молекулярной селекции повысит рентабельность культивирования и эффективность селекции не только кукурузы, но и других сельскохозяйственных растений.
Zea mays l, гибрид, зерно, эндосперм, перикарп, зародыш, инфракрасный спектр, поверхностное внутреннее отражение
Короткий адрес: https://sciup.org/142236363
IDR: 142236363 | УДК: 633.15:577.336 | DOI: 10.15389/agrobiology.2022.5.933rus
Текст научной статьи Использование метода спектроскопии поверхностного внутреннего отражения для диагностики зерна кукурузы (Zea mays L.)
В настоящее время существенное внимание уделяется разработке методических приемов, которые позволяют контролировать содержание и конформацию различных молекул в клетках и тканях растений. Инфракрасная (ИК) спектроскопия и спектроскопия комбинационного рассеяния (КР) — современные методы, на основе которых успешно формируются биотехнологические подходы, позволяющие проводить генетический и функциональный анализ органов и тканей растений на молекулярном уровне, что важно для селекции сельскохозяйственных культур (1-4). Быстрый молекулярный мониторинг позволяет эффективно оценивать результаты диагностики и селекции не только в лаборатории, но и в полевых условиях. Кроме того, эти методы могут служить основой для новых технологий оперативного и квалифицированного контроля качества поступающего сырья для обрабатывающей промышленности (5-7).
Ранее с помощью ИК- и КР-спектроскопии были получены важные характеристики не только структуры отдельных молекул, но и изменений их конформации (изменение доли характерных колебаний химических связей в молекулах) (8-11). Например, с помощью КР-спектроскопии мы выявили изменения в содержании и конформации молекул каротиноидов в хлоропластах гибридов кукурузы (7). С использованием ИК-спектроскопии (область 3500-3000 см-1) установлено, что в молекулах хлоропластов (вода, углеводы, белки) доля колебаний ОН-групп и внутри- и межмолекулярных Н-связей была максимальной у линии ZPPL 186, а доля колебаний N-H групп амидов (белки) оказалась минимальной у линии ZPPL 225. Для хлоропластов ZPPL 186 была характерна максимальная доля валентных колебаний от молекул алканов, карбоновых кислот (область 2920-2860 см-1) и деформационных колебаний ароматических структур (1000 см-1), а для линии M1-3-3-sdms — доля валентных колебания O=C=O связей (2300 см - 1). С помощью КР-спектроскопии (области 1250-500 см - 1 и 1535-1400 см - 1) было обнаружено, что различия в хлоропластах у линий кукурузы связаны с изменениями конформации молекул каротиноидов, а не целлюлозы. У всех образцов, кроме ZPPL 225, молекулы каротиноидов находились в 15-trans форме с различной конформацией полиеновой цепи. Важно, что конформация молекул каротиноидов линии ZPPL 186 характеризуется минимальной величиной поворота оси молекулы вне плоскости полиеновой цепи и более выраженными колебаниями боковой метильной группы C-СН 3 . Предполагается, что у каротиноидов из хлоропластов листьев различных линий кукурузы отсутствуют взаимодействия с ароматическими аминокислотами белков (7).
Внедрение указанных методов анализа конформации молекул в тканях растений, наряду с молекулярно-генетическими технологиями, способствует формированию молекулярных методов селекции в сельском хозяйстве (7).
В представленной работе с помощью спектроскопии поверхностного внутреннего отражения (ПВО), которая представляет собой модификацию ИК-спектроскопии, впервые зарегистрированы и выявлены различия в содержании и конформации биомолекул в зерне, эндосперме, перикарпе и зародыше гибридов кукурузы ZP 735.
Нашей целью была разработка методологии спектроскопии поверхностного внутреннего отражения для идентификации содержания и конформации органических молекул в цельном семени кукурузы и в его тканях.
Методика. Объектом исследования служили зерна гибрида кукурузы ( Zea mays L.) ZP 735 (оригинатор — Maize Research Institute, Zemun Polje, 934
г. Белград, Сербия). Эндосперм, перикарп и зародыш зерна отделяли согласно описанной методике (12). Агрономические, морфологические и химико-физиологические свойства гибрида кукурузы ZP 735, включая селекционные, семеноводческие и технологические характеристики, подробно описаны в работе M. Radosavljevic с соавт. (13).
Случайным образом отбирали 30 зерен. Для получения ПВО-спек- тров образцы целых зерен и их частей (эндосперма, перикарпа и зародыша) измельчали, гомогенизировали и помещали в специальную ячейку прибора.
Для регистрации ПВО-спектров использовали спектрометр (Nicolet™ iS20 FTIR Spectrometer, «Thermo Scientific», США) с алмазом (diamond ATR crystal, «Thermo Scientific», США), а для анализа спектров — пакет программ
(«Thermo Scientific», США). Характеристики прибора были следующими: спектральный диапазон — 3800-375 см-1, разрешение — около 1,0 см-1, соотношение сигнал/шум — более 20000:1, линейность ординаты — 0,07 % Т, точность по волновому числу — 0,01 см-1, максимальная скорость — 40 ска-нирований/с. Спектры регистрировали с 32-кратными повторениями и идентифицировали с помощью библиотек данных (более 1500 соединений). ПВО-спектры сопоставляли в библиотеке данных программы Advanced ATR correction Algorithm («Thermo Scientific», США).
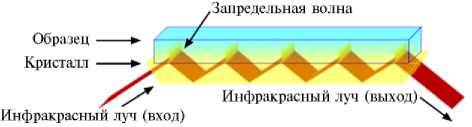
Рис. 1 Оптический путь инфракрасного излучения в кристалле полного внутреннего отражения при проведении ПВО-спектроскопии.
Результаты. В традиционной ИК-спектроско-пии анализируют спектр излучения света, прошедшего через образец, в ПВО-спек-троскопии — регистрируют инфракрасное излучение, отраженное от поверхности образца. Метод ПВО-спектро- скопии основан на отражении пучка света на границе раздела двух фаз: фазы кристалла с высоким показателем преломления, входящего в состав прибора ПВО, и фазы (гомогенной поверхности) исследуемого образца с более низким показателем преломления. В процессе измерения луч света проникает в образец на небольшую глубину, где частично поглощается. При последующих облучениях это явление повторяется, и в результате регистрируется ПВО-спектр.
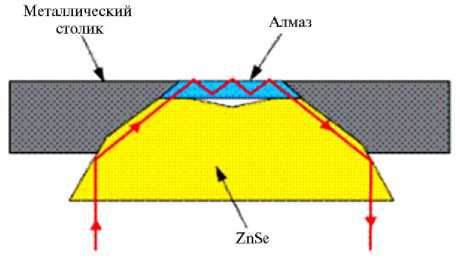
Рис. 2. Схема устройства держателя объекта в приставке
ПВО-спектрометра.
При анализе состава образца с помощью ПВО-спектроскопии вещество или объект размещали на поверхности кристалла в приставке ПВО-спектрометра (рис. 1). Далее через кристалл под специально подобранным углом направлялось ИК-излучение, интенсивность которого затем регистрировали на выходе луча света из кристалла. Важно, чтобы материал кри- сталла, используемого для ПВО-спектроскопии, обладал высоким коэффициентом преломления (кристаллы алмаза и селенида цинка) (рис. 2).
Существенное преимущество ПВО-спектроскопии заключается в том то, что она позволяет изучать непрозрачные нативные образцы, а также обходиться без длительной пробоподготовки объекта и проводить анализ непосредственно в полевых условиях. Предлагаемая методика дает возможность оценивать состояние (конформацию) и содержание различных биомолекул в цельной ткани (например, лист, корень и т.д.).
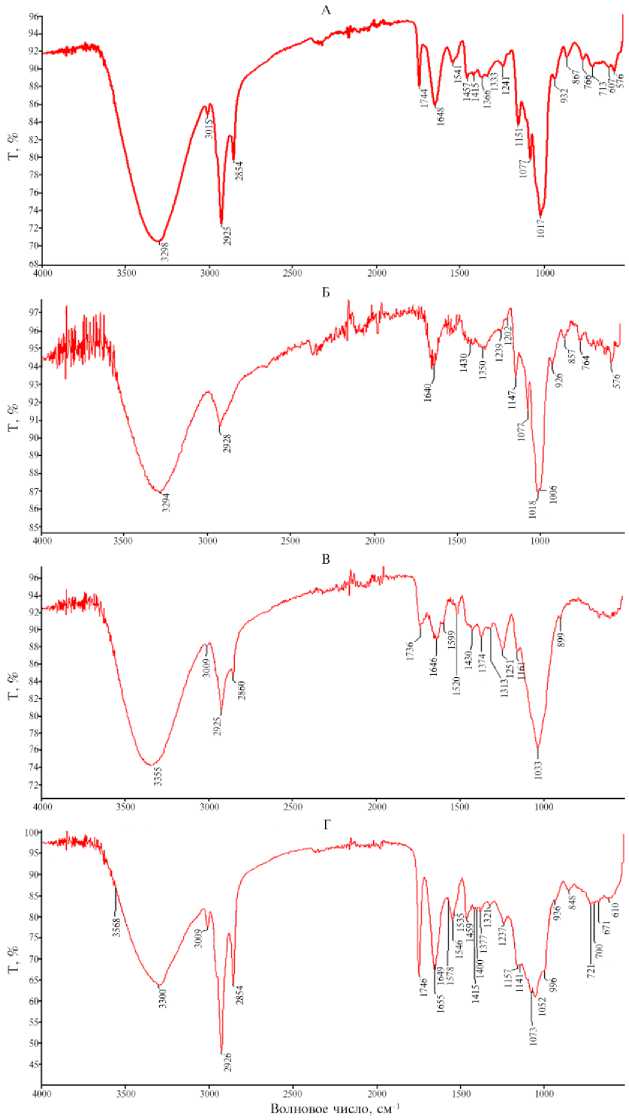
Рис. 3. ПВО-спектры гомогената целого зерна (А) , эндосперма (Б) , перикарпа (В) , зародыша гибрида кукурузы ( Zea mays L.) ZP 735. Т — коэффициент пропускания (отношение интенсивности света, прошедшего через образец, к интенсивности света, падающего на образец, то есть доля падающего света, которая проходит через испытуемый образец).
Доля эндосперма в зерне гибрида кукурузы ZP 735 составляла 84,75 %, перикарпа — 5,30 %, зародыша — 9,95 % (13). ПВО-спектр гомогената зерна гибрида кукурузы ZP 735 (в диапазоне от 400 см - 1 до 4000 см - 1) (рис. 3) характеризовался 20 полосами, которые отличались друг от друга амплитудой интенсивности и частотой. Все полосы ПВО-спектра как для гомогената целого зерна, так и для гомогенатов эндосперма, перикарпа и зародыша были разделены на четыре группы по амплитуде максимумов (Т, %).
В целом зерне максимальную (20 % > T > 6 %) амплитуду интенсивности отмечали при 3298, 2925, 1744 и 1151 см - 1, высокую (6 % > T > 3 %) — на частотах 1648, 1457 и 1077 см - 1, низкую (3,0 % > T > 1,0 %) — на частотах 2854, 1541, 1413, 867 и 766 см - 1, очень низкую (1,0 % > T > 0,2 %) — на частотах 1366, 1333, 1241, 932, 607 и 576 см - 1 (табл. 1, 2).
1. Характеристики полос ПВО-спектра гомогената целого зерна, эндосперма, перикарпа и зародыша у гибрида кукурузы (Zea mays L.) ZP 735 Порядок регистрации Интенсивность Волновое число, Спектральные полосы максималь- спектральных полос полосы, % см-1 ной и высокой интенсивности Целое зерно 1 20,8 3298 Протеины, липиды, карбоновые кис- 2 12,5 2925 лоты, сахара, сложные эфиры, амиды, 3 2,9 2854 кетоны, альдегиды, нитросоединения, 4 7,0 1744 амины, эфиры, фенолы, спирты арома- 5 6,1 1648 тические углеводороды, ациклические 6 1,9 1541 соединения, алкины, алкены, алканы 7 3,6 1457 8 1,8 1413 9 0,8 1366 10 0,2 1333 11 0,4 1241 12 8,0 1151 13 6,0 1077 14 9,2 1017 15 0,2 932 16 1,8 867 17 1,4 766 18 0,8 713 19 0,2 607 20 0,2 576 Эндосперм 1 17,9 3294 Карбоновые кислоты, липиды, белки, 2 4,0 2928 сахара, сложные эфиры, амиды, кетоны, 3 6,0 1640 альдегиды, нитросоединения, амины, 4 2,6 1430 эфиры, фенолы, спирты ароматические 5 0,8 1350 углеводороды, ациклические соедине- 6 1,1 1239 ния, алкины, алкены, алканы 7 1,2 1202 8 6,6 1147 9 6,0 1077 10 12,0 1018 11 11,8 1006 12 0,4 926 13 0,4 857 14 1,8 764 15 1,6 576 Перикарп 1 18,0 3355 Протеины, липиды, карбоновые кис- 2 0,2 3009 лоты, сахара, сложные эфиры, амиды, 3 7,0 2925 кетоны, альдегиды, нитросоединения, 4 0,2 2860 амины, эфиры, фенолы, спирты, арома- 5 5,0 1736 тические углеводороды, ациклические 6 2,4 1646 соединения, алкины, алкены, алканы 7 0,2 1599 8 1,8 1520 9 2,0 1430 10 2,0 1374 11 2,5 1313 12 4,0 1251 13 10,0 1162 14 11,0 1033 15 0,2 899
Продолжение таблицы 1
|
Зародыш |
|||
|
1 |
5,0 |
3568 |
Протеины, липиды, карбоновые кис- |
|
2 |
10,0 |
3300 |
лоты, сахара, сложные эфиры, амиды, |
|
3 |
2,0 |
3009 |
кетоны, альдегиды, нитросоединения, |
|
4 |
14,0 |
2926 |
амины, эфиры, фенолы, спирты, арома- |
|
5 |
7,6 |
2854 |
тические углеводороды, ациклические |
|
6 |
13,4 |
2746 |
соединения, алкины, алкены, алканы |
|
7 |
9,1 |
2655 |
|
|
8 |
0,2 |
1648 |
|
|
9 |
2,0 |
1578 |
|
|
10 |
1,6 |
1546 |
|
|
11 |
3,2 |
1538 |
|
|
12 |
0,2 |
1459 |
|
|
13 |
0,2 |
1415 |
|
|
14 |
0,2 |
1400 |
|
|
15 |
0,2 |
1377 |
|
|
16 |
0,2 |
1321 |
|
|
17 |
2,2 |
1237 |
|
|
18 |
4,5 |
1157 |
|
|
19 |
1,6 |
1141 |
|
|
20 |
2,0 |
1073 |
|
|
21 |
2,1 |
1052 |
|
|
22 |
7,4 |
996 |
|
|
23 |
2,0 |
936 |
|
|
24 |
0,4 |
848 |
|
|
25 |
0,2 |
721 |
|
|
26 |
0,2 |
700 |
|
|
27 |
0,2 |
671 |
|
|
28 |
0,2 |
610 |
|
Пр им еч ан и е. Для всех гомогенатов были выявлены следующие колебания атомов в молекуле: симметричные и антисимметричные валентные (stretching); деформационные плоскостные ножничные (scissoring); деформационные плоскостные маятниковые (rocking); деформационные внеплоскостные веерные (wagging); крутильные внеплоскостные деформационные (twisting); дрожание, валентных связей и молекулярных структур (trembling). Расшифровку полос полученных нами спектров проводили согласно опубликованным данным (14-17).
Зарегистрированные ПВО-спектры гомогената эндосперма, перикарпа и зародыша отличались от ПВО-спектров гомогената зерен как по интенсивности, так и по частоте конкретных полос. Установлено, что амплитуда интенсивности полос ПВО-спектра эндосперма была максимальной на частотах 3294, 1147, 1018 и 1006 см - 1, высокой — на частотах 2928, 1640, 1147, 1077, 1018 и 1006 см - 1, низкой — на частотах 1430, 1239, 1202, 764 и 576 см - 1 и очень низкой — на частотах 1350, 926 и 857 см - 1 (см. рис. 3, Б, табл. 1, 2). Интенсивность полос ПВО-спектра гомогената перикарпа была максимальной на частотах 3355, 2925, 1162 и 1033 см - 1, высокой на частотах 1736 и 1251 см - 1, низкой на частотах 1646, 1520, 1430, 1374 и 1313 см - 1 и очень низкой на частотах 3009, 2860, 1599 и 899 см - 1 (см. рис. 3, В, табл. 1, 2). Интенсивность полос ПВО-спектра зародышей гибрида кукурузы ZP 735 была максимальной на частотах 3300, 2926, 2854, 2746, 2655 и 996 см - 1, высокой на частотах 3568, 1538, 1157 и 996 см - 1, низкой на частотах 1578, 1538), 1073, 1052 и 936 см-1 и минимальной на частотах 1648, 1459, 1415, 1400, 1377, 1321, 848, 721, 700, 671 и 610 см - 1 (см. рис. 3, Г, табл. 1, 2).
Важно, что ранее в наших работах колебания валентных связей функциональных групп органических молекул были выявлены и в классических ИК-спектрах целого зерна (18, 19).
Таким образом, мы установили, что с помощью ПВО-спектроско-пии, основанной не на поглощении, а на отражении пучка света на границе раздела двух фаз (кристалла и биологического объекта), можно регистрировать спектры, которые позволяют не только анализировать конформацию молекул различных веществ, но и определять их наличие и концентрацию в тканях семян. Впервые была описана структура (совокупность полос) ПВО-спектра гомогената зерна гибрида кукурузы ZP 735 и составляющих его тканей по амплитуде характерных полос. Эти данные предлагается использовать для исследования содержания и конформации различных молекул веществ в тканях семян по ПВО-спектрам. Такие результаты важны для определения наличия в зерне необходимых органических соединений или оценки изменения их конформации в процессе селекции.
-
2. Формы колебаний валентных связей органических молекул в гомогенате целого зерна, эндосперма, перикарпа и зародыша гибрида кукурузы ( Zea mays L.) ZP 735, выявленные с помощью ПВО-спектроскопии
Волновое число, см - 1
Формы колебаний валентных связей функциональных групп органических молекул
целое зерно
эндосперм перикарп
зародыш
3298 2925 2854 1744 1648 1541 1457 1415 1366 1333
1241 1151
1077 1017
932 867 766 713
607 576
3294 3355
2928 3009
1640 2925
1430 2860
1350 1736
1239 1646
1202 1599
1147 1520
1077 1430
1018 1374
1006 1313
926 1251
857 1161
764 1033
576 899
3568
3300
3009
2926
2854
1746
1655
1648
1578
1546
1535
1459
1415
1400
1377
1321
1237
1157
1141
1073
1052
996
936
848
721
700
671
610
Спирты (O H)
Амины (N H), (C H)
Алкины (C N), (C C)
Кетоны ( C O)
Алкены (C C)
Эфиры (O CH 2 )
Липиды (C O)
Карбонильные группы (C O) (эфиры)
Амиды (N CH 2 ), ( CO N )
Аминогруппы ( NH )
Первичные амины ( CONH 2 )
Карбоксильные группы ( CO 2 H)
Имиды ( CO N CO ) Хлорангидриды ( COCl)
Нитриты ( C N)
Амиды (N CH 2 )
Карбонильные группы (C O) (амиды)
Алифатические углерод-водородные связи
Альдегиды ( CHO)
Пр им еч ан и е. Расшифровку полос полученных нами спектров проводили согласно опубликованным данным (14, 16, 17).
Представленные нами данные свидетельствуют, что с помощью ПВО-спектроскопии можно дифференцировать состояние и содержание молекул веществ в тканях не только в лаборатории, но и в полевых испытаниях. При этом анализ ПВО-спектров по двум параметрам — максимальной и высокой амплитуде полос дает возможность исследовать изменения содержание и конформацию различных молекул в тканях семян, тогда как полосы с низкой и очень низкой амплитудой интенсивности, которые мы отмечали в ПВО-спектрах зерна ZP 735, вероятно, позволяют только выявить наличие молекул, присутствующих в тканях семян в низких концентрациях (следовых количествах).
Очевидно, что предлагаемая нами новая методика исследования семян требует более простой по сравнению с ИК-спектроскопией пробопод-готовки и при этом позволяет с высокой чувствительностью исследовать изменения конформации и содержания отдельных биомолекул в цельной ткани. Ранее исследования гомогената семени проводились с помощью ИК-спектроскопии (18, 19). Мы доказали, что полосы ИК-спектров семян гибридов кукурузы аналогичны набору полос ИК-спектров чистых линий кукурузы: колебания валентных С—Н связей алкенов и предельных углеводородов соответствуют набору полос 2852 см - 1, 2926 см - 1 и 995 см - 1, колебания валентных О—Н связей — набору полос 1161 см - 1 и 1082 см - 1 вторичных и третичных спиртов, а колебания валентных С=О связей белков амид I и амид II — набору полос 1651 см - 1 и 1541 см - 1 (20, 21). В настоящей работе было установлено, что полосы ПВО-спектров гомогенатов семян кукурузы ZP 735 аналогичны набору полос ИК-спектров: колебания валентных С—Н связей алкенов и предельных углеводородов соответствовали набору полос 2854 см - 1, 2925 см - 1 и 932 см - 1, колебания валентных О—Н связей — набору полос 1151 см - 1 и 1077 см - 1 вторичных и третичных спиртов, а колебания валентных С=О связей амид I и амид II белков — набору полос 1648 см - 1 и 1541 см - 1. С помощью другого метода — вибронной спектроскопии (спектроскопия комбинационного рассеяния) в КР-спектрах семян кукурузы были выявлены дополнительные сигналы, а именно полосы, характерные для молекулы каротиноидов (960, 1006, 1156 и 1520 см - 1), соответствующие валентным колебаниям С—С связей и делокализации π -электронов в молекуле. Было доказано, что структура молекул каротиноидов у гибридов неодинакова. Минимальную длину полиеновой цепи каротиноидов семян выявили у ZP 335. У остальных гибридов этот параметр практически идентичен: у семян чистых линий соотношение I 1520 /I 1156 варьировало от 1,5 (ZP 186, ZP 225) до 1,9 (M1-3-3-sdms). С использованием КР-спектроскопии было установлено, что каротиноиды целых семян ZP 341 имеют минимальное значение соотношения I 960 /I 1006 среди гибридов, и оно аналогично показателю для семян линий ZPPL 186 и ZPPL 225. Величина соотношения I 1156 /I 1190 в КР-спектре каротиноидов была сходной у всех исследованных гибридов, а у семян ZP 434 выявили максимальную величину I 1120 /I 1190 . Последнее, вероятно, свидетельствует о высокой доле каротиноидов, связанных с хлорофиллами в семени (18). Отметим, что во всех этих исследованиях не были получены данные по составу и конформации метаболитов в различных тканях семени, что важно для селекции и генетики.
Далее сравним некоторые наши результаты по амплитудам полос для разных тканей семени кукурузы при использовании ИК- и ПВО-спек-троскопии. Методом ИК-спектроскопии было установлено, что для семян гибрида ZP 735 амплитуда полосы 1017 см - 1 максимальна в гомогенате эндосперма и минимальна в гомогенате зародыша. Вероятно, в этой области ИК-спектра (1017-1054 см - 1) максимумы полос обусловлены ароматическими СН-плоскими деформационными колебаниями (20, 21). В настоящей работе также было установлено, что амплитуда полосы 1018-1052 см - 1 ПВО-спектра максимальна в эндосперме и минимальна в гомогенате зародыша. Амплитуда полосы 1648 см - 1 ИК-спектра была максимальна в эндосперме и минимальна в гомогенате зародыша. Вероятно, эти полосы обуслов-940
лены валентными колебаниями С=О в амидах, деформационными колебаниями N—H и C—N во вторичных амидах белков, пептидов и свободных аминокислот и также характеризуют колебания ОН-группы кристаллической целлюлозной воды (20-22). В настоящем исследовании амплитуда полосы 1640 см - 1 ПВО-спектра тоже была максимальной в эндосперме и минимальной в гомогенате зародыша.
Как известно, с конформационным состоянием фотосинтетических пигментов связана их функциональная активность (23, 24), что важно, в частности, для селекции. Из методов спектроскопии чаще других для идентификации и исследования органических соединений в биологических объектах используется ИК-спектроскопия (25). Кроме того, следует учитывать, что ИК-воздействие стало одним из распространенных способов обработки растительного сырья (26, 27), что требует углубленного изучения ее физикохимических эффектов.
Отметим, что при спектроскопии поверхностного внутреннего отражения регистрируется не поглощение ИК-излучения света, а его отражение образцом. Следовательно, одно из преимуществ ПВО-спектроскопии заключается в том, что, в отличие от ИК-спектроскопии, при которой свет должен пройти образец насквозь, для спектроскопии поверхностного внутреннего отражения толщина образца не имеет значения. Кроме того, в ИК-спектроскопии для получения полезного спектра обычно нужна дополнительная подготовка: гомогенизированные образцы зерна закатывают в таблетку с бромидом калия (KBr, в соотношении компонентов 1:100), тогда как при ПВО-спектроскопии этого не требуется. Предлагаемый подход и оригинальный метод позволят разработать программу скрининг-исследова-ния не только кукурузы, но и других растений при селекции, заболеваниях, а также при анализе воздействия на растения экстремальных факторов внешней среды.
Итак, в диапазоне волновых чисел от 400 до 4000 см - 1 в спектрах поверхностного внутреннего отражения (ПВО) целого зерна, эндосперма, перикарпа и зародыша гибрида кукурузы ZP 735 выявлены все известные полосы, полученные при инфракрасной (ИК) спектроскопии. С помощью детектирования полос ПВО-спектра с максимальной и высокой амплитудой интенсивности можно контролировать изменения содержания ряда органических соединений (протеинов, липидов, сахаров, сложных эфиров, амидов, кетонов, альдегидов, карбоновых кислот, простых эфиров, фенолов, спиртов, ароматических углеводородов, ациклических соединений, алкенов, алканов и алкинов) в тканях семени. К важным преимуществам метода ПВО-спектроскопии по сравнению с классической ИК-спектроскопией относятся, с одной стороны, простая пробоподготовка, которая не влияет на физико-химические свойства образца, с другой — эффективная оценка содержания и конформации молекул с высокой чувствительностью (разрешение порядка 1,0 см - 1). Реализация разработанной методики для формирования технологии молекулярной селекции повысит рентабельность культивирования и эффективность селекции не только кукурузы, но и других сельскохозяйственных растений.
Список литературы Использование метода спектроскопии поверхностного внутреннего отражения для диагностики зерна кукурузы (Zea mays L.)
- Radenovic C.N., Maksimov G.V., Tyutyaev E.V., Stankovic G.J., Jovanovic Z.V., Beljan-ski M.V. Detecting the phase transition in thylakoid membranes of maize inbred lines by means of delayed fluorescence. Plant Physiology and Biochemistry, 2014, 81: 208-211 (doi: 10.1016/j.plaphy.2014.03.013).
- Grubbs B.A., Etter N.P., Slaughter W.E., Pittsford A.M., Smith C.R., Schmitt P.D. A low-cost beam-scanning second harmonic generation microscope with application for agrochem-ical development and testing. Analytical Chemistry, 2019, 91(18): 11723-11730 (doi: 10.1021/acs.analchem.9b02304).
- Butler H.J., Martin F.L., Roberts M.R., Adams S., McAinsh M.R. Observation of nutrient uptake at the adaxial surface of leaves of tomato (Solanum lycopersicum) using Raman spectroscopy. Analytical Letters, 2020, 53(4): 536-562 (doi: 10.1080/00032719.2019.1658199).
- Hu F., Shi L., Min W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods, 2019, 16(9): 830-842 (doi: 10.1038/s41592-019-0538-0).
- Schiavon M., Pizzeghello D., Muscolo A., Vaccaro S., Francioso O., Nardi S. High molecular size humic substances enhance phenylpropanoid metabolism in maize (Zea mays L.). J. Chem. Ecol., 2010, 36 (6): 662-669 (doi: 10.1007/s10886-010-9790-6).
- Ertani A., Francioso O., Tinti A., Schiavon M., Pizzeghello D., Nardi S. Evaluation of seaweed extracts from Laminaria and Ascophyllum nodosum spp. as biostimulants in Zea mays L. using a combination of chemical, biochemical and morphological approaches. Front. Plant Sci., 2018, 6(9): 428 (doi: 10.3389/fpls.2018.00428).
- Radenovic C.N., Maksimov G.V., Shutova V.V., Slatinskaya O.V., Protopopov F.F., Delic N.S., Grchic N.M., Pavlov J.M., Camdzija Z.F. Complete study of nature and importance of spectral bands contained in Infrared spectra of leaves of maize inbred lines with significant breeding properties. Russian Agricultural Sciences, 2019, 45(4): 334-339 (doi: 10.3103/S106836741904013X).
- Vollhardt P.C., Schore N.E. SaplingPlus for organic chemistry: structure and function. NY, 2018.
- Krimm S., Bandekar J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry, 1986, 38: 181-364 (doi: 10.1016/S0065-3233(08)60528-8).
- Свердлов Л.М., Ковнер М.А., Крайнов Е.П. Колебательные спектры многоатомных молекул. М., 1970.
- Radenovich C.N., Makсимов Г.В., Шутова В.В., Hao J., Delich N.S., Sechansky M.D., Popo-vich A.S. Использование инфракрасной спектроскопии и спектроскопии комбинационного рассеяния для анализа состояния биомолекул у линий кукурузы Zea mays L. Сельскохозяйственная биология, 2021, 6(5): 948-957 (doi: 10.15389/agrobiology.2021.5.948rus).
- Galvez Ranilla L. The application of metabolomics for the study of cereal corn (Zea mays L.). Metabolites, 2020, 10(8): 300 (doi: 10.3390/metabo10080300).
- Radosavljevic M., Bekric V., Bozovic I., Jakovljevic J. Physical and chemical properties of various corn genotypes as a criterion of technological quality. Genetika, 2000, 32(3): 319-329.
- Jackson M., Mantsch H.H. Infrared spectroscopy, ex vivo tissue analysis by biomedical spectroscopy. In: Encyclopedia of analytical chemistry: applications, theory and instrumentation. John Wiley & Sons Ltd., New York, 2006: 131-156 (doi: 10.1002/9780470027318.a0107).
- Yu P., McKinnon J.J., Christensen C.R., Christensen D.A. Imaging molecular chemistry of pioneer corn. J. Agric. Food Chem., 2004, 52(24): 7345-7352 (doi: 10.1021/jf049291b).
- Corn: chemistry and technology /P.J. White, L.A. Johnson (eds.). American Association of Cereal Chemists, Minnesota, 2003.
- Skoog D.A., Holler F.J., Crouch S.R. Principles of instrumental analysis. Boston, Cengage Learning, 2018.
- Radenovic C.N., Maksimov G.V., Shutova V.V., Delic N.S., Milenkovic M.V., Pavlovic M.D., Beljanski M.V. The study by the methods of infrared spectroscopy of the stretching and twisting vibrations of chemical bonds in functional groups of organic compounds contained in grains of maize inbred lines. Fisiol. Rast. Genet., 2018, 50(4): 322-330 (doi: 10.15407/frg2018.04.322).
- Radenovic C.N., Maksimov G.V., Shutova V.V., Slatinskaya O.V., Protopopov F.F., Delic N.S., Grchic N.M., Pavlov J.M., Camdzija Z.F. Complete study of nature and importance of spectral bands contained in infrared spectra of leaves of maize inbred lines with significant breeding properties. Russian Agricultural Sciences, 2019, 45(4): 334-339 (doi: 10.3103/S106836741904013X).
- Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Г. Инфракрасная спектроскопия органических и природных соединений: уч. пос. СПб, 2007.
- Тарасевич Б.Н. ИК спектры основных классов органических соединений. М., 2012.
- Amir R.M., Anjum F.M., Khan M.I., Khan M.R., Pasha I., Nadeem M. Application of Fourier transform infrared (FTIR) spectroscopy for the identification of wheat. J. Food Sci. Technol, 2013, 50: 1018-1023 (doi: 10.1007/s13197-011-0424-y).
- Слатинская О.В., Раденович Ч.Н., Шутова В.В., Максимов Г.В. Изменение конформации каротиноидов семян гибридов кукурузы при действии ультрафиолета и а-частиц. Радиационная биология. Радиоэкология, 2020, 60(4): 371-377 (doi: 10.31857/S0869803120040104).
- Слатинская О.В., Протопопов Ф.Ф., Сейфулина Н.Х., Маторин Д.Н., Раденович Ч.Н., Шутова В.В., Максимов Г.В. Исследование состояния фотосинтетических пигментов при воздействии ультрафиолета и радиации на семена гибридов кукурузы. Биофизика, 2018, 63(4): 776-785 (doi: 10.1134/S0006302918040142).
- Раденович Ч., Максимов Г.В., Тютяев Е.В., Шутова В.В., Делич Н., Чамджия З., Павлов Й., Йованович Ж. Идентификация органических соединений в зерне гибридов кукурузы (Zea mays L.) сербской селекции с помощью инфракрасной спектроскопии. Сельскохозяйственная биология, 2016, 51(5): 645-653 (doi: 10.15389/agrobiology.2016.5.645rus).
- Rastogi N.K. Recent trends and developments in infrared heating in food processing. Critical Reviews in Food Science and Nutrition, 2012, 52(9): 737-760 (doi: 10.1080/10408398.2010.508138).
- Aboud S.A., Altemimi A.B., Al-Hilphy A.R.S., Yi-Chen L., Cacciola F. A comprehensive review on infrared heating applications in food processing. Molecules, 2019, 24(22): 4125 (doi: 10.3390/molecules24224125).


