Использование МТТ-теста для изучения отдалённых эффектов острого G-облучения у ракообразных Daphnia magna
Автор: Савина Н.Б., Ускалова Д.В., Сарапульцева Е.И.
Рубрика: Научные статьи
Статья в выпуске: 1 т.27, 2018 года.
Бесплатный доступ
Для изучения токсического действия g-излучения в качестве модели использованы беспозвоночные животные Daphnia magna ( D. magna ) - один из повсеместно распространённых видов низших ветвистоусых ракообразных, широко применяемых в экотоксикологических исследованиях. Исходную выборку D. magna (F0) однократно облучали g-квантами 60Со в дозах 10 (мощность дозы 28 мГр/мин), 100 и 1000 мГр (мощность дозы 960 мГр/мин). На четвёртые сутки проводили МТТ-тест, который отражает жизнеспособность клеток и их метаболическую активность. В работе установлено, что облучение D. magna в дозах 100 и 1000 мГр вызывает снижение МТТ-показателя, т.е. оказывает токсический эффект. Из третьего помёта облучённых D. magna формировали потомство первого поколения (F1), которое не облучали. Обнаружено, что токсический эффект сохраняется и у необлучённого потомства. В работе установлена корреляционная зависимость между показателем МТТ-теста и выживаемостью D. magna в двух поколениях. Сделано заключение, что МТТ-тест может быть использован как скрининговый метод для анализа отдалённых радиационно-индуцированных эффектов низкодозового облучения in vivo.
Мтт-тест, g-облучение, острое облучение, радиационно-индуцированный биологический эффект, отдалённые радиобиологические эффекты, цитотоксичность, малые дозы, жизнеспособность, экотоксикология, мтт-assay
Короткий адрес: https://sciup.org/170170338
IDR: 170170338 | УДК: 612.014.482.4:595.3:576.311.317 | DOI: 10.21870/0131-3878-2018-27-1-86-93
Текст научной статьи Использование МТТ-теста для изучения отдалённых эффектов острого G-облучения у ракообразных Daphnia magna
Токсическое действие у -излучения изучали на Daphnia magna , распространённом в природе виде низших ветвистоусых ракообразных [1]. Ранее радиационный эффект у этих организмов оценивали преимущественно по выживаемости и плодовитости [2, 3]. Для оценки эффекта мы использовали модифицированный МТТ-тест [4], который применяется для in vitro анализа чувствительности клеток к противоопухолевым препаратам [5]. Также нами было показано, что МТТ-анализ можно применять in vivo при изучении влияния низких доз облучения на Daphnia magna [4].
В 1953 г. впервые было обнаружено, что соли тетразолия (МТТ) в присутствии метаболически активных клеток восстанавливаются до формазана, нерастворимого в воде окрашенного в фиолетовый цвет соединения. Это свойство легло в основу создания спектрофотометрического МТТ-теста, с помощью которого можно оценить in vitro количество жизнеспособных клеток по изменению оптической плотности окрашенных образцов.
Хорошо известно, что метаболизм, как и все регуляторные процессы в организме, связан с окислительным фосфорилированием, происходящим в митохондриях. Нарушение митохондриальной активности приводит к патологиям развития эмбрионов лабораторной линии африканской шпорцевой лягушки [6], ускоренному старению и сокращению продолжительности жизни Drosophila melanogaster [7] и облучённых мышей [8]. Одним из объяснений наблюдаемого у D. magna эффекта при использовании МТТ-теста может быть нарушение функционирования
митохондрий, связанное с целостностью митохондриальной ДНК (мтДНК). В обзоре [9] собраны экспериментальные доказательства того, что мтДНК в большей степени, чем ядерная ДНК (яДНК), подвержена действию различных эндо- и экзогенных факторов, в том числе ионизирующего излучения. Если следующему поколению передаются мутантные копии мтДНК, то активная экспрессия их генов приводит к синтезу аберрантных белков, которые могут нарушить работу цепи переноса электронов, что вызовет повышенное образование активных форм кислорода (АФК), усиление оксидативного стресса и дисфункцию митохондрий. Обнаруженная нами ранее [10] активация синтеза АФК у облучённых D. magna и их потомства первого поколения подтверждает наше предположение, что токсическое действие облучения приводит к нарушению метаболизма у рачков и сохранению эффекта в первом, необлучённом потомстве D. magna . В митохондриях возникает широкий спектр изменений, включающий в себя повреждения мтДНК, липидов и белков, снижение дыхательной функции. Развитие этих процессов приводит к нарушению энергетического гомеостаза клеток и тканей. Однако из литературы известно, что восстановление МТТ может катализировать также другие, не митохондриальные, ферменты [11]. Поэтому эффект, обнаруженный нами с применением МТТ-теста, может быть объяснён цитотоксическим действием γ -излучения, вызывающего снижение общей метаболической активности облучённых D. magna и их потомства первого поколения.
Повышенный синтез АФК в митохондриях может служить также сигналом для запуска аутофагии с избирательной элиминацией органелл с нарушенными функциями или погибших клеток [9]. Однако, в соответствии с методикой, МТТ-тест оценивает значения оптической плотности (ОD) в относительных единицах. Согласно приведённой в разделе «Материалы и методы» формуле, полученные данные OD «нормируются» на единицу массы образца, а не на суммарную массу клеток в образце. Также известно, что значения OD, полученные МТТ-тестом, коррелируют с выживаемостью клеток [12]. В связи с этим целесообразно провести исследование, результаты которого помогут определить, отразится ли нарушение соотношения живых и мёртвых клеток на выживаемости особи в целом, и может ли показатель жизнеспособности, полученный МТТ-тестом в опыте in vivo , быть биомаркером отдалённой радиационно-индуцированной гибели D. magna .
Цель работы – показать новые возможности МТТ-теста для анализа отдалённых радиационно-индуцированных эффектов у потомства D. magna после острого γ -облучения родительского поколения F 0 .
Материалы и методы
Культивирование D. magna и схема облучения
Культура Daphnia magna Straus была получена на кафедре гидробиологии МГУ им. М.В. Ломоносова и в течение нескольких лет культивируется в нашей лаборатории в соответствии с международным протоколом [13]. В качестве среды для культуры применяется водопроводная отстоянная дважды фильтрованная вода: рН 7,5-8,2, О 2 ~ 10,0 мг/л; жёсткость ~ 6,8 мг/л, соотношение Ca:Mg 4:1, Fe<0,3 мг/л, Mn – 0,1 мг/л, хлоридов – до 12 мг/мл, фосфатов – <0,05 мг/мл, сульфатов около 44 – 50 мг/мл, взвешенных веществ – <3 мг/мл.
Для синхронизации культуры пробы по 5 половозрелых самок культивировали в 100 мл воды при освещённости 700 люкс в режиме «свет/тьма» 12 ч/12 ч при 20 °C (Климатостат, мо- дель Р2, Россия). D. magna кормили ежедневно суспензией зелёных водорослей (Chlorella vulgaris) в концентрации ~ 1,9 мг C/л (плотность - 4^105 кл./мл). Новорождённых рачков из третьего и последующих помётов поколения F0 облучали на установке «Луч-1» (Латвия, 60Co) в дозах 10, 100 и 1000 мГр. Контрольные группы формировали из необлучённых рачков того же возраста. МТТ-анализ в поколении F0 проводили на четвёртые сутки после облучения.
Для получения первого поколения потомства (F 1 ) дафний из поколения F0 пробы по 5 особей помещали в 100 мл воды и культивировали в климатостате в оптимальных условиях.
МТТ-тест
Для проведения МТТ-теста из каждой дозовой и контрольной групп каждого поколения 50 дафний переносили в микропробирки типа «Эппендорф». После удаления воды к суспензии добавляли 100 мкл водного раствора 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромида (МТТ) в концентрации 0,5 мг/мл и инкубировали образцы 1 ч в темноте при комнатной температуре. По окончании инкубации раствор МТТ замещали на 200 мкл диметилсульфоксида (ДМСО) для растворения осадка формазана. Через 10 мин содержимое микропробирок гомогенизировали. По такой же схеме, только без добавления МТТ, из необлучённых D. magna в каждой серии опытов готовили пять фоновых проб. Далее 100 мкл суспензии каждого образца переносили в лунки 96-луночного планшета. Согласно рекомендациям [14], фоновые пробы помещали в лунки ряда В, начиная с В2. Крайние ряды (А1…А12 и В1, С1, Е1…) не заполняли во избежание искажения результатов. Контрольные и опытные пробы размещали в лунках рядов С, D, E и т.д. Измерение оптической плотности образцов проводили на планшетном иммуно-ферментном анализаторе «StatFax» 2100 («Awareness Technology», США, VIS-модель) при длине волны 492 (рабочая) и 630 нм (шумовая).
Проведено несколько серий независимых экспериментов. Результаты проанализированы по изменению оптической плотности (OD) в 42-67 образцах из каждого поколения в контрольных и облучённых группах. Средние значения OD вычисляли по формуле:
ODo/к - ОDф, где ODo/k - абсолютные значения OD каждой пробы в опыте (о) / или контроле (к), ОDф - средние значения OD фоновых проб.
Анализ результатов и статистическая обработка данных
Статистическая обработка выполнена с помощью пакета программ STATISTICA 8. Проведён двухфакторный дисперсионный анализ для оценки вклада эффекта облучения. Значимость отличия групп, облучённых в разных дозах, с соответствующим контролем оценивали с использованием теста Крускала-Уоллиса с поправкой Бонферрони на множественное сравнение.
Результаты и обсуждение
Согласно результатам двухфакторного дисперсионного анализа, у -облучение оказывает сильный токсический эффект как на исходную выборку, так и на потомство D. magna из необлу-чённого поколения F 1 (F(3,38)=37,51; Р=1,59 х 10 " 11). При этом между эффектами в облучённом поколении и эффектами у потомства значимые различия не выявляются (F(1,38)=0,38; Р=0,54).
В табл. 1 приведены данные по изменению оптической плотности в образцах D. magna .
Таблица 1
Изменение оптической плотности в образцах D. magna в поколениях F 0 и F 1 после острого у -облучения исходной выборки (F 0 )
|
Доза, мГр |
0 |
10 |
100 |
1000 |
|
Поколение F o : тест Крускала-Уоллиса (df=3)*=66,90; P=1,98 x 10-14 |
||||
|
N |
52 |
43 |
53 |
42 |
|
M ± SEM |
0,23 ± 0,01 |
0,21 ± 0,01 |
0,13 ± 0,01 |
0,12 ± 0,01 |
|
P† |
1 |
5,09 x 10-11 |
1,45 x 10-12 |
|
|
Поколение F i : тест Крускала-Уоллиса (df=3)*=31,16; P=7,88 x 10- 7 |
||||
|
N |
42 |
67 |
43 |
49 |
|
M ± SEM |
0,19 ± 0,01 |
0,19 ± 0,01 |
0,14 ± 0,01 |
0,15 ± 0,01 |
|
P† |
0,11 |
4,29 x 10-7 |
1,55 x 10-5 |
|
Примечание: M – среднее значение оптической плотности; SEM – стандартная ошибка; N – количество проанализированных образцов; * – вероятность гомогенности всех групп, оценённая тестом Крускалла-Уоллиса; † – вероятность теста Крускала-Уоллиса для сравнения с контрольной группой с поправкой Бонферрони на множественное сравнение.
Из таблицы видно, что в поколении F 0 наблюдается значимое влияние облучения, начиная с дозы 100 мГр, которая в 500 раз ниже полулетальной для D. magna (53 Гр [15]). В выборках, облучённых в дозе 10 мГр, негативный эффект не обнаружен. Результаты согласуются с ранее полученными данными для родительского поколения, облучённого в дозах 10-1000 мГр [4]. Согласно табл. 1 наблюдается достоверное снижение оптической плотности в образцах первого поколения потомства D. magna (F 1 ).
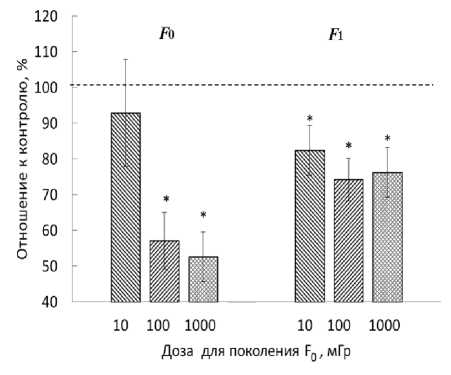
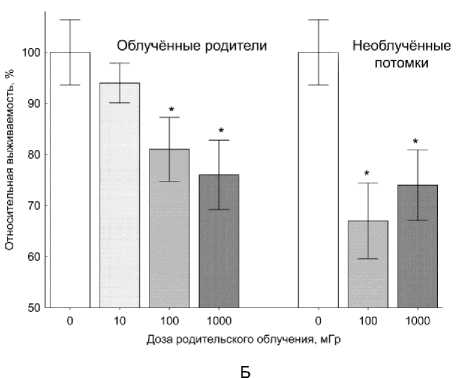
Для ответа на вопрос: отразится ли нарушение соотношения живых и мёртвых клеток на выживаемости особи в целом, и может ли показатель жизнеспособности, полученный МТТ-тестом в опыте in vivo, быть биомаркером отдалённой радиационно-индуцированной гибели D. magna, было проведено сопоставление оценённых МТТ-тестом показателей цитотоксичности с радиационно-индуцированным нарушением выживаемости рачков в поколениях F0 и F1. В наших предыдущих исследованиях [16-18] была обнаружена высокая чувствительность молоди D. magna к облучению в малых и средних дозах. На рис. 1 приведены значения OD облучённых и контрольных образцов дафний, полученных МТТ-тестом, и показатели выживаемости D. magna, полученные при остром у-облучении родительской выборки в дозах 10-1000 мГр в работе [16].
А
Рис. 1. Оптическая плотность (А) в образцах (МТТ-тест) и выживаемость (Б) D. magna к 21-м суткам (N=40) [16] в двух поколениях с увеличением дозы облучения исходной выборки, в процентном отношении к соответствующему контролю. Приведены средние значения со стандартными ошибками (* Р<0,05).
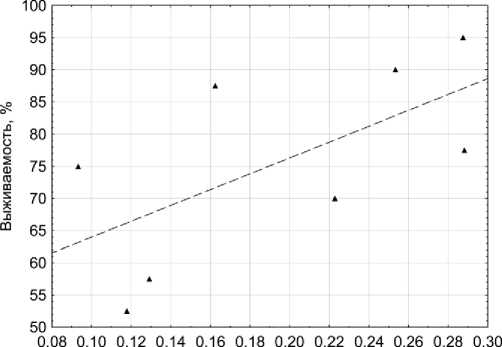
Взятые для корреляционного анализа средние значения выживаемости (в % относительно исходной выборки, N=40) составили: для поколения F 0 - 95,0; 90,0; 82,5 и 75,0 (для контроля и доз 10, 100 и 1000 мГр соответственно); для поколения F 1 - 77,5; 52,5 и 57,5 (для контроля и доз 100 и 1000 мГр) [16]. Проведённый анализ выявил высокую корреляцию показателей как для поколения F 0 (r=0,83, Р=0,17), так и для поколения F 1 (r=0,99, Р=0,08). Результаты представлены на рис. 2.
Оптическая плотность
Рис. 2. Зависимость изменения выживаемости в двух поколениях D. magna от изменения оптической плотности в образцах дафний после острого γ -облучения исходной выборки в дозах 10-1000 мГр.
Недостаточная статистическая значимость результатов связана с малой выборкой анализируемых в исследовании доз облучения. Возможно, увеличение количества выборок позволит в дальнейшем решить эту задачу.
Заключение
Таким образом, при оценке радиационных эффектов у D. magna с применением МТТ-теста обнаружено, что облучение материнской выборки дозами 100 и 1000 мГр вызывает у дафний и их необлучённого потомства первого поколения радиационно-индуцированный токсический эффект. При воздействии на рачков в дозе 10 мГр величина токсического эффекта относительно невелика и статистической значимости не имеет. На основании полученных данных можно заключить, что МТТ-тест, широко применяющийся в биомедицинских исследованиях для выбора цитотоксической терапии, может быть применён как скрининговый метод для анализа отдалённых эффектов облучения D. magna в радиобиологических исследованиях.
Исследование выполнено при частичной финансовой поддержке РФФИ в рамках научного проекта № 18-07-01403.
Список литературы Использование МТТ-теста для изучения отдалённых эффектов острого G-облучения у ракообразных Daphnia magna
- Barata C., Campos B., Rivetti C., LeBlanc G.A., Eytcheson S., Street S., Tobor-Kaplon M., de Vries Buitenweg S., Choi S.-H., Choi J., Sarapultseva E.I, Coutellec M.-A., Coke M., Pandard P., Chaumo A., Quéau H., Delorme N., Geffard O., Martínez-Jerónimo F., Watanabe H., Tatarazako N., Lopes I., Pestana J., Soares A.M.V.M., De Schamphelaere K., Pereira C.M. Validation of a two-generational reproduction test in Daphnia magna: an interlaboratory exercise//Sci. Total Environ. 2017. V. 579. P. 1073-1083.
- Dallas L.J., Keith-Roach M., Lyons B.P., Jha A.N. Assessing the impact of ionizing radiation on aquatic invertebrates: a critical review//Radiat. Res. 2012. V. 177. P. 693-716.
- Fuller N., Lerebours A., Smith J.T., Ford A.T. The biological effects of ionising radiation on Crustaceans: a review//Aquat. Toxicol. 2015. V. 167. P. 55-67.
- Сарапульцева Е.И., Рябченко Н.И., Иголкина Ю.В., Иванник Б.П. Использование клеточного биохимического метода для биотестирования in vivo радиационного загрязнения окружающей среды//Радиационная биология. Радиоэкология. 2013. Т. 53. № 6. С. 634-638.
- Hayon T., Dvilansky A., Shpilberg O., Nathan I. Appraisal of the MTT-based assay as a useful tool for predicting drug chemosensitivity in leukemia//Leukemia and Lymphoma. 2003. V. 44, N 11. P. 1957-1962.
- Мелехова О.П. Свободнорадикальные процессы в эпигеномной регуляции развития. М.: Наука, 2010. 324 с.
- Moskalev A.A., Aliper A.M., Smit-McBride Z., Buzdin A., Zhavoronkov A. Genetics and epigenetics of aging and longevity//Cell Cycle. 2014. V. 13, N 7. P. 1063-1077.
- Loed L.A., Wallace D.C., Martin G.M. The mitochondrial theory of aging and its relationship to reactive oxygen species damage and somatic mtDNA mutations//Proc. Natl. Acad. Sci. USA. 2005. V. 102, N 52. P. 18769-18770.
- Газиев А.И. Пути сохранения целостности митохондриальной ДНК и функций митохондрий в клетках, подвергшихся воздействию ионизирующей радиации//Радиационная биология. Радиоэкология. 2013. Т. 53, № 2. С. 117-136.
- Сарапульцева Е.И., Мелехова О.П., Коссова Г.В., Иголкина Ю.В., Алексеева Н.В. Свободнорадикальные реакции in vivo при облучении дафний в малых дозах//Радиационная биология. Радиоэкология. 2014. Т. 54, № 3. С. 305-308.
- Bernas T., Dobrucki J. Mitochondrial and nonmitochondrial reduction of MTT: interaction of MTT with TMRE, JC-1, and NAO mitochondrial fluorescent probes//Cytometry. 2002. V. 47. P. 236-242.
- Buch K., Peters T., Nawroth Th., Sänger M., Schmidberger H., Langguth P. Determination of cell survival after irradiation via clonogenic assay versus multiple MTT assay -a comparative study//Radiat. Oncol. 2012. V. 7, N 1 DOI: 10.1186/1748-717X-7-1
- Guideline for the Testing of Chemicals. No 211. Daphnia magna Reproduction Test. Organization for Economic Cooperation and development. Paris, 2012. 202 p.
- Cancer Cell Culture. Methods and Protocols/Ed.: I.A. Cree. Second ed. Springer. New York, Dordrecht, Heidelberg, London: Human Press, 2011. P. 237-244.
- Тряпицына Г.А. Реакция биоценозов водных экосистем на хроническое радиационное воздействие: автореф. дис. … докт. биол. наук. М.: МГУ, 2011. 46 с.
- Сарапульцева Е.И., Горский А.И., Малина Ю.Ю. Радиационные риски смертности и сокращение продолжительности жизни g-облучённых в малых дозах дафний//Радиация и риск. 2011. Т. 20, № 1. С. 34-40.
- Сарапульцева Е.И., Бычковская И.Б., Федорцева Р.Ф. Наследование дозонезависимых эффектов относительно малых доз радиации. Модельные опыты на Daphnia magna//Медицинская радиология и радиационная безопасность. 2009. Т. 54, № 6. С. 11-15.
- Sarapultseva E.I., Dubrova Y.E. The long-term effects of acute exposure to ionising radiation on survival and fertility in Daphnia magna//Environ. Res. 2016. V. 150. P. 138-143.


