Использование нейросетевого моделирования для прогнозирования течения острого панкреатита
Автор: Ельский И.К., Васильев А.А., Смирнов Н.Л.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 4 (48), 2021 года.
Бесплатный доступ
Представлены данные исследований 82 пациентов с острым панкреатитом. С помощью нейросетевого анализа выявлены наиболее показательные параметры для прогнозирования острого панкреатита: индексы интоксикации Кальф-Калифа в модификации Костюченко и Хомича, Рейса, Гаркави, соотношение лейкоцитов к СОЭ, лейкоцитарный индекс, общий показатель интоксикации; сонографические параметры - размеры головки поджелудочной железы, диаметр селезеночной вены, наличие свободной жидкости в брюшной полости; биохимические параметры - концентрация амилазы крови, диастазы мочи. При проведении кластеризации в многомерном пространстве признаков была создана нейронная сеть Кохонена. Все анализируемые объекты эффективно разделялись на 3 кластера. Наиболее тяжелым и прогностически неблагоприятным является 1 кластер, куда вошли данные 30 пациентов, с максимальным уровнем летальности и максимальными сроками пребывания в стационаре.
Острый панкреатит, индексы интоксикации, прогнозирование, нейросетевое моделирование, предикторы летальности
Короткий адрес: https://sciup.org/142231924
IDR: 142231924 | УДК: 616.37-002 | DOI: 10.38181/2223-2427-2021-4-23-32
Текст научной статьи Использование нейросетевого моделирования для прогнозирования течения острого панкреатита
Острый панкреатит (ОП) – одно из наиболее распространенных заболеваний желудочно-кишечного тракта в структуре экстренной абдоминальной хирургии. Заболеваемость ОП во всем мире варьирует от 4,9 до 73,4 случаев на 100 000 населения и имеет выраженную тенденцию к росту. В Российской Федерации частота этого заболевания колеблется от 10 до 13% от общего количества пациентов, страдающих хирургической патологией органов брюшной полости. С каждым годом наблюдается неуклонный рост ОП среди лиц молодого населения [1-5, 7].
Традиционные способы оценки тяжести больных с ОП, шкалы и системы с балльным оцениванием требуют значительного времени и ресурсов для исполнения и не все из них обладают достаточной специфичностью к ОП. Практического хирурга всегда интересует быстрая, недорогая и доступная в применении система определения тяжести и прогноза заболевания [3, 11,12].
Цель исследования : построить математическую модель для прогнозирования тяжести ОП на основе клинико-лабораторных критериев.
Материалы и методы
Исследования проводили на базе клиники хирургии и эндоскопии ГОО ВПО ДОННМУ ИМ.М.ГОРЬКОГО в течение 2019-2020 гг. Обследовано 82 пациента в возрасте от 25 до 90 лет с диагнозом «острый панкреатит» (К 85.Х).
Дизайн исследования: проспективное рандомизированное когортное исследование. Критериями включения пациентов в исследование были:
-
1. Согласие пациента или его законного представителя на участие в исследовании;
-
2. Наличие у пациента острого панкреатита (ОП);
-
3. Возраст от 25 до 90 лет.
Распределение исследованных больных по возрасту и полу приведено в таблице 1.
В исследовании принимало участие 82 пациента, из которых 47 (57,3%) были мужчин, 35 (42,7%) – женщины. 10 больных, поровну мужчин и женщин, отно-
Распределение обследованных пациентов по возрасту и полу*
Distribution of examined patients by age and sex*
сились к самой молодой возрастной группе «от 25 до 30 лет» В возрастной группе «от 31 до 40 лет» преобладали (p=0,032, критерий χ2) мужчины: 15 лиц мужского пола (18,1% от всех исследуемых) и только 5 (6,0%) женщин. В возрасте «от 41 до 50 лет» обследовано 6 пациентов, 2 мужчин и 4 женщины. 20 пациентов, 13 мужчин и 7 женщин, участвовали в исследовании в возрасте «от 51 до 60 лет». 17 человек (10 мужчин и 7 женщин) относились к группе старшего возраста (61-70 лет). В возрасте 71-80 лет приняло участие в исследовании 7 пациентов (2 мужчин, 5 женщин). 3 пациенты (2 женщины и 1 мужчина) относились к самой старшей возрастной группе «от 81 до 90 лет». Значимых гендерных различий в этих возрастных группах не выявлено (табл. 2.1).
Заболевание имело сопоставимую распространенность среди мужчин (п=47 (57,3%)) и женщин (п=35 (42,7%)) (табл.1). В возрастной группе «от 31 до 40 лет» преобладали (p=0,032, критерий χ2) мужчины: 15 лиц
Таблица 1.
Table 1.
|
Возраст (лет) |
Количество больных |
Баллы |
Критерий χ2 |
|
|
мужчины |
женщины |
|||
|
25-30 |
10; 12,2% (6,0%-20,1%) |
5; 6,0% (2,0%-12,1%) |
5;6,0% (2,0%-12,1%) |
p =0,745 |
|
31-40 |
20; 24,4% (15,8%-34,2%) |
15; 18,1% (10,6%-27,0%) |
5;6,0% (2,0%-12,1%) |
p =0,032 |
|
41-50 |
6; 7,3% (2,7%-13,9%) |
2; 2,4% (0,2%-6,9%) |
4; 4,9% (1,3%-10,6%) |
p =0,678 |
|
51-60 |
20; 24,4% (15,8%-34,2%) |
13; 15,9% (8,8%-24,5%) |
7; 8,5% (3,5%-15,5%) |
p =0,233 |
|
61-70 |
17; 20,7% (12,7%-30,1%) |
10; 12,2% (6,0%-20,1%) |
7; 8,5% (3,5%-15,5%) |
p =0,609 |
|
71-80 |
7; 8,5% (3,5%-15,5%) |
2; 2,4% (0,2%-6,9%) |
5;6,0% (2,0%-12,1%) |
p =0,440 |
|
81-90 |
3; 3,7% (0,7%-8,8%) |
1; 1,2% (0,0%-4,7%) |
2; 2,4% (0,2%-6,9%) |
p =1,000 |
|
Всего |
82; 100,0% (97,7%-100,0%) |
47; 57,3% (46,5%-67,8%) |
35; 42,7% (32,2%-53,5%) |
p =0,086 |
Примечание: * – интегральная оценка, процедура Мараскуило-Ляха-Гурьянова для множественного сравнения долей [13]
Note: * – integral assessment, Marasquilo-Lyakha-Guryanov procedure for multiple comparison of shares [13]
Таблица 2.
Распределение обследованных пациентов по основному диагнозу*
Distribution of examined patients by main diagnosis*
Table 2.
|
Патология |
Количество больных |
Средний возраст, М±m |
мужчин |
женщин |
Критерий χ2 |
|
Кол-во; Ме%(±ДИ95%)% |
Кол-во; Ме% (±ДИ95%)% |
||||
|
Острый небилиарный панкреатит |
53; 64,6% (54,0%-74,6%) |
46,7±2,3 |
34; 64,2% (50,9%-76,4%) |
19;35,8% (23,6%-49,1%) |
p =0,007 |
|
Острый билиарный панкреатит |
20; 24,4% (15,8%-34,2%) |
64,4±3,1 |
9;45,0% (24,4% – 66,6%) |
11; 55,0% (33,4%-75,6%) |
p =0,753 |
|
Острый тяжелый небилиарный панкреатит |
6; 7,3% (2,7%-13,9%) |
55,5±6,172 |
1; 1,2% (0% 4,7%) |
5; 6,1% (2,0%-12,3%) |
p =0,212 |
|
Острый тяжелый билиарный панкреатит |
3; 3,7% (0,7% – 8,8%) |
47±8,155 |
3; 3,7% (0,7% – 8,8%) |
0; 0% (0%-2,3% ) |
p =0,244 |
|
Всего |
82; 100,0% (97,7%-100,0%) |
55,5±2,868 |
47; 57,3% (46,5%-67,8%) |
35; 42,7% (32,2%-53,5%) |
p =0,086 |
|
Летальность |
4; 4,9% (1,3%-10,6%) |
60,5±10,49 |
2; 2,4% (0,2%-6,9%) |
2; 2,4% (0,2%-6,9%) |
p =0,765 |
Примечание: * – интегральная оценка, процедура Мараскуило-Ляха-Гурьянова для множественного сравнения долей [13] Note: * – integral assessment, Marasquilo-Lyakha-Guryanov procedure for multiple comparison of shares [13]
мужского пола (18,1% от всех исследуемых) и только 5 (6,0%) женщин.
Средний возраст пациентов составил M±m= 51,4± 16,2 лет. Средний койко-день составил M±m= 7,7±5,3 суток, 68,3% (п=56) участников исследования являлись лицами трудоспособного возраста (табл. 2).
Все больные поступали в стационар в срочном порядке. Заболевание имело доказано билиарный генез в 28% (n=23) наблюдений, небилиарный – в 72% (n=59) случаев. 9 пациентов переносили тяжелый панкреатит (3 – билиарного и 6 – небилиарного генеза). Острый небилиарный панкреатит чаще (p=0,007, критерий χ2) был выявлен у мужчин (табл.2). Основными причинами возникновения ОП были погрешность в питании – в 26,8% (n=22) наблюдений и употребление алкоголя – в 65,9% (n=54) случаев. У пациентов с патологией желчевыводящих путей преимущественное значение в дебютезаболевания имело нарушение питания – в 18,3% (n=15) случаев.
У 65,9% (n=54) пациентов выявили различную сопутствующую патологию, в структуре которой преобладали сердечно-сосудистые заболевания – 17,1%(n=14) случаев. В 8,5% (n=7) наблюдений коморбидные расстройства затрагивали две и более системы органов.
С целью постановки диагноза, а также для мониторинга динамики заболевания проводили исследования основными направлениями которых являлись:
-
1) Всем пациентам в обязательном порядке назначали исследования в соответствии с принятыми стандартами обследования больного с острой хирургической патологией: а) лабораторные (общий анализ крови, биохимический анализ крови, общий анализ мочи), б) ультразвуковые (сонография гепатобилиарной зоны), в) эндоскопические (ФЭГДС); оценка выраженности системных расстройств определяли по клиническим (ЧСС, ЧД, критерии шкалы Глазго) и лабораторным показателям.
-
2) Оценка тяжести интоксикации у больных с ОП: определяли с помощью расчета индексов интоксикации (ИИ) Кальф-Калифа в модификации Хомича и Костюченко, Рейса, Гаркави, вариант ИИ В. Островского, ядер-ный индекс Г. Д. Даштаянц, индекс иммунореактивности индекс соотношения лимфоцитов и моноцитов, индекс соотношения лимфоцитов и эозинофилов, индекс соотношения эозинофилов и лимфоцитов, индекс соотношения лейкоцитов и СОЭ, индекс соотношения агрануло-цитов и СОЭ, лейкоцитарного индекса интоксикации и показателя интоксикации [14].
Для оценки тяжести состояния больных мы не использовали балльные прогностические шкалы в связи с тем, что, по нашему мнению, они не имели достаточный уровень специфичности при ОП [3, 11, 12].
Статистический анализ проводили с использованием программы MedStat и STATISTICA 10. Формирование, хранение, анализ электронной базы данных, статистическая обработка и визуализация результатов исследований выполнены в лицензионных пакетах: MedStat v. 4 и Microsoft Office. Лицензионный паспорт на серийный номер MS 000020.
Характер распределения цифровых данных (по закону нормального распределения или по закону распре-деления,который отличается от нормального) определяли с помощью критерия хи-квадрат (χ2) и теста Шапиро-Уилка [13, 15, 16].
Использованы непараметрические критерии доказательства статистически значимых отличий сравниваемых совокупностей величин. Парные сравнения центральных тенденций независимых выборок проводили с использованием W-критерия Вилкоксона (W-W), а двух связанных выборок – с использованием Т-критерия Вилкоксона (T-W). Множественные сравнения, когда количество совокупностей для сравнения было более двух, проводили путем рангового однофакторного анализа Крускала-Уоллиса и, при наличии статистически значимого отличия между группами, проводили парное сравнение с использованием критерия Данна [15].
Для оценки плотности корреляционной связи между признаками рассчитывали непараметрические коэффициенты: парной (Кендалла) и ранговой (Спирмена) корреляции [17].
Результаты и обсуждение
При проведении кластеризации испытуемых в многомерном пространстве признаков важным является условие их независимости (отсутствия высоких прямых или обратных корреляционных связей), поэтому на первом этапе был проведен корреляционный анализ значений, полученных данных (ранговая корреляция Кендалла (τ), Спирмена (ρ). В результате для значений всех исследуемых показателей был выделен набор 18 взаимнонекоррелированных признаков (табл. 3).
Каждый из этих признаков представлял группу параметров, высоко (коэффициент корреляции Кендалла τ > 0,75 или τ < -0,75) коррелированных между собой: «количество койко-дней», «тяжесть состояния клинически», «индексы интоксикации (ИИ): Кальф-Калифа в модификации Хомича и Костюченко, Рейса, Гаркави, индекс соотношения лейкоцитов и СОЭ (ИЛСОЭ), лейкоцитарный индекс интоксикации (ЛИИ) и общий
Table 3.
|
№ |
Группа взаимнонекоррелированных признаков |
Кластеры |
Множественные сравнения критерий Крус-калло-Уоллиса⁰ |
||
|
Cl 1 |
Cl 2 |
Cl 3 |
|||
|
N=30 |
N=20 |
N=32 |
|||
|
Ме (±ДИ95%) |
Ме (±ДИ95%) |
Ме (±ДИ95%) |
|||
|
Средний возраст (лет) |
62 (53-67)23 |
53 (35-57)1 |
43 (35-55) 1 |
||
|
Количество мужчин* |
14;46,7% (29,4-64,4%) |
12;60,0% (38,3%-79,8%) |
21;65,6% (48,6%-80,8%) |
||
|
Количество женщин* |
16; 53,3% (35,6%-70,6%) |
8; 40,0% (20,2%-61,7%) |
11; 34,4% (19,2%-51,4%) |
||
|
Патология билиарного генеза* |
12; 40,0% (23,5%-57,8%) |
4; 20,0% (5,9%-39,8%) |
7; 21,9% (9,5%-37,6%) |
||
|
Патология небилиарного генеза* |
18; 60,0% (42,2%-76,5% ) |
16; 80,0% (60,2%-94,1%) |
25; 78,1% (62,4%-90,5%) |
||
|
1 |
«количество койко-дней» |
8 (5-15) |
7,5 (3-12) |
5,5 (4-7) |
|
|
2 |
«тяжесть состояния клинически» |
1 (1-2) |
1 (1-2) |
1 (0-1) |
|
|
3 |
ИИ Кальф-Калифа в модификации Хомича и Костюченко. Норма: <1,8 |
3,5 (1,9-4,98) #12 #13 |
3,8 (2,7-6,6) #12 #23 |
1,4 (1,05-1,82) #13 #23 |
|
|
4 |
ИИ Рейса. Норма: 1,0 ± 0,5 до 1,6 ± 0,5 |
3,8 (2,45-4,9) |
3,8 (3-5,3) |
1,9 (1,6-2,2) |
|
|
5 |
ИИ Гаркави. Норма: 0,3 – 0,5 |
0,26 (0,18-0,36) |
0,24 (0,16-0,27) |
0,44 (0,35-0,53) |
|
|
6 |
ИЛСОЭ. Норма: 1,87 ± 0,76 |
1 (0,73-1,87) |
1,3 (0,88-1,83) |
2,7 (2,1-4) |
|
|
7 |
ЛИИ. Норма 0,41 ± 0,03 |
0,19 (0,12-0,29) |
0,18 (0,12-0,23) |
0,37 (0,32-0,52) |
|
|
8 |
ОПИ. Норма: 0,62 ± 0,09 |
4,25 (2,36-7,2) #12 #13 |
5,0 (3,7-8) #12 #23 |
1,4 (1,1-2,0) #13 #23 |
|
|
9 |
«АЛТ (Ед/л)» |
32 (27-35) |
34 (24-51) |
35 (30-45) |
|
|
10 |
«диастаза (ЕД)» |
42 (32-60) |
48 (40-108) |
28,5 (19-50) |
|
|
11 |
«амилаза (мкмоль/(ч*л) ЕД/л» |
42 (32-60) |
48 (40-108) |
28,5 (19-50) |
|
|
12 |
«размер головки поджелудочной железы (ПЖ) (мм) по данным УЗИ» |
28 (23-32) |
32 (28-34) |
24 (22-28) |
|
|
13 |
«наличие/отсутствие конкримента в желчном пузыре (ЖП) по данным УЗИ»* |
22 из 30; 73,3% (56,4%-87,3%) |
0 из 20; 0% (0%-9,1%) |
3 из 32; 9,4%(1,9%-9,4%) |
|
|
14 |
«диаметр холедоха (мм) по данным УЗИ» |
5 (4,7-6) #12 #13 |
5 (4-6) #12 #23 |
4 (3-5) #13 #23 |
|
|
15 |
«диаметр селезеночной вены (мм) по данным УЗИ» |
4 (3,2-4,1) |
4 (3,6-5) |
3 (2,9-3,1) |
|
|
16 |
«наличие/отсутствие свободной жидкости в брюшной полости по данным УЗИ» * |
3 из 30; 10% (2%-23%) |
5 из 20; 25% (9%-45,7%) |
0 из 32; 0% (0%-5,8%) |
|
|
17 |
«наличие/отсутствие желчи в залукович-ных отделах по данным ФЭГДС» * |
7 из 30; 23,3% (10,2%-39,8%) |
3 из 20; 15,0% (3,2%-33,5%) |
7 из 32; 21,9 (9,5%-37,6%) |
|
|
18 |
«исходы» * |
3 летальных исхода из 30; 10% (2%-23%) |
1 летальный исход из 20; 5% (0%-18,5%) |
0 летальных исходов из 32; 0% (0%-5,8%) |
|
Примечание: * – интегральная оценка, процедура Мараскуило-Ляха-Гурьянова для множественного сравнения долей [13];
#12 #13 #23– Формы распределения двух выборок, критерий хи-квадрат, распределения отличаются на уровне значимости p≤0,05
Note: * – integral assessment, Marasquilo-Lyakha-Guryanov procedure for multiple comparison of shares [13];
#12 #13 #23 – Shapes of distribution of two samples, chi-square test, distributions differ at the level of significance p≤0.05
Таблица 3.
Структура кластеров острого панкреатита
Cluster structure of acute pancreatitis
показатель интоксикации (ОПИ)» [14, 19, 20, 21], «АЛТ (Ед/л)», «диастаза (ЕД)», «амилаза (мкмоль/(ч*л)», «размер головки поджелудочной железы (ПЖ) (мм)», «наличие/от-сутствие конкремента в желчном пузыре (ЖП)», «диаметр общего желчного протока (мм)», «диаметр селезеночной вены (мм)», «наличие/отсутствие свободной жидкости в брюшной полости», «наличие желчи в залуковичных отделах», «варианты исхода (выздоровление/exitus letalis)».
Для проведения кластеризации данных в многомерном пространстве признаков используется особый тип нейронных сетей, которые представляют собой сети, обучающиеся без выходных сигналов («обучение без учителя», которые были предложены Kohonen) – сети Кохонена [22].
Оптимальное количество различных кластеров, в которые проводится классификация, вычислялось с помощью процедуры расчета коэффициента контрастности разбиения [23]. Аномально высокоезначение показателя Contrast было выявлено в случае разбиения множества на 3 кластера. Таким образом, при проведении кластеризации 18-и параметров в многомерном пространстве признаков была создана нейронная сеть Кохонена с 18-ю нейронами во входном слое и тремя нейронами в выходном.
То есть, все анализируемые объекты эффективно разделялись в многомерном пространстве признаков в 3 различных группы – кластеры (Cl) (табл.2). К первому кластеру (Cl 1) было отнесено 30 случаев, ко второму (Cl 2) – 20 случаев, к третьему (Cl 3) – 32 случая (табл. 3).
Среди особенностей исследуемых показателей у 30-и пациентов, вошедших в 1-й кластер, следует отметить: самый высокий (критерий Крускалло-Уоллиса (кКУ), p=0,046) «средний возраст», высокую частоту встречаемости билиарного генеза ОП (40,0%), максимально длительное пребывание в стационаре койко-дней=8 (5-15), минимальный уровень АЛТ (Ед/л) (32 (27-35); сонографически выявлены: у 73,3% пациентов, чаще, чем у больных остальных кластеров, конкременты в желчном пузыре, максимальный диаметр холедоха (свыше 8,0 мм);
недостоверно высокую, в сравнении с остальными кластерами, летальность и частоту «одноэтапных» хирургических вмешательств.
Для исследуемых пациентов, чьи показатели вошли во второй кластер, типичным было: максимально часто выявляемое «тяжелое» общее состояние (30,0%) при первичном осмотре, максимальные уровни индекса интоксикации Кальф-Калифа в модификации Хомича и Костюченко (3,8 (2,7-6,6) и общего показателя интоксикации (5,0 (3,7-8), максимально высокие, по сравнению с остальными кластерами, уровни диастазы – 48 (40-108) ЕД – и амилазы – 48 (40-108) ЕД/л, сонографически зафиксированные максимальные размер головки поджелудочной железы 32 (28-34) мм и диаметр селезеночной вены 4 (3,6-5) мм, максимально часто встречаемое наличие свободной жидкости в брюшной полости – 25%.
3-й кластер включал в себя самых «молодых» пациентов – средний возраст = 43 (35-55), которые провели в стационаре минимальное количество койко-дней – 5,5 (4-7). При осмотре только в этом кластере выявлены пациенты в «удовлетворительном» общем состоянии 13,6% от всех исследуемых в кластере. Уровень интоксикации у этих пациентов был самым низким по показателям всех применяемых в исследовании индексов интоксикации (табл. 3). Уровень АЛТ у пациентов 3-го кластера был самым высоким. Показатели диастазы и амилазы, напротив, были самыми низкими. По данным УЗИ, размер головки ПЖ, диаметры холедоха и селезеночной вены были минимальными. Никто из пациентов, включенных
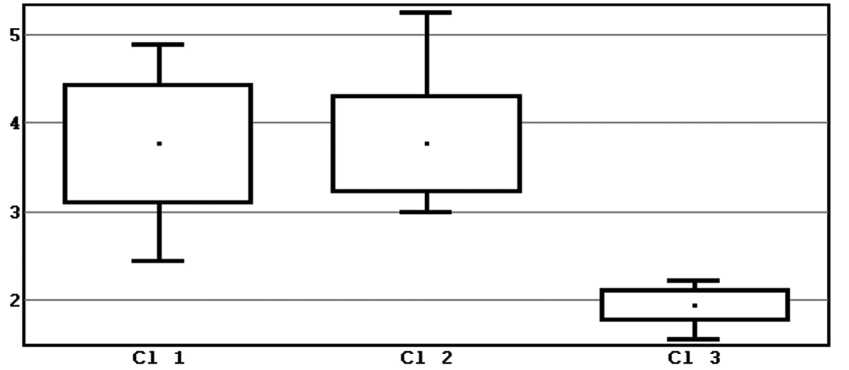
Рис. 1. Уровни ИИ Рейса в трех кластерах
Примечание: Центральные тенденции отличаются Кластер 1 и 3., на уровне значимости p<0,00. Центральные тенденции Кластер 2 и 3 отличаются, на уровне значимости p<0,001. Сравнение формы распределения двух выборок. Критерий хи-квадрат. Переменные: Cl 1, Cl 2. Хи-квадрат=14,50, число степеней свободы k=6.
Распределения отличаются на уровне значимости p<0,025
Fig. 1. Levels of the Rays index in three clusters
Note: Central trends differ between Clusters 1 and 3., at a significance level of p <0.00. The central trends of Cluster 2 and 3 differ, at the p <0.001 significance level. Comparison of the shape of distribution of two samples. Chi-square test. Variables: Cl 1, Cl 2. Chi-square = 14.50, the number of degrees of freedom k = 6. Distributions differ at the level of significance p <0.025
в 3-й кластер, не получал хирургического лечения, все пациенты выписаны из отделения с выздоровлением.
На рисунке 1 указано, что уровни ИИ Рейса в формате центральных тенденций кластеров 1 и 3отличаются на уровне значимости p<0,00, в то время, как статистически нет различий между 1 и 2 кластерами.
Рисунок 2 иллюстрирует заметное отличие между уров- нями ИИ Гаркави в 3 кластере по отношению к 1 и 2 кластерам.
Рисунок 3 демонстрирует регрессионную связь между ИИ Кальф-Калифа в модификации Хомича и Костюченко при поступлении пациентов с ОП и тяжестью их состояния. Доказано, что на уровне R>0 существует линейная корреляционна связь.
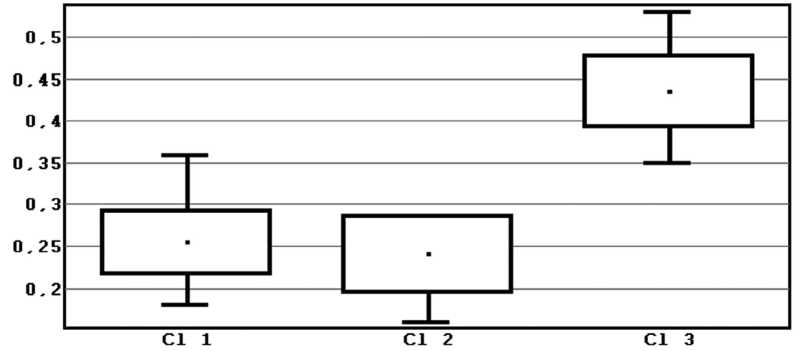
Рис. 2. Уровни ИИ Гаркави в трех кластерах
Примечание: Центральные тенденции отличаются Кластеров 1 и 3., на уровне значимости p<0,00. Центральные тенденции Кластеров 2 и 3 отличаются, на уровне значимости p<0,001. Сравнение формы распределения двух выборок. Критерий хи-квадрат. Переменные: Cl 1, Cl 2. Хи-квадрат=7,36, число степеней свободы k=7.
Различие распределений не является статистически значимым, p=0,392
Fig. 2. Levels of the Garkavi index in three clusters
Note: Central trends differ between Clusters 1 and 3., at a significance level of p <0.00. The central tendencies of Clusters 2 and 3 differ, at the p <0.001 significance level. Comparison of the shape of distribution of two samples. Chi-square test. Variables: Cl 1, Cl 2. Chi-square = 7.36, the number of degrees of freedom k = 7. The difference in distributions is not statistically significant, p = 0.392
Регрессионный анализ
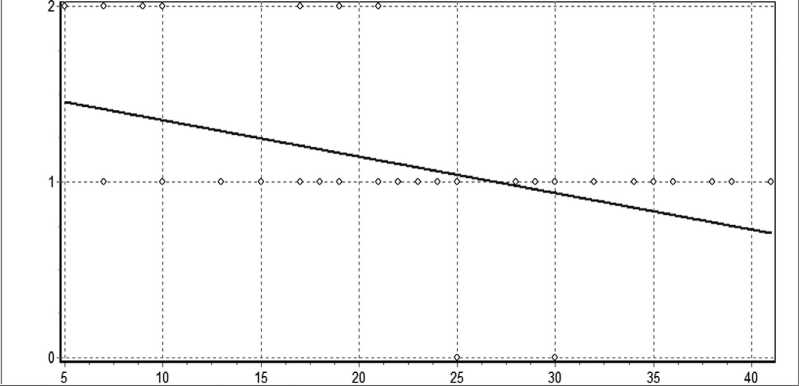
Рис. 3. Регрессионная связь между тяжестью состояния при поступлении и уровнем интоксикации по индексу Кальф-Калифа в модификации Хомича и Костюченко у пациентов с ОП
Примечание: Построение линейной модели. Зависимость переменной Var1 от переменной Var2. Уравнение линейной регрессии имеет вид:
Var1 = 0,09502*Var2 + 0,835. Объем выборки: N=82. Коэффициент линейной корреляции R= 0,599, число степеней свободы k=48.
Существует линейная корреляционная связь, R>0 на уровне значимости p<0,001. Коэффициент детерминации =0,358
Fig. 3. Regression relationship between the severity of the condition on admission and the level of intoxication according to the Kalf-Kalif index in modification of Khomich and Kostyuchenko in patients with OP
Note: Building a linear model. Dependence of the variable Var1 on the variable Var2. The linear regression equation is: Var1 = 0.09502 * Var2 + 0.835. Sample size: N = 82. The linear correlation coefficient is R = 0.599, the number of degrees of freedom is k = 48. There is a linear correlation, R> 0 at the p <0.001 significance level. Determination coefficient = 0.358
На рисунке 4 указано, что на уровне R<0 со значимостью p=0,005 существует линейная корреляционная связь между тяжестью состояния больных с ОП в момент поступления и ИИ Гаркави.
Рисунок 5 наглядно показывает линейную корреляционную связь между тяжестью состояния больных с ОП и общим индексом интоксикации.
Таким образом, на основании построенной математи-
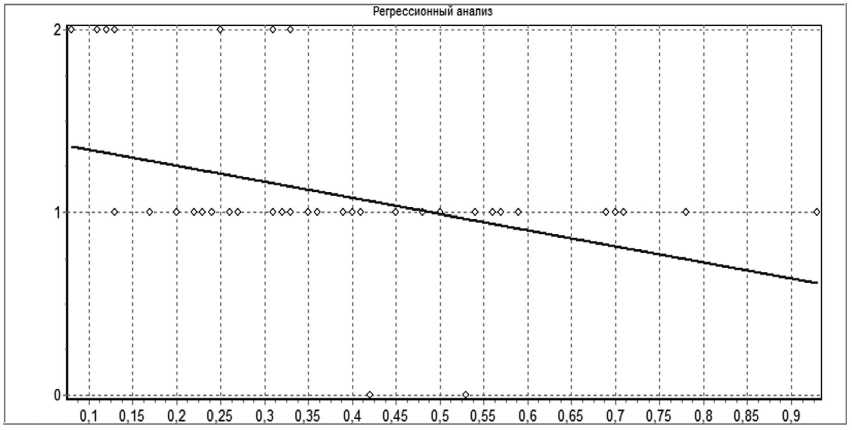
Рис.4. Регрессионная связь между тяжестью состояния при поступлении и уровнем интоксикации по индексу Гаркави у пациентов с ОП Примечание: Построение линейной модели. Зависимость переменной Var1 от переменной Var2. Уравнение линейной регрессии имеет вид: Var1 = -0,8747*Var2 + 1,429. Объем выборки: N=82. Коэффициент линейной корреляции R= -0,393, число степеней свободы k=48. Существует линейная корреляционная связь, R<0 на уровне значимости p=0,005. Коэффициент детерминации =0,154
Fig.4. Regression relationship between the severity of the condition on admission and the level of intoxication according to the Harkavi index in patients with AP Note: Building a linear model. Dependence of the variable Var1 on the variable Var2. The linear regression equation is: Var1 = -0.8747 * Var2 + 1.429. Sample size: N = 82. The linear correlation coefficient is R = -0.393, the number of degrees of freedom is k = 48. There is a linear correlation, R <0 at the p = 0.005 significance level. Determination coefficient = 0.154
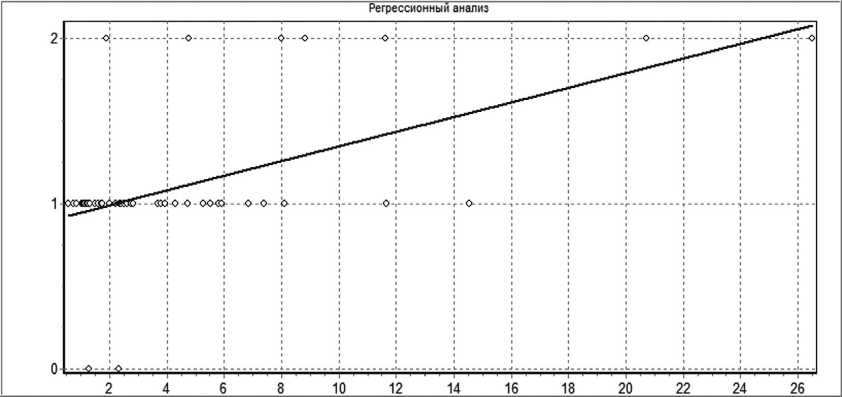
Рис. 5. Регрессионная связь между тяжестью состояния при поступлении и уровнем интоксикации по общему индексу интоксикации у пациентов с ОП Примечание: Построение линейной модели. Зависимость переменной Var1 от переменной Var2. Уравнение линейной регрессии имеет вид: Var1 = 0,04446*Var2 + 0,9037. Объем выборки: N=50. Коэффициент линейной корреляции R= 0,544, число степеней свободы k=48. Существует линейная корреляционная связь, R>0 на уровне значимости p<0,001. Коэффициент детерминации =0,296
Fig. 5. Regression relationship between the severity of the condition on admission and the level of intoxication according to the general index of intoxication in patients with AP Note: Building a linear model. Dependence of the variable Var1 on the variable Var2. The linear regression equation is: Var1 = 0.04446 * Var2 + 0.9037. Sample size: N = 50. The linear correlation coefficient is R = 0.544, the number of degrees of freedom is k = 48. There is a linear correlation, R> 0 at the p <0.001 significance level. Determination coefficient = 0.296
ческой модели ОП прогностически неблагоприятными параметрами – предикторами летальности, по результатам настоящего исследования следует считать:
-
1. Повышение индекса интоксикации Кальф-Калифа в модификации Хомича и Костюченко свыше 1,9;
-
2. Повышение показателя интоксикации выше 0.71;
-
3. Повышение уровня ферментов АЛТ, АСТ выше пороговых значений (>45 ЕД и >31 ЕД соответственно);
-
4. Увеличение концентрации амилазы крови более 100 ЕД/л;
-
5. Увеличение концентрации диастазы мочи более 124 ЕД/л;
-
6. Увеличение диаметра холедоха более 8 мм.
-
7. Увеличение размеров головки поджелудочной железы больше 30.0 мм,
-
8. Увеличение диаметра селезеночной вены больше 7.0 мм
-
9. Наличие свободной жидкости в брюшной полости.
По данным настоящего исследования, наиболее тяжелым и прогностически неблагоприятным является 1 кластер, куда вошли данные 30 пациентов, с максимальным уровнем летальности и максимальным пребыванием в стационаре. Эти пациенты требуют большего диагностического внимания с обязательным использованием эндоскопических и сонографических методов исследования в динамике.
У пациентов 1 и 2 кластеров, которые характеризовались более тяжелым течением заболевания и длительным пребыванием в стационаре, а также большей частотой оперативных вмешательств,выявлено повышение индекса интоксикации Кальф-Калифа в модификации Хомича и Костюченко свыше 1,9. В то время как для пациентов с более легким течением заболевания, которые относились к 3 кластеру, данный показатель находился в пределах 1,05 – 1,82.
Максимальное повышение концентрации ферментов поджелудочной железы и среднее значение АЛТ было выявлено у пациентов 2 кластера, в котором превалировали пациенты с ОП небилиарного генеза.
Наиболее часто встречаемое увеличение головки поджелудочной железы, расширение селезеночной вены и наличие свободной жидкости в брюшной полости по данным УЗИ были характерными признаками заболевания также для пациентов 2 кластера.
В связи с тем, что у этих пациентов отмечалось наиболее тяжелое начало ОП с выраженным уровнем интоксикации, данной группе больных рекомендуется начинать активную дезинтоксикационную и этиотропную терапию с первых часов пребывания в стационаре.
Прогностически «относительно легким» течением ОП характеризовались данные 32 пациентов, отнесенных к 3 кластеру. Для данной категории пациентов мы считаем возможным ограничить частоту использования практически всех методов исследования.
Заключение
Для прогнозирования течения ОП и длительности пребывания в стационаре наиболее показательными параметрами являются:
-
- индексы интоксикации: Кальф-Калифа в модификации Костюченко и Хомича, Рейса, Гаркави, соотношение лейкоцитов к СОЭ, лейкоцитарный индекс, общий показатель интоксикации;
-
- сонографические признаки: размеры головки поджелудочной железы, диаметр селезеночной вены, наличие свободной жидкости в брюшной полости;
-
- биохимические маркеры: концентрация амилазы крови, диастазы мочи.
В нашем исследовании степень тяжести пациентов при поступлении высоко прямо коррелировала с показателями индексов интоксикации Рейса и общего показателя интоксикации и обратно коррелировала с лейкоцитарным индексом, индексом Гаркави и соотношением лейкоцитов к СОЭ.Именно эти индексы интоксикации являются наиболее проностически значимыми для пациентов с ОП.
Список литературы Использование нейросетевого моделирования для прогнозирования течения острого панкреатита
- Munigala S, Yadav D. Case-fatality from acute pancreatitis is decreasing but its population mortality shows little change. Pancreatology. 2016; 16(4): 542-550. http://doi.org/10.1016/j.pan.2016.04.008
- Kurti F, Shpata V, Kuqo A, Duni A, Roshi E, Basho J. Incidence of acute pancreatitis in Albanian population. Mater Sociomed. 2015; 27(6): 376-369. http://doi.org/10.5455/msm.2015.27.376-379
- Ельский И.К., Васильев А.А., Смирнов Н.Л. Эффективность прогностических шкал в стратификации острого панкреатита. Обзор литературы. Хирургическая практика. 2020;3(43):17-28. [El'skij I.K., Vasil'ev A.A., Smirnov N.L. Jeffektivnost' prognosticheskih shkal v stratifikacii ostrogo pankreatita. Obzor literatury. Hirurgicheskaja praktika. 2020; 3(43); 17-28. (In Russ.).] https://doi.org/10.38181/2223-2427-2020-3-17-28
- Karakayali FY. Surgical and interventional management of complications caused by acute pancreatitis. World J Gastroenterol. 2014; 20(37): 412-423. https://doi:10.3748/wjg.v20.i37.13412
- Подлужный В.И. Острый панкреатит: современные представления об этиологии, патогенезе, диагностике и лечении. Фундаментальная и клиническая медицина. 2017;2(4):62-71. [Podluzhnyj V.I. Ostryj pankreatit: sovremennye predstavlenija ob jetiologii, patogeneze, diagnostike i lechenii. Fundamental'naja i klinicheskaja medicina. 2017; 2(4): 62-71. (In Russ.).]
- Kokosis G, Perez A, Pappas TN. Surgical management of necrotizing pancreatitis: an overview. World J Gastroenterol. 2014; 20(43): 16106-16112. https://doi:10.3748/wjg.v20.i43.16106
- Borodin NA, Maltceva OV, Gibert BK, Zaitcev EJ. Modern approaches to treatment of destructive forms of pancreatitis, ways to reduce mortality. Medical Science and Education of the Ural. 2015; 2-1(82): 70-73. https://doi:10.23946/2500-0764-2017-2-4-62-71
- Акимов А.А., Стяжкина С.Н., Валинуров А.А., Вареник Е.Ю., Королев В.К., Матусевич А.Е. Острый панкреатит в молодом возрасте. Медико-фармацевтический журнал «Пульс». 2018; 20(4): 18-21. [Akimov A.A., Stjazhkina S.N., Valinurov A.A., Varenik E.Ju., Koroljov V.K., Matusevich A.E. Ostryj pankreatit v molodom vozraste. Mediko-farmacevticheskij zhurnal «Pul's». 2018; 20(4): 18-21. (In Russ.).]
- Stjazhkina SN, Protopopov VA, Darovskih AA, Akimov AA. Mortality from acute pancreatitis in Udmurt Republic for the period of 2012-2015. Journal of Scientific Articles Health and Education in the XXI Century. 2017; 19(9): 119-121.
- Setiawan VW, Pandol SJ, Porcel J, Wilkens LR, Le Marchand L, Pike MC, et al. Prospective Study of Alcohol Drinking, Smoking, and Pancreatitis: The Multiethnic Cohort. Pancreas. 2016; 45(6): 819-825. https://doi:10.1097/MPA.0000000000000657
- Александрович Ю.С., Гордеев В.И. Оценочные и прогностические шкалы в медицине критических состояний. СПб: Сотис; 2007. [Aleksandrovich Ju.S., Gordeev V.I. Ocenochnye i prognosticheskie shkaly v medicine kriticheskih sostojanij. SPb: Sotis; 2007. (In Russ.).]
- Ельский И.К., Ширшов И.В., Медведев А.В. Особенности оценки тяжести острого некротического панкреатита и их прогностическое значение. Вестник неотложной и восстановительной хирургии. 2017; 2-3(2): 238-242. [El'skij I.K., Shirshov I.V., Medvedev A.V. Osobennosti ocenki tjazhesti ostrogo nekroticheskogo pankreatita i ih prognosticheskoe znachenie. Vestnik neotlozhnoj i vosstanovitel'noj hirurgii. 2017; 2-3(2): 238-242. (In Russ.).]
- Kaplan M, Ates I, Oztas E, et al. A New Marker to Determine Prognosis of Acute Pancreatitis: PLR and NLR Combination. J Med Biochem. 2018; 37(1): 21-30. http://dx.doi.org/10.1515/jomb-2017-0039
- Лях Ю. Е. Анализ результатов медико-биологических исследований и клинических испытаний в специализированном статистическом пакете MEDSTAT. Вестник гигиены и эпидемиологии. 2004; 8(1): 155-167. [Ljah Ju. E. Analiz rezul'tatov medikobiologicheskih issledovanij i klinicheskih ispytanij v specializirovannom statisticheskom pakete MEDSTAT. Vestnik gigieny i jepidemiologii. 2004; 8(1): 155-167. (In Russ.).]
- Сперанский И.И., Самойленко Г.Е., Лобачева М.В. Общий анализ крови – все ли его возможности исчерпаны? Интегральные индексы интоксикации как критерии оценки тяжести течения энндогенной интоксикации, ее осложнений и эффективности проводимого лечения. Здоровье Украины. 2009; 6(19): 51-57. [Speranskij I.I., Samojlenko G.E., Lobacheva M.V. Obshhij analiz krovi – vse li ego vozmozhnosti ischerpany? Integral'nye indeksy intoksikacii kak kriterii ocenki tjazhesti techenija jenndogennoj intoksikacii, ee oslozhnenij i jeffektivnosti provodimogo lechenija. Zdorov'e Ukrainy. 2009; 6(19): 51-57. (In Russ.).]
- Боровиков В. STATISTICA. Искусство анализа данных на компьютере: Для профессионалов. 2-е изд. СПб.: Питер; 2003. [Borovikov V. STATISTICA. Iskusstvo analiza dannyh na komp'jutere: Dlja professionalov. 2-e izd. SPb.: Piter; 2003. (In Russ.).]
- Лойд Э., Ледерман У., Айвазян С.А., Тюрина Ю.Н. Справочник по прикладной статистике. М.: Финансы и статистика;1990. [Lojd Je., Lederman U., Ajvazjan S.A., Tjurina Ju.N. Spravochnik po prikladnoj statistike. M.: Finansy i statistika; 1990. (In Russ.).]
- Лапач С.Н. Статистические методы в медико-биологических исследованиях с использованием EXCEL. К.: МОРИОН; 2002. [Lapach S.N. Statisticheskie metody v mediko-biologicheskih issledovanijah s ispol'zovaniem EXCEL. K.: MORION; 2002. (In Russ.).]
- Щекотов В.В. Патогенез и клиническая диагностика синдрома эндогенной интоксикации. В кн.: Корюкина И.П. Лабораторная диагностика синдрома эндогенной интоксикации. Пермь: ПГМА; 2005: 4-17. [Shhekotov V.V. Patogenez i klinicheskaja diagnostika sindroma jendogennoj intoksikacii. V kn.: Korjukina I.P. Laboratornaja diagnostika sindroma jendogennoj intoksikacii. Perm': PGMA; 2005: 4-17 (in Russ.)];
- Белозеров И.В. Оценка эффективности предоперационного подготовительного этапа у больных раком ободочной кишки, осложненного острой непроходимостью кишечника. Харківська хірургічна школа. 2010; 6(44): 6-10. [Belozerov I.V. Ocenka jeffektivnosti predoperacionnogo podgotovitel'nogo jetapa u bol'nyh rakom obodochnoj kishki, oslozhnennogo ostroj neprohodimost'ju kishechnika. Harkіvs'ka hіrurgіchna shkola. 2010; 6(44): 6-10. (In Russ.).]
- Галлямов Э.А., Агапов М.А., Луцевич О.Э., Какоткин В.В. Современные технологии лечения инфицированного панкреонекроза: дифференцированный подход. Анналы хирургической гепатологии. 2020;25(1):69-78. https://doi.org/10.16931/1995-5464.2020169-78 [Gallyamov E.A., Agapov M.A., Lutsevich O.E., Kakotkin V.V. Advanced technologies for treatment of infected pancreatic necrosis: differentiated approach. Annaly khirurgicheskoy gepatologii = Annals of HPB Surgery. 2020;25(1):69-78. (In Russ.) https://doi.org/10.16931/1995-5464.2020169-78]
- Левченко К.Ф., Чернобай Г.Н. Информативность стандартных параклинических тестов у пациентов с раком молочной железы. Вестник НГУ. Серия: Биология, клиническая медицина. 2010; 8(1): 15-154. [Levchenko K.F., Chernobaj G.N. In formativnost' standartnyh paraklinicheskih testov u pacientov s rakom molochnoj zhelezy. Vestnik NGU. Serija: Biologija, klinicheskaja medicina. 2010; 8(1): 15-154. (In Russ.).]
- Лях Ю. Е. Обоснование выбора оптимального числа кластеров для метода самоорганизующихся карт Кохонена. Клиническая информатика и телемедицина. 2005; 2(1): 124. [Ljah Ju. E. Obosnovanie vybora optimal'nogo chisla klasterov dlja metoda samoorganizujushhihsja kart Kohonena. Klinicheskaja informatika i telemedicina. 2005; 2(1): 124. (In Russ.).] http://dx.doi.org/10.5152/tjg.2017.25041


