Использование пиридоксина для повышения противоопухолевой активности метионин-гамма-лиазы на моделях перевиваемых опухолей мышей
Автор: Давыдов Д.Ж., Морозова Е.А., Комарова М.В., Ануфриева Н.В., Завильгельский Г.Б., Манухов И.В., Демидкина Т.В., Трещалина Е.М., Покровский В.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.16, 2017 года.
Бесплатный доступ
Приведены экспериментальные данные монотерапии и комбинированной терапии моделей перевиваемых опухолей мышей препаратами метионин-γ-лиазы (МГЛ) и пиридоксина гидрохлорида. Изучены МГЛ Clostridium sporogenes и Citrobacter freundii. Использованы перевиваемые модели опухолей мышей: карцинома легкого Льюис (LLC), меланома В16, лимфолейкоз P388, лимфолейкоз L1210, лимфаденоз Фишера L5178y. На моделях P388, L5178y МГЛ не показала противоопухолевой активности ни в монорежиме, ни в сочетании с пиридоксином. На модели L1210 было получено пограничное увеличение продолжительности жизни (УПЖ) 22 %, р=0,035 при применении МГЛ C. sporogenes в дозе 2000 Е/кг 11-кратно внутрибрюшинно с интервалом 12 ч. На LLC показано, что на 1-е сут после окончания лечения одновременное внутрибрюшное (в/б) введение МГЛ C. sporogenes 400 Е/кг 4-кратно с интервалом 48 ч и пиридоксина в дозе 250 мг/кг вызывало ТРО=55 % (р
Пиридоксин, карцинома лёгкого льюис (llc), меланома в16, лимфолейкоз p388, лимфаденоз фишера l5178y, метионин-γ-лиаза, мгл, витамин в6, противоопухолевые ферменты
Короткий адрес: https://sciup.org/140254139
IDR: 140254139 | УДК: 577.114.5:616-006.6:547.458]-092.9 | DOI: 10.21294/1814-4861-2017-16-5-27-35
Текст научной статьи Использование пиридоксина для повышения противоопухолевой активности метионин-гамма-лиазы на моделях перевиваемых опухолей мышей
L-метионин – незаменимая серосодержащая алифатическая α-аминокислота, которая необходима для синтеза витаминов, антиоксидантов, коферментов, полиаминов и ряда других молекул, требующихся для нормального функционирования клетки [1–3]. L-метионин является первой аминокислотой, которая используется в процессе синтезa белков и служит предшественником биосинтеза цистеина. Метиониновая зависимость опухолевых клеток была замечена ещё в 1959 г. на модели карциносаркомы Уокера у крыс [4]. Ограничение поступления метионина в метионинзависимые опухолевые клетки может приводить к остановке клеточного цикла в поздней фазе S/G2 как in vitro , так и in vivo [5, 6]. Остановка клеточного цикла в фазе S/G2 повышает вероятность их гибели.
Метионин-γ-лиаза (МГЛ, КФ 4.4.1.11) – пиридоксальфосфат-5’-(ПЛФ)-зависимый фермент [7, 8], который катализирует превращение L-метионина в α-кетобутират, метилмеркаптан и аммиак в реакции α, γ-элиминирования (рис. 1). МГЛ представляет интерес в качестве противоопухолевого агента, поскольку снижает концентрацию метионина в плазме крови, и метионин-зависимые опухолевые клетки погибают [9]. Ранее было показано наличие цитотоксичности МГЛ C. sporogenes и C. freundii на культурах опухолевых клеток K562, РС-3, LnCap, MCF7, L5178y, SCOV-3, a также установлены основные фармакокинетические параметры МГЛ и динамика снижения уровня метионина плазмы крови после её однократного введения [10, 11]. В частности, показано, что введение МГЛ C. sporogenes мышам внутривенно однократно в дозе 1000 Е/кг снижает уровень метионина ниже 0,05 мкМ/л в течение 8 час [11].
В 1973 г. были опубликованы данные об эффективности MGL С. sporogenes in vitro в культуре клеток мышиной мастоцитомы P815 и in vivo на саркоме Уокера 256 крыс [12]. К MGL из Pseudomonas putida чувствительны культуры клеток гемобластозов CEM, Molt4, Molt16, K562, HL60 [13]. Цитотоксичность MGL из Aspergillus flavipes продемонстрирована на культурах клеток рака предстательной железы PC-3, печени HepG2
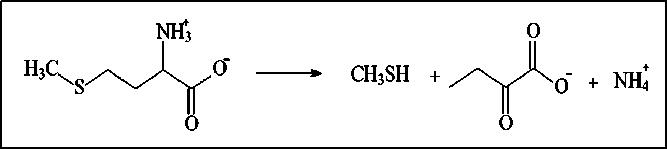
Рис. 1. Реакция γ-элиминирования L-метионина и молочной железы MCF-7 [13]. MGL из Idioma-rina цитотоксична в отношении клеток острого Т-лимфобластного лейкоза СЕМ-С7 и MOLT-4 и острого миелобластного лейкоза MV4-11 и MOLM-13: IC50 составила 1,7; 0,3; 0,64; 0,03 Ед/мл соответственно [15]. В ряде исследований показан синергизм цитотоксичности MGL и известных противоопухолевых препаратов. Например, на культуре клеток CCRF-CEM рекомбинантная MGL повышает цитотоксичность 5-фторурацила и фолиевой кислоты [16].
Эффективность фермента (нативного или рекомбинантного) из P. putida показана на широком спектре перевиваемых солидных опухолей животных и человека: саркоме Йошида, немелкоклеточном раке легкого NCL-Н460 и Ma44, медуллобластоме Daoy; нейробластоме LAN-1 и NMB-7, раке толстой кишки HCT116, HCT15, HT29, Colo205 и SW620, фибросаркоме HT1080, плоскоклеточном раке KB3-1, KB8-5 [17, 18]. На модели саркомы Уокера 256 у крыс Wistar MGL более эффективно замедляла опухолевый рост по сравнению с безметиониновой диетой [12].
На ксенографтах рака толстой кишки человека Colo205 и SW620, а также рака молочной железы человека MX-t показан синергизм комбинации рекомбинантной MGL с цисплатином [19–21]. На модели карциномы легкого Льюис мышей обнаружен потенцирующий эффект MGL при совместном применении с 5-фторурацилом [20]. На ксенографтах нейробластомы и глиобластомы человека эффективными были комбинации MGL с винкристином, темозоломидом или кармустином [17, 22]. В то же время эффективность МГЛ в монорежиме остается ограниченной.
Пиридоксин – одна из форм витамина В6, который является предшественником пиридоксаль-5’-фосфата (ПЛФ) – кофермента МГЛ [11]. В связи с тем, что МГЛ является ПЛФ-зависимым ферментом, важным становится вопрос о влиянии пиридоксина на противоопухолевую активность МГЛ, так как при высокой дозе МГЛ и недостаточном содержании кофермента активность МГЛ проявляется не в полной мере.
Цель исследования – определить чувствительные опухолевые модели in vivo к терапии МГЛ, а также диапазон эффективных и максимально переносимых доз; показать возможность увеличения противоопухолевого эффекта МГЛ при комбинированной терапии с пиридоксином на чувствительных моделях злокачественных опухолей мышей.
Материал и методы
Животные : мыши чистых линий DBA2 и С57Bl6, и гибридные BDF1[DBA2×C57Bl6], обоих полов, разведения РОНЦ им. Н.Н. Блохина Минздрава России.
Опухолевые модели. Лимфолейкозы P388, L1210, лимфаденоз Фишера L5178y – внутрибрюшинная трансплантация (в/б) по 106 клеток; эпидермоидная карцинома лёгких Льюис LLC, меланома В16 – подкожная трансплантация (п/к) по 5×106 клеток.
Препараты. МГЛ из C. sporogenes (выделена и очищена в ФГБУН «ИМБ им. В.А. Энгельгардта» или ФГУП ГосНИИГенетика), и С freundii 80-250 Е/мл (ФГБУН «ИМБ им. В.А. Энгельгардта»). Пиридоксина гидрохлорид, 50 мг/мл, ООО «Виал».
Дозы и режимы введения препаратов . На модели P388 МГЛ вводили в дозах 50, 100 или 200 Е/кг внутривенно (в/в), 4-кратно с интервалом 48 ч, на модели L1210 – в дозах 1000 или 2000 Е/кг в/б 9- или 11-кратно с интервалом 12 ч, на модели L5178y – в дозах от 4000 до 16000 в/б 9-кратно с интервалом 24 ч. Лечение гемобластозов начинали через 24 ч после трансплантации. На модели LLC МГЛ вводили в дозах 200 или 400 Е/кг в/в 4-кратно с интервалом 48 ч, на модели В16 МГЛ вводили в/в или в/б 20-кратно в дозах 500, 1000 или 2000 Е/кг, интервал между введениями 12 ч. Лечение солидных опухолей начинали через 48 ч после трансплантации. Пиридоксин вводили в дозах 250, 300 или 500 мг/кг п/к или в/б одновременно с МГЛ.
Оценка противоопухолевого эффекта . Эффективность лечения мышей оценивали по увеличению продолжительности жизни (УПЖ) и торможению роста опухоли (ТРО). Значимыми считали УПЖ >25 % и ТРО >50 %. Показатели эффективности определяли в сравнении c контролем.
Оценка переносимости. О переносимости лечения судили по состоянию и поведению мышей. Состояние животных визуально оценивали ежедневно. Павших или умерщвленных передозировкой эфирного наркоза мышей подвергали аутопсии для визуального определения патологических изменений внутренних органов. Фиксировали достоверное уменьшение массы тела (≥30 %) и селезенки (косвенные признаки общей, гематологической и иммунотоксичности), а также гибель от токсичности. Сроки гибели леченых животных сравнивали с контрольной группой.
Статистический анализ данных выполняли в среде пакета IBM SPSS Statistics 21. Сравнения выполняли с помощью одно- и двухфакторного дисперсионного анализа, попарные сравнения групп по критерию Тьюки. В работе приведены среднее и среднеквадратическое отклонение (M ± s). Различия считали статистически значимыми при p ≤0,05.
Результаты
Эффективность МГЛ на модели лимфолей-коза Р388 . МГЛ C. sporogenes вводили в/в в дозах 50, 100, и 200 Е/кг 4-кратно с интервалом 48 ч. Пиридоксин вводили в дозах 250 или 500 мг/кг в/б одновременно с МГЛ. Терапия лимфолейкоза P388 в изученном диапазоне доз была переносимой, но неэффективной. УПЖmax – 7 %, при комбинированной терапии УПЖmax– 9 %, различия статистически недостоверны. Средняя продолжительность жизни мышей, не получавших пиридоксин (n=34), составила 11,97±0,969 дней (среднее и стандартное отклонение), получавших пиридоксин в/б (n=28) – 12,61 ± 0,685 дней, получивших пиридоксин п/к (n=36) – 11,97 ± 0,878 дней, различия между группами статистически недостоверны. Переносимость всех видов лечения была удовлетворительной, гибели мышей от токсичности не отмечали.
Эффективность МГЛ на модели лимфолейко-за L1210. МГЛ C. sporogenes вводили в дозах 1000 или 2000 Е/кг в/б 9- или 11-кратно с интервалом между введениями 12 ч. Терапия лимфолейкоза L1210 в изученном диапазоне доз была умеренно эффективной. Достоверный эффект в виде УПЖ=22 % наблюдался только при дозе 2000 Е/кг, демонстрируя статистически значимое увеличение продолжительности жизни против дозы 1000 Е/кг (р=0,014) и против контроля (р=0,035). Таким образом, применение МГЛ в разовой дозе 2000 Е/кг при многократном введении с интервалом 12 ч было минимально эффективным и переносимым, однако чувствительность модели L1210 к МГЛ также оказалась недостаточной.
Эффективность МГЛ на модели лимфаде-ноза Фишера L5178y . МГЛ вводили в разовых дозах 4000 Е/кг (в монорежиме или в сочетании с пиридоксином), 8000 Е/кг (в монорежиме или в сочетании с пиридоксином) и 16000 Е/кг в/б 9-кратно. Во всех изученных дозовых режимах терапия лимфаденоза Фишера L5178у с МГЛ C. sporogenes не выявила достоверного противоопухолевого эффекта. Комбинированная терапия в сочетании с пиридоксином в дозах 4000 и 8000 также не показала эффективности (р=0,060). При разовых дозах выше 4000 Е/кг, как в схемах лечения с пиридоксином, так и без него была получена выраженная токсичность с гибелью с 5-х по 14-е сут. Так, в группе мышей, получивших МГЛ в дозе 16000 Е/кг гибель наблюдалась после 4-го введения, все мыши пали на 56-е сут после трансплантации при явлениях выраженной адинамии, снижения массы тела (>20 % по сравнению с исходным уровнем), на аутопсии были выявлены признаки выраженной гепатотоксичности и перитонита. В группе мышей, получивших МГЛ в дозе 8000 Е/кг (как в монорежиме, так и в сочетании с пиридоксином), животные погибали на 9–14-е сут после трансплантации (после 8 введений), при аналогичных признаках токсичности. Использование дозы 4000 Е/кг
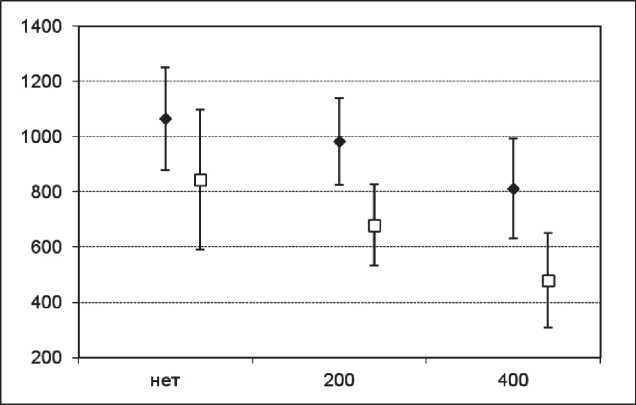
Рис. 2. Средние размеры опухолей у мышей c LLC, МГЛ или МГЛ + пиридоксин, 10-е сут, мм3, 95 % ДИ. По оси абсцисс указаны дозы МГЛ: ♦ – без пиридоксина □ – пиридоксин в дозе 250 мг/кг
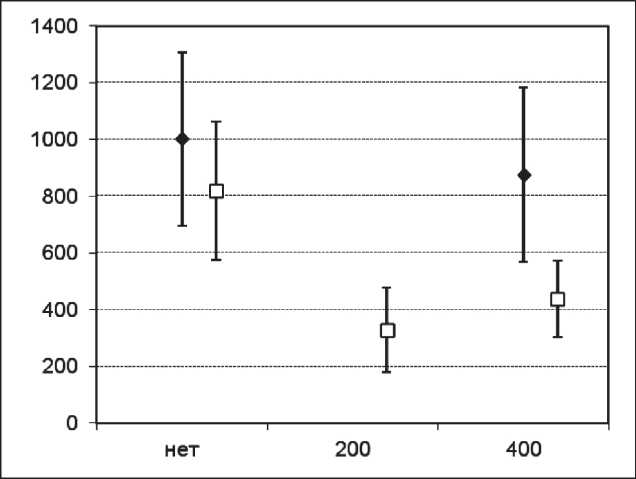
Рис. 3. Средние размеры опухолей у мышей c LLC, МГЛ Ñ. freundii 200 или 400 Е/кг четырехкратно или МГЛ + пиридоксин 500 мг/кг четырехкратно, 10-е сут, мм3, 95 % ДИ. По оси абсцисс указаны дозы МГЛ: ♦ – без пиридоксина □ – пиридоксин в дозе 250 мг/кг
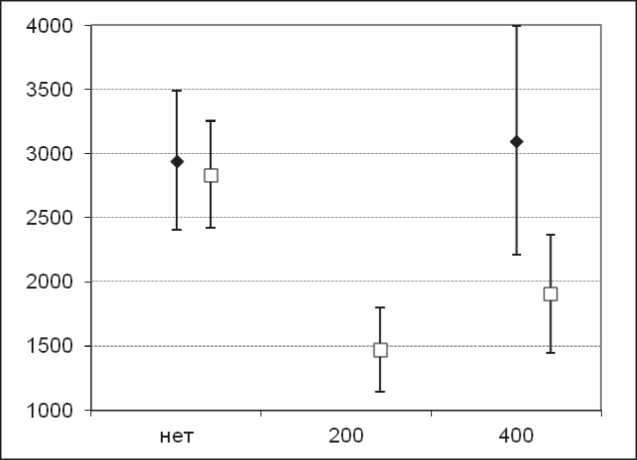
Рис. 4. Средние размеры опухолей у мышей c LLC, МГЛ 200 или 400 Е/кг четырехкратно МГЛ + пиридоксин 500 мг/кг четырехкратно, 18-е сут, мм3, 95 % ДИ. По оси абсцисс указаны дозы МГЛ: ♦ – без пиридоксина □ – пиридоксин в дозе 250 мг/кг
9-кратно не сопровождалось гибелью, но также было токсичным для животных: снижение массы тела после последнего дня лечения составило 18 % по сравнению с исходной.
Таким образом, увеличение дозы выше 4000 Е/кг в/б во много раз чаще приводило к гибели животных. Максимальная переносимая доза МГЛ C. sporogenes при многократном в/б введении с интервалом 24 ч, использованная для последующих экспериментов, составила 2000 Е/кг, до 10 введений. Введение пиридоксина не усугубляло токсичности МГЛ.
Эффективность МГЛ C. sporogenes на модели эпидермоидной карциномы легкого Льюис (LLC) . МГЛ C. sporogenes вводили в дозах 200 или 400 Е/кг в/в 4-кратно с интервалом 48 ч. На модели LLC показано наличие достоверного противоопухолевого эффекта. По критерию ТРО был продемонстрирован пограничный эффект МГЛ С. sporogenes в разовой дозе 400 МЕ/кг в сочетании с пиридоксином в дозе 250 мг/кг (рис. 2). На 10-е сут после трансплантации опухоли одновременное введение МГЛ и пиридоксина вызывало ТРО на уровне 55 %, при этом монотерапия МГЛ или пиридоксином в аналогичных дозах и режимах применения вызывала ТРО –24 и 21 % соответственно.
Статистически значимые отличия выявлены на 10-е сут наблюдения (1-й день после окончания лечения) в группах МГЛ в дозе 400 МЕ/кг + пиридоксин 250 мг/кг (p<0,001 по сравнению с контрольной группой) и МГЛ в дозе 200 МЕ/кг + пиридоксин 250 мг/кг (p=0,019 по сравнению с контрольной группой). Эффект в группе МГЛ в дозе 200 МЕ/кг + пиридоксин 250 мг/кг пролонгировался до 18-х сут после трансплантации (9-е сут после окончания лечения), р=0,02 против контрольной группы. При попарном сравнении опытных групп достоверные отличия были выявлены для монотерапии МГЛ 200 Е/кг и комбинированной терапии МГЛ 400 Е/кг + пиридоксин (р=0,001) на 10-е сут после трансплантации. Эффект МГЛ в дозе 400 МЕ/кг + пиридоксин 250 мг/кг на 10-е сут был также достоверно выше по сравнению с монотерапией пиридоксином (р=0,031). Переносимость лечения была удовлетворительной, гибели мышей от токсичности не наблюдалось. Добавление пиридоксина значимо увеличивало эффективность МГЛ для дозы МГЛ 200 Е/кг (р=0,005) и для дозы МГЛ 400 Е/кг (р=0,007).
Эффективность МГЛ C. freundii на модели карциномы легкого Льюис LLC. Для воспроизведения эффекта МГЛ в сочетании с пиридоксином был проведен эксперимент с МГЛ С. freundii в дозах 200 или 400 МЕ/кг в/в и пиридоксина в дозе 500 мг/кг в/б (рис. 3, 4). Монотерапия МГЛ С. freundii, как и монотерапия МГЛ C. sporogenes , не давала достоверного эффекта на модели LLC. Добавление пиридоксина в дозе 500 мг/кг дало достоверный эффект у МГЛ С. freundii как в дозе
400 МЕ/кг, так и в дозе 200 МЕ/кг. Значение ТРО на 10-е сут после трансплантации (1-е сут после окончания терапии) составило 67 и 56 %, достоверное ТРО сохранялось на протяжении 18 сут после трансплантации (9-е сут после окончания лечения). Получить достоверное значение УПЖ, как и в случае с МГЛ С. freundii, не удалось. Двукратное увеличение разовой дозы пиридоксина в монотерапии (с 250 до 500 мг/кг) не повышало эффективности монотерапии. Эффект взаимодействия, оцененный по размерам опухоли на 18-е сут, оказался статистически значимым и свидетельствует о том, что пиридоксин уменьшает размер опухоли только при наличии МГЛ (р=0,003).
Как на 10-е, так и на 18-е сут после трансплантации использование комбинированной терапии МГЛ С. freundii давало достоверный биологически значимый эффект (р=0,001–0,038). Эффективность комбинированной терапии была также достоверной по отношению к монотерапии МГЛ в дозе 400 МЕ/кг, а эффект комбинированной терапии МГЛ 200 МЕ/кг + пиридоксин 500 мг/кг был также значимо выше, чем при монотерапии пиридоксином в аналогичной дозе (p=0,016) на 10-е сут после трансплантации (1-е сут после окончания лечения) и на 18-е сут (р=0,003) после трансплантации (9-е сут после окончания лечения).
Эффективность МГЛ на модели меланомы В16. МГЛ C. sporogenes вводили в/в или в/б 20кратно в дозах 500, 1000 или 2000 Е/кг, интервал между введениями 12 ч. Пиридоксин вводили в дозе 300 мг/кг. Для модели меланомы В16 показана умеренная чувствительность к терапии МГЛ C. sporogenes. Добавление к схеме лечения пиридоксина достоверно повышало противоопухолевую активность фермента. По сравнению с контрольной группой на 10-е сут после трансплантации наблюдался достоверный значимый противоопухолевый эффект: ТРО 59 % в 1-й день после окончания лечения в группе 2000 Е/кг в/б (р=0,045), 53 % в 1-й день после окончания лечения в группе МГЛ 1000 Е/кг в/б + пиридоксин (р=0,085 различия не достоверны) и 50 % в 1-й день после окончания лечения в группе 500 Е/кг в/в + пиридоксин (р=0,104 различия недостоверны). Различия между группами МГЛ 1000 Е/кг в/б + пиридоксин и МГЛ 1000 Е/кг в/б были значимыми на 3-и сут после окончания лечения (р=0,034), что свидетельствует о влиянии пиридоксина на повышение противоопухолевой активности МГЛ при данной схеме лечения. МГЛ 500 Е/кг в/в + пиридоксин и МГЛ 500 Е/кг в/в были статистически не достоверными (p>0,05), что говорит о сопоставимой противоопухолевой активности МГЛ и МГЛ в сочетании с пиридоксином. На 14-й день после трансплантации (3-и сут после окончания лечения) наблюдаемый противоопухолевый эффект был менее выраженным, но в некоторых группах также достигал 35 % (в группе 2000 Е/кг в/б (р=0,395, различия статистически не значимы) и 45 % в группе МГЛ 1000 Е/кг в/б + пиридоксин (р=0,200, различия статистически не значимы). Увеличение продолжительности жизни за счёт применения комбинированной терапии по отношению к монотерапии МГЛ не было статистически значимым.
Обсуждение
Применение в онкологии ферментных препаратов, необратимо разрушающих определенные аминокислоты, основано на метаболической специфичности некоторых опухолевых клеток, характерной особенностью которых являются отсутствие или низкая активность синтетаз определенных аминокислот [23, 24]. Среди представителей этого класса наиболее известна L-аспарагиназа E. coli , которая применяется для лечения острых лимфобластных лейкозов уже более 30 лет [25–27]. В последние годы выделены и изучены L-аспарагиназы из различных источников [28–30], L-лизин-альфа-оксидаза Trichoderma cf. aureoviride Rifai [31], L-фенилаланин-аммиак-лиаза [32], L-аргининдезиминаза [33] и др.
Сложность изучения противоопухолевой активности ряда ферментов определяется необходимостью наличия в среде кофермента для реализации ферментативной активности. Одним из примеров кофермента ряда ферментов, катализирующих разнообразные реакции превращений аминокислот и аминов, является ПЛФ. Молекулярные механизмы реакций, катализируемых ПЛФ, были предложены практически одновременно и независимо А.Е. Браунштейном и М.М. Шемякиным, Д. Мец-лером и Э. Снеллом [34–36].
Существующего в плазме крови мышей исходного уровня ПЛФ для поддержания реакции в течение всего периода циркуляции фермента недостаточно, поэтому для выявления противоопухолевого эффекта МГЛ необходимо дополнительное введение ПЛФ [37, 38]. Базовый уровень ПЛФ в плазме крови мышей составляет 0,3 мкМ, для проявления эффекта МГЛ необходимо увеличить его концентрацию до стабильного уровня 5–10 мкМ в течение 2–5 ч после введения фермента [38]. В отсутствие дополнительного введения ПЛФ концентрация метионина снижается до <5 % исходной непосредственно после введения МГЛ в средних дозах, а инактивация МГЛ в связи с диссоциацией ПЛФ у мышей происходит через 2 ч после введения [39, 40]. В качестве возможных источников кофермента ранее были изучены подкожно имплантируемые помпы с постоянным высвобождением ПЛФ из резервуара и рацион с повышенным содержанием пиридоксина [38]. К достоинствам первой методики относятся контролируемое высвобождение ПЛФ и возможность получения постоянной прогнозируемой концентрации в плазме крови, к достоинствам второй – неинвазивность. Однако адаптация подобных методик использо- вания МГЛ в клинической практике трудоемка и обладает крайне низкой комплаентностью: требует либо имплантации подкожной помпы, либо постоянного мониторинга уровня ПЛФ в плазме крови. В этой связи представлялась актуальной разработка простого и воспроизводимого метода оценки противоопухолевого эффекта МГЛ с использованием доступных препаратов, который может быть применен в клинической практике без опасности снижения эффективности терапии.
В такой модели в качестве источника ПЛФ может быть использован его предшественник – пиридоксин, существующий в виде препарата, разрешенного для парентерального применения у человека. В качестве базовых предпосылок при разработке модели были использованы известные параметры фармакокинетики, метаболизма и токсичности пиридоксина у мышей [38], а также возможность его применения вместе с МГЛ по примеру компонентов комбинированной терапии, что может быть относительно легко перенесено в клиническую практику.
В нашем исследовании пиридоксин был использован в качестве модификатора противоопухолевой активности МГЛ in vivo с целью повышения эффективности терапии. Модели гемобластозов мышей (L5178у, P388 и L1210) оказались малочувствительными к терапии МГЛ как в монорежиме, так и в сочетании с пиридоксином. Нечувствительность указанных моделей может быть объяснена как исходной их нечувствительностью к МГЛ, независимо от эффективности протекания ферментативной реакции, так и низкой использованной дозой МГЛ или недостаточностью поддерживаемой концентрации ПЛФ во время циркуляции МГЛ в плазме
Список литературы Использование пиридоксина для повышения противоопухолевой активности метионин-гамма-лиазы на моделях перевиваемых опухолей мышей
- Thomas D., Surdin-Kerjan Y. Metabolism of sulfur amino acids in Saccharomyces cerevisiae. Microbiol Mol Biol Rev. 1997 Dec; 61 (4): 503-32
- Ravanel S., Gakière B., Job D., Douce R. The specific features of methionine biosynthesis and metabolism in plants. Proc Natl Acad Sci USA. 1998 Jun 23; 95 (13): 7805-12
- Sekowska A., Kung H., Danchin A. Sulfur metabolism in Escherichia coli and related bacteria: facts and fiction. J Mol Microbiol Biotechnol. 2000 Apr; 2 (2): 145-77
- Sugimura T., Birnbaum S.M., Winitz M., Greenstein J.P. Quantitative nutritional studies with water-soluble, chemically defined diets. VII. The forced feeding of diets eaсh lacking in one essential amino acid. Arch Biochem Bioophys. 1959; 81 (2): 448-455
- Guo H.Y., Herrera H., Groce A., Hoffman R.M. Expression of the biochemical defect of methionine dependence in fresh patient tumors in primary histoculture. Cancer Res. 1993; 53 (11): 2479-83


