Использование препарата «Коллапан» при остеомиелите позвоночника в эксперименте
Автор: Ардашев И.П., Черницов С.В., Веретельникова И.Ю., Бунина Ольга Геннадьевна, Иванова Олеся Александровна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2012 года.
Бесплатный доступ
Цель исследования. Анализ воздействия препарата «Коллапан» на процессы регенерации костной ткани при экспериментальном остеомиелите позвоночника. Материалы и методы. Экспериментальные остеомиелитические дефекты позвонков хвоста крысы заполняли препаратом «Коллапан». В послеоперационном периоде осуществляли клиническое наблюдение за животными, рентгенографическое, морфологическое исследование препаратов на сроках один, три и шесть месяцев. Результаты. При использовании «Коллапана» для заполнения дефекта костной ткани к шестому месяцу формируется костный блок. Выводы. Разработана экспериментальная модель хронического остеомиелита позвоночника у крыс, которая позволяет исследовать процессы репаративного остеогенеза и влияние на него материла «Коллапан». Хирургическая санация остеомиелитического процесса в позвоночнике с использованием материала «Коллапан» способствует формированию костного блока и полному регрессу воспалительных явлений с отсутствием рецидива и выздоровлением животного
Позвоночник, остеомиелит, остеогенез, биоматериал, "коллапан"
Короткий адрес: https://sciup.org/142121549
IDR: 142121549
Текст научной статьи Использование препарата «Коллапан» при остеомиелите позвоночника в эксперименте
Остеомиелит позвоночника представляет собой актуальную медицинскую и социальную проблему. Изучение вопросов этиопатогенеза, диагностики и лечения остеомиелита позвоночника ставит перед исследователями ряд задач, которые трудно разрешить в условиях клиники. Важным этапом на пути их разрешения является экспериментальное исследование, предполагающее использование биологической модели, которая позволит вести наблюдения за динамикой патологического процесса, а также за результатами антибактериального и хирургического лечения. Предлагаемые на сегодняшний день экспериментальные модели остеомиелита обладают рядом недостатков: высокой летальностью животных, сложностью технического выполнения, гнойными осложнениями вследствие генерализации инфекции, высокой стоимостью эксперимента [9, 11].
В настоящее время продолжается разработка новых методов лечения остеомиелита позвоночника с применением современных достижений биологии и медицины, поэтому для обоснования и внедрения в клиническую практику новых эффективных способов лечения необходима экономически выгодная, легко воспроизводимая экспериментальная модель хронического остеомиелита [11].
Проблема замещения костных дефектов, образующихся после радикального хирургического лечения хронического остеомиелита, остается до сих пор актуальной и дискутабельной. Аутотрансплантат из крыла подвздошной кости считается «золотым стандартом», так как обладает остеогенными, остеоиндуктивными и остеокондуктивными свойствами [10]. С биологической и клинической точек зрения этот материал долгое время считался идеальным для костной пластики [12]. Однако применение аутотрансплантата выявило ряд серьезных осложнений: болевой синдром в области донорского участка, косметический дефект, гематому, ин- фекцию, переломы подвздошной кости, повреждение сосудов и нервов [1].
В качестве заменителя аутотрансплантатов используются аллоимплантаты, однако их применение связано с риском передачи инфекции, развитием реакции гистонесовместимости [10].
Указанные недостатки по применению ауто- и аллотрансплантатов не могут удовлетворять хирургов-ортопедов и вынуждают искать альтернативное решение в применении других заменителей костной ткани. Поиск путей влияния на репаративный остеогенез рассматривается как одна из актуальных проблем биологии и медицины [8].
В последние годы широкое распространение получил материал «Коллапан», созданный Российской фирмой ООО «Интермедапатит». «Коллапан» состоит из высокоочищенного гидроксиапатита и коллагена. Он обладает биосовместимостью и резорбируемыми матрицами, на поверхности которых формируется новообразованная кость [8, 11].
Экспериментальные и клинические исследования с использованием «Коллапана» были проведены при замещении асептических и инфицированных костных дефектов [3], которые показали, что «Коллапан» создает антибактериальный фон, является матрицей для новообразованной костной ткани и активизирует процесс остеогенеза. О широком применении «Коллапана» при хирургическом лечении вертебральной патологии отмечено в работах московских вертебрологов [3, 5].
«Коллапан» применялся пункционно в виде геля, интраоперационно в виде гранул, пластин, в сочетании со стабилизацией углеродным имплантатом. По клиническим и рентгенологическим наблюдениям видно, что применение «Коллапана» снижает сроки формирования костного блока. Между тем, в отдельных работах говорится, что фиброзный блок формируется и при отсутствии стабилизации [6].
В вертебральной патологии «Коллапан» был применен при полисегментарном остеохондрозе и оссификации задней продольной связки, опухоли тел позвонков, нестабильных повреждениях. После резекции тел позвонков, стабилизации позвоночника, осуществляемой костным трансплантатом, оставшиеся костные дефекты заполнялись гранулами «Коллапана». Во всех случаях достигнут костный блок. Процесс остеогенеза и замещения «Коллапана» костной тканью проходит без стадии
«хрящевой мозоли» [4].
Описан опыт применения «Коллапана» при хирургическом лечении патологических переломов, опухолей, остеомиелита шейного отдела позвоночника. Проводилось удаление пораженного диска с резекцией смежных позвонков и последующей стабилизацией позвоночника углеродным имплантатом в сочетании с «Коллапаном». Рецидивов спондилита не отмечалось, костно-углеродный блок наступал во всех наблюдениях [4].
Для профилактики рецидива спондилита с возможными осложнениями и генерализацией инфекции у 49 больных в стадии стихания гнойного воспаления был использован «Коллапан» в виде гранул или геля. После санации очага был осуществлен спондилодез углеродным имплантатом с пломбировкой остаточной полости гранулами «Коллапана». Костный блок был получен у 43 (88 %) больных [4].
Применение «Коллапана» у 48 пациентов с гематогенным остеомиелитом позвоночника с использованием миниинвазивной методики секве-стрэктомии позволило добиться формирования костно-фиброзного спондилодеза на уровне пораженного сегмента [2].
По этим соображениям знание процессов репаративного остеогенеза с применением «Коллапана» в эксперименте при остеомиелите позвоночника является актуальным. Основанием для проведения настоящего исследования стало отсутствие экспериментального обоснования имплантации биокомпозиционного материала «Коллапан» в послеоперационные дефекты для формирования экспериментального межпозвонкового спондилодеза при остеомиелите позвоночника. При этом в литературе имеются данные о применении материала «Коллапан» [12] при переломах позвоночника в эксперименте, тогда как экспериментальные работы, посвященные анализу применения его при спондилите, нами не встречались.
Целью исследования являлось изучить регенерацию костной ткани при хроническом остеомиелите позвоночника с применением препарата «Коллапан» в эксперименте. Для достижения поставленной цели была разработана модель хронического остеомиелита позвоночника у лабораторных животных (крыс), позволяющая создать передний спондилодез и в динамике оценивать влияние различных факторов на процессы репаративного остеогенеза.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проведены на 20 крысах сам-цах в возрасте пяти-шести месяцев, массой 210±30 г. Уход и содержание экспериментальных животных были стандартными в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. № 755).
Подготовка животных к операции начиналась с помещения их в изолятор, где они в течение 14 дней проходили карантин. При отборе животных к операции учитывали поведение экспериментальных животных, наличие аномалий, признаков ранее перенесенной травмы и общее состояние к началу эксперимента. Крысы содержались в отдельных клетках вивария (2 крысы в каждой клетке) и находились на стандартном рационе питания, после операции к рациону питания добавлялись молоко, рыба, витамины.
Предоперационная подготовка животных для эксперимента сводилась к процессу осмотра, взве- шивания. В день операции крыс не кормили и не поили. Анестезию крысам проводили путем внутрибрюшинного введения 0,3-0,4 мл нембутала за пять минут до операции. Непосредственно перед хирургическим вмешательством животное фиксировалось на экспериментальном операционном столике в положении на спине, операционное поле хвостового отдела позвоночника крысы тщательно выбривалось. Хвостовой отдел позвоночника жестко фиксировался на операционном столике. Опера-цион-ное поле дважды обрабатывалось 70 % раствором спирта, изолировалось салфетками, которые фиксировались к хвосту швами проксимальнее и дистальнее уровня оперативного вмешательства. Затем вновь проводилась обработка операционного поля 70 % этиловым спиртом. Адекватность анестезии осуществлялась посредством подсчета ЧСС и оценки микроциркуляции на основании цвета, влажности и температуры языка животного.
Доступ к 3-4 позвонкам хвостового отдела позвоночника экспериментального животного осуществлялся с вентральной поверхности. Рассекали скальпелем кожу в проекции 3-4 позвонков и межпозвонкового диска хвостового отдела позвоночника, обнажали тела позвонков и меж-позвонковый диск. Гемостаз осуществлялся 3 % раствором перекиси водорода. Электрическим бором (диаметр 0,2 см) производили продольный распил ¼ проксимального и ¼ дистального отделов тел позвонков, межпозвонкового диска. В сформированный паз вводили суточную чистую культуру Staphylococcus aureus на агаровой подушке. Рану послойно ушивали и наносили клей БФ 6. После окончания операции проводили контрольную рентгенографию. В послеоперационном периоде осуществляли клиническое наблюдение за животными (оценка общего состояния, локальный статус, клинический анализ крови) и рентгенографию оперированного участка в динамике на сроках один, два и три месяца, а также микробиологическое исследование раневого отделяемого. Отдельно на трех крысах проводилось морфологическое исследование через три месяца после заражения для верификации остеомиелитического процесса.
Через три месяца после верификации остеомиелита проводили хирургическую санацию остеомиелитического очага из вентрального доступа с иссечением свищевого хода, удалением некротических тканей и замещение дефекта костной ткани препаратом «Коллапан». При легком вытяжении хвостового отдела позвоночника трансплантат (4 грамма) плотно укладывался в остеомиелитическую по- лость. Проводилась контрольная рентгенография. В послеоперационном периоде осуществляли клиническое наблюдение за животными, рентгенографическое исследование в динамике на сроках один, три, шесть месяцев и морфологическое исследование препаратов на сроках один, три, шесть месяцев.
По окончании операции животные переводились в послеоперационную комнату, помещались по две особи в клетку, где они находились 10-14 суток. Послеоперационное наблюдение и выхаживание сводились к тщательному объективному наблюдению, обработке швов и обеспечению дополнительного питания (молоко, рыба, витамины).
Выведение животных из эксперимента осуществлялось по заранее составленному графику в соответствии с «Правилами проведения работ с использованием экспериментальных животных», утвержденными приказом МЗ СССР№775 от 12.08.77. Все эксперименты и выведение животных из опытов осуществляли под общей анестезией. Для крыс использовали внутрибрюшинное введение нембутала в дозе 7-8 мл, как правило, на 3-4-й минуте наступала остановка дыхания, а еще через 5-7 минут - остановка сердечной деятельности.
Рентгенологические изменения в динамике прослеживались на аппарате АРД-2-125. Рентгенограммы выполнялись на сроках: первый, третий, шестой месяцы наблюдения. Фокусное расстояние равнялось 70 см при режиме 44 - 1 V и 22 тА. Время экспозиции составляло 0,04 с. Рентгенограммы маркировались фломастером с указанием номера животного и даты проведения рентгенографии.
На сроках три месяца после заражения (три крысы), первый, третий, шестой месяцы после замещения дефекта препарат оперированного участка выделялся из хвостового отдела позво-ночника с захватом неповрежденных прокси-мальных и дистальных тел позвонков. Препараты фиксировали в 15 % растворе нейтрального формалина в течение двух-трех дней. Затем декальцинировали путем помещения в 10 % раствор трилона-Б в течение 1012 дней. Промывали, обезжиривали и заливали в целлоидин или парафин. Из целлоидиновых или парафинированных блоков готовили продольные и поперечные срезы регенерата. Для решения поставленных задач проводились общие морфологические методики, дающие представление о структуре исследуемых тканей (окраска гематоксилин и эозином, по Ван-Гизону, увеличение × 40, 100, 200, 400). Процесс репаративного остеогенеза в области замещения дефекта изучали под световым микроскопом МБС-2, МБИ-6.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Общее состояние инфицированных живот-ных не отличалось от исходного на протяжении всего срока исследования. К 3 месяцу течения остеомиелитического процесса у животных отмечалось наличие свища, при бактериологическом исследовании отделяемого идентифицировался исходный штамм Staphylococcus aureus, в клиническом анализе крови выявлены признаки воспаления (лейкоцитоз), рентгенографически определялась выраженная деструкция позвонков, костные секвестры, имелись признаки склероза и кифотическая деформация (рис. 1, 2).
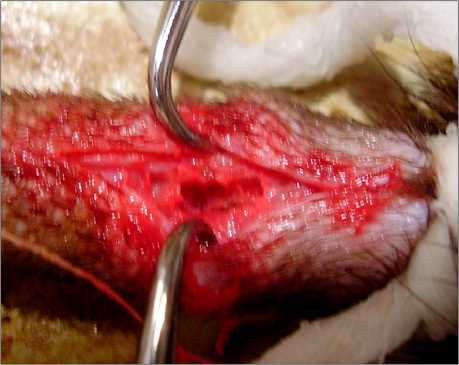
Рис. 1. Остеомиелитическая полость через 3 месяца после заражения
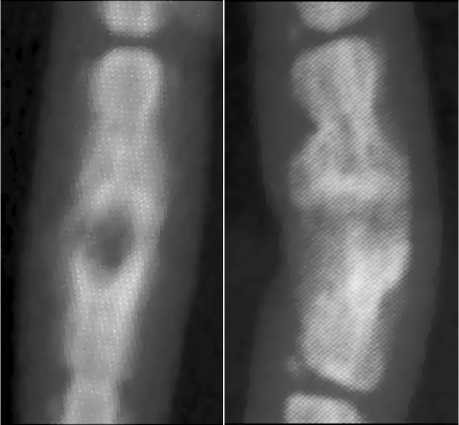
Рис. 2. Рентгенограммы хвоста крысы через 3 месяца после заражения в прямой и боковой проекциях
Через две недели после санации и замещения дефекта отмечался регресс воспалительных явлений, рана заживала первичным натяжением с закрытием свищевого хода. В течение шести месяцев наблюдения рецидива инфекции не было.
После замещения дефекта на рентгенограммах сразу после операции прослеживался дефект в зоне оперативного вмешательства, контуры остеомиелитической полости с уложенным материалом.
Через месяц рентгенологически определяют-ся контуры уложенного препарата, структура которого становится разреженной. По краям материала возникают резорбционные процессы, появляются участки просветления. Контуры ложа и краев материала становятся нечеткими, смазанными (рис. 3).
При морфологическом исследовании через месяц фрагменты «Коллапана» окружены широким слоем фиброзной соединительной ткани с выраженной макрофагальной реакцией. Процесс остеогенеза со стороны материнского ложа незначительный (рис. 4).
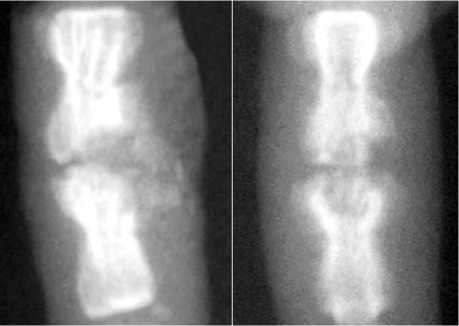
Рис. 3. Рентгенограммы хвоста крысы через месяц после замещения дефекта препаратом «Коллапан» в прямой и боковой проекциях
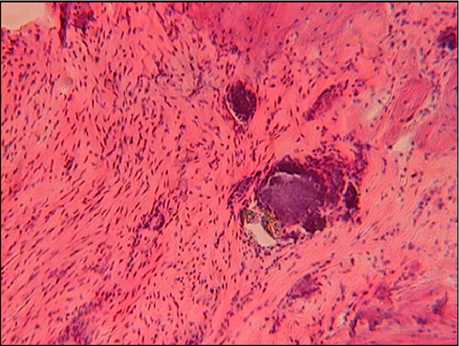
Рис. 4. Морфологический препарат хвоста крысы через месяц после замещения дефекта препаратом «Коллапан», окраска гематоксилин и эозин, увеличение ×100
Через три месяца рентгенологически продолжается дальнейшая перестройка регенерата на уровне диска и периферических отделов тел позвонков, контуры его становятся все более нечеткими. Нарастают признаки субхондрального склероза замыкательных пластинок тел позвонков. Участки просветления становятся более плотными.
При морфологическом исследовании через три месяца на гистологических препаратах наблюдался дефект тела позвонка, заполненный гранулами биокомпозиционного материала. Большую часть дефекта выполняет грубоволокнистая соединительная ткань. Гранулы «Коллапана» окружены рыхлой соединительной тканью, по-прежнему наблюдается макрофагальная реакция.
Через шесть месяцев рентгенологически в области оперативного вмешательства прослеживается увеличение явлений спондилеза и образование костного блока (рис. 5).
При морфологическом исследовании через 6 месяцев наблюдается дефект тела позвонка, заполненный гранулами биокомпозиционного материала, окруженного грубоволокнистой соединительной тканью. В зонах материнского ложа наблюдается остеогенная реакция в виде формирования примитивных костных структур (рис. 6).
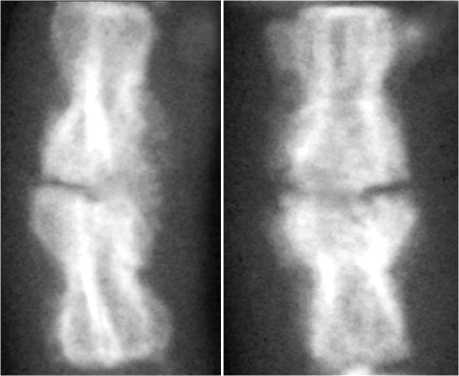
Рис. 5. Рентгенограммы хвоста крысы через шесть месяцев после замещения дефекта препаратом «Коллапан» в прямой и боковой проекциях
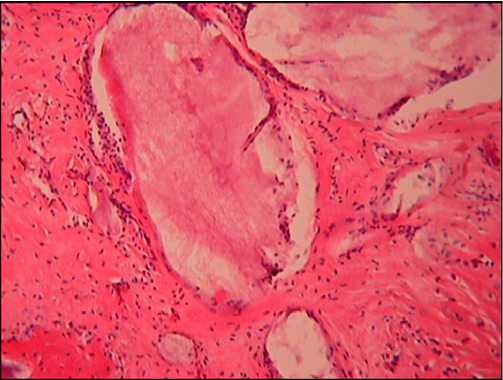
Рис. 6. Морфологический препарат хвоста крысы через шесть месяцев после замещения дефекта препаратом «Кол-лапан», окраска гематоксилин-эозин, увеличение ×400
ВЫВОДЫ
-
1. Разработана экспериментальная модель остеомиелита позвоночника у крыс, которая позволяет исследовать процессы репаративного остеогенеза и влияние на него препарата «Коллапан».
-
2. При формировании дефекта тел позвонков и межпозвонкового диска с заполнением дефекта биокомпозиционным материалом «Коллапан» рентгенологически на срок три месяца прослеживается процесс очагового остеогенеза. К шести месяцам появляется усиление боковых разрастаний, формируется костный блок.
-
3. При морфологическом исследовании через три месяца гранулы «Коллапана» окружаются со-
- единительнотканными структурами с выра-женной макрофагальной реакцией. Процесс остеогенеза выражен слабо. Через шесть месяцев композиционный материал окружен соединительнотканной капсулой с остеогенной реакцией со стороны материнского ложа. Прослеживается формирование костного блока.
-
4. Хирургическая санация остеомиелитического процесса в позвоночнике с использованием материала «Коллапан» способствует формированию костного блока и полному регрессу воспалительных явлений с отсутствием рецидива и выздоровлению животного в течение шести месяцев после операции.


