Использование прямого ингибитора Ренина - Алискирена при оперативном лечении нефролитиаза
Автор: Россоловский А.Н., Попков В.М., Понукалин А.Н., Чехонацкая М.Л., Захарова Н.Б., Березинец О.Л., Иноземцева Н.Д.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 1 т.9, 2013 года.
Бесплатный доступ
Цель: изучение влияния антифибротического нефропротективного эффекта алискирена на состояние гемодинамики и динамику уровней профибротических цитокинов и медиаторов почечного повреждения у больных нефролитиазом, подвергшихся различным видам оперативного лечения. Материал и методы. Обследовались 2 группы пациентов: с применением и без применения нефропротекции. Все исследования выполнялись на дооперационном этапе и через 1 месяц после хирургического лечения. Определяли концентрацию TGF-p, маркеров острого почечного повреждения (NGAL и р2-микроглобулин) в моче, а также индикатора эндотелиаль-ной дисфункции ЭТ-1 в сыворотке крови. С помощью дуплексного сканирования оценивали также состояние почечного кровотока. Результаты. В результате применения алискирена отмечалось снижение уровней профибротических медиаторов тубулоинтерстициального повреждения и нефрофиброза, достоверно улучшались параметры почечного кровотока через 1 месяц после лечения по сравнению с группой, не получавшей нефро-протективной терапии. Заключение. Прямой ингибитор ренина алискирен может быть использован в качестве средства нефропротективной терапии в комплексном лечении больных нефролитиазом.
Внутрипочечная гемодинамика, нефролитиаз, профибротические цитокины, прямой ингибитор ренина алискирен
Короткий адрес: https://sciup.org/14917672
IDR: 14917672
Текст научной статьи Использование прямого ингибитора Ренина - Алискирена при оперативном лечении нефролитиаза
Адрес: 410017, г. Саратов, 1-й Телевизионный проезд, 3, кв. 42.
Тел.: (8452) 44-72-19
Несмотря на динамичное развитие малоинвазивной хирургии в лечении нефролитиаза, применение данных технологий не исключает травматического воздействия на почечную паренхиму, проявляющегося преходящими расстройствами микроциркуляции с развитием тубулоинтерстициального повреждения и прогрессирующего нефрофиброза [7–10]. Современная волна интереса к тубулоинтерстициальным поражениям связана как с ролью ятрогении в целом, так и с предположением ведущей роли интерстиция и канальцев в прогрессировании заболевания почек и открывающимися в связи с этим возможностями лечения и профилактики. Понимание большинства механизмов патогенеза прогрессирования хронических заболеваний почек послужило отправной точкой для разработки принципов современной нефропро-тективной стратегии.
Для достижения регресса фиброзных изменений и обратимости почечной дисфункции необходимо четко определять мишени для терапии [11]. Многолетние исследования патогенеза повреждения почек привели к выводу о многофакторности этого процесса [12]. В то же время эффекты нефропротективных методов лечения реализуются через воздействие на общие для всех нефропатий компоненты патогенеза.
Основу современной нефропротективной стратегии составляют ингибиторы АПФ (и-АПФ) и блокаторы АТ-І-рецепторов, защитный эффект которых обусловлен снижением внутриклубочкового давления, протеинурии и внутрипочечной продукции ангиотензина-ІІ, оказывающих фиброгенный эффект [13]. Большое число экспериментальных и клинических исследований показало, что АТ-ІІ играет ключевую роль в прогрессирующем снижении функции почек посредством гемодинамических и негемодинамических механизмов. Несомненно, препараты, фармакологически блокирующие РАС (ингибиторы АПФ и блокаторы АТ-І-рецепторов), причисляются к важнейшим инновациям в лечении хронических заболеваний почек и особенно в предотвращении их прогрессирования.
Известно, что прерывание РАС также может быть достигнуто путем блокирования активности ренина, лимитирующего биосинтез АТ-ІІ. Начиная с 1982 г. предпринимались многочисленные попытки производства соединения для ингибирования ренина, самым успешным из которых стал алискирен, одобренный в 2007 г. для лечения артериальной гипертензии [14]. D. Feldman и соавт. (2010) показали, что алискирен снижал содержание маркера канальцевого повреждения NGAL и предотвращал развитие нефрофиброза [15]. В сравнительном исследовании алискирена и и-АПФ периндоприла на модели крыс продемонстрировано, что алискирен не уступал последнему в уменьшении альбуминурии и превосходил его в отношении замедления развития тубулоинтерстициального фиброза [16]. Кроме того, имеется сообщение о значительном уменьшении степени выраженности тубулярной атрофии при использовании алискирена [17]. В экспериментальном исследовании на крысах прямое ингибирование ренина значительно снижало почечный фиброз и апоптоз после хронической почечной ишемии. Иммунофлу-оресцентное окрашивание также показало, что использование алискирена уменьшило отложение интерстициального коллагена І [18]. В работе B. Pilzetal (2005) применение алискирена ассоциировалось с улучшением эндотелиальной функции [19]. Исследование D. L. Feldmanetal (2008) установило подавление алискиреном экспрессии TGF-β1 в ткани почек, играющего центральную роль в развитии нефрофи-броза [15].
Таким образом, фармакологическое подавление воспаления и фиброза возможно на ранних стадиях развития почечного повреждения. Травматизация почечной паренхимы при хирургических вмешательствах, инициирующая каскад молекулярных взаимодействий с последующими морфологическими изменениями, побуждает многих исследователей продолжать поиски защитных агентов, предотвращающих или хотя бы ограничивающих масштабы структурно-функциональных повреждений в почке. Неоспорима важность максимально раннего начала лечения до необратимого ухудшения почечных функ- ций. При этом велика потребность изучения легко выделяемых маркеров (в моче или плазме), прогнозирующих развитие почечной дисфункции на ранних стадиях.
Цель исследования : и зучение нефропротек-тивных эффектов применения прямого ингибитора ренина — алискирена при оперативном лечении больных нефролитиазом на основе разработанных неинвазивных диагностических критериев.
Материал и методы. Обследовано 80 пациентов с МКБ, оперированных в клинике уронефрологиикли-нической больницы им. С. Р. Миротворцева СГМУ в период 2009–2011 гг. Все пациенты были разделены на 2 группы: 1-ю группу составили 40 больных МКБ, получавших, помимо хирургического и стандартного консервативного лечения, нефропротективную терапию алискиреномв дозе 150 мг в сутки в течение 1 месяца, вторую (контрольную) — 40 пациентов с МКБ, которым выполнялось оперативное пособие со стандартной медикаментозной терапией. Больные группы контроля были сопоставимы по полу, возрасту и видам оперативного лечения и не получали другие ингибиторы РАС.
Пациентам обеих групп выполнялись как малоинвазивные вмешательства (2 и более сеансов ДЛТ за один период пребывания в стационаре, ПНЛТ, комбинированное лечение ПНЛТ+ДЛТ («сандвич»-терапия), а также открытые операции. Распределение пациентов в группе в зависимости от вида оперативного лечения представлено на диаграмме (рис. 1).
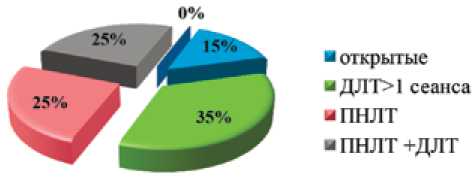
Рис. 1. Виды оперативных вмешательств у больных МКБ, получавших алискирен в периоперационном периоде
Из представленного графика следует, что большинству пациентов выполнялись малоинвазивные вмешательства: несколько сеансов ДЛТ (28 больных), ПНЛТ (20 больных) и сандвич-терапия (20 больных). Открытые операции выполнялись у 12 пациентов.
Для оценки степени почечного повреждения у больных МКБ в обеих группах выполнялось дуплексное сканирование почечного кровотока с определением индекса резистентности (Ri) на уровне дуговых внутрипочечных артерий. Методом ИФА на анализаторе «StatFax-2100» (США) в динамике исследовалась концентрация экскретирующихся с мочой про-фибротического цитокина ТGF-β; маркеров острого повреждения тубулоинтерстициальной ткани почек NGAL и β2-микроглобулина, а также уровень сывороточного ЭТ-1, являющегося показателем эндотелиальной дисфункции (таблица).
Лабораторная оценка влияния различных методов оперативного лечения и эффектов прямого ингибитора ренина на функцию почек проводилась на основании мониторинга креатинина сыворотки крови (сКр) и определения скорости клубочковой фильтрации (СКФ) с использованием уравнения, полученного в исследовании MDRD, а также расчетной формулы
Референсные значения используемых медиаторов почечного повреждения и нефрофиброза
|
Группы медиаторов |
Норма |
Исследуемая среда |
Биологическое значение |
|
β2-МГ, мкг/мл |
0–0,03 |
Моча |
Индикатор тубулярной дисфункции |
|
ЭТ-1, фмоль/мл |
0,2–0,34 |
Сыв. |
Физиологический антагонист NO, мощнейший эндогенный вазоконстриктор, обладающий провоспалительным, митогенным и профибро-тическим эффектами |
|
NGAL, нг/мл |
0,2–5 (Huyn-hetal.,2009) |
Моча |
Ренальный «тропонин», один из наиболее быстро реагирующих маркеров ранней фазы ишемическогого повреждения почек (в течение 2 ч); играет определяющую роль в обеспечении выживания поврежденных ренальных клеток и их дальнейшей пролиферации |
|
TGF-β, нг/мл |
4,85 |
Моча |
Регулятор клеточной пролиферации, дифференцировки, апоптоза, иммунного ответа, ремоделирования экстрацеллюлярного матрикса; играет важную роль в процессе заживления ран и физиологическом восстановлении структуры тканей при повреждении; вызывает изменения почечной паренхимы на поздней стадии развития нефрофи-броза |
Сockroft-Gault (CG). Регистрацию изучаемых параметров производили как на дооперационном этапе, так и в динамике через 1–3 месяца после оперативного вмешательства.
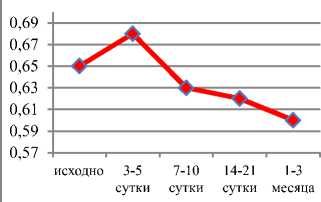
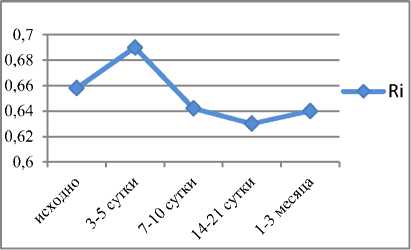
Результаты. При оценке изменений внутрипочечного кровотока отмечалось постепенное снижение индекса резистентности у пациентов 2-й группы, в то время как у больных 1-й группы на 14–20-е сутки после операции вновь происходил незначительный подъем данного показателя (рис. 2).
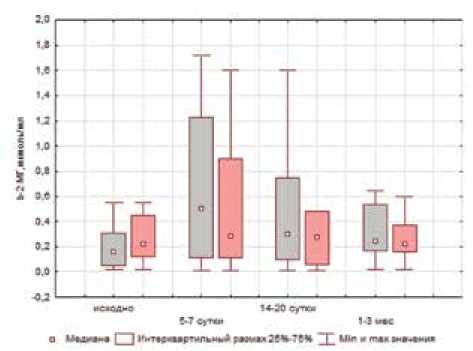
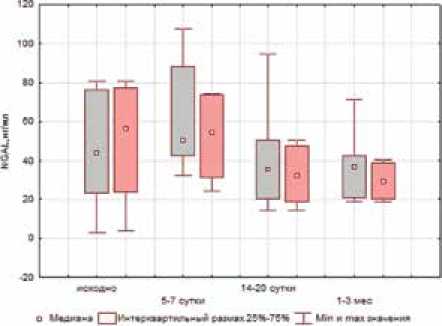
Для оценки влияния ингибиции ренина на прогрессирование канальцевого повреждения был использован общепризнанный маркер тубулярного повреждения b2-микроглобулин (рис. 3).
Из графика (см. рис. 3а)) следует, что использование алискирена уменьшает выраженность атрофии канальцев на всех этапах хирургического лечения (р≤0,05). Активация маркеров острого повреждения паренхимы почек, одним из которых является липо-
а)
б)
Рис. 2. Оценка изменений внутрипочечного кровотока (Ri) в периоперационном периоде на уровне дуговых артерий: а) ‒ у больных 1-й группы; б) ‒ у больных 2-й группы калин-2 (NGAL), также менее выражена у больных 1-й группы (см. рис. 3б)).
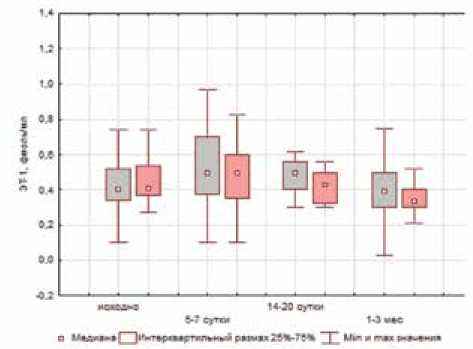
Как уже указывалось, одним из эффектов алиски-рена является его влияние на функцию эндотелия и подавление вазоконстрикции за счет прямого ингибирования ренина и ангиотензина-ІІ, в связи с чем проводилась сравнительная оценка содержания ЭТ-1 в группах на фоне нефропротективного лечения.
Так, на 5–7-е сутки после лечения отмечалась активация вазоконстрикции, сопровождающаяся повышением уровня ЭТ-1 в обеих группах. В то же время в последующий период у пациентов 1-й группы отмечается достоверное снижение данного показателя по сравнению с пациентами 2-й группы (см. рис. 3в)).
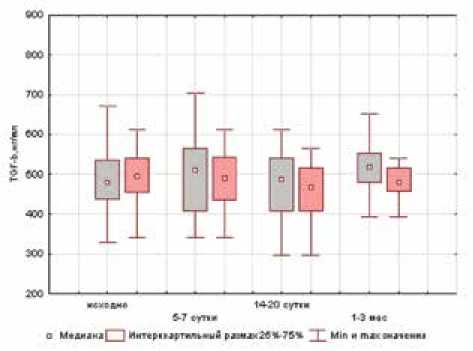
Ключевым маркером нефрофиброза является TGF-b. Более низкий уровень его экскреции с мочой у больных 1-й группы через 1–3 месяца после вмешательства свидетельствует о достаточно высокой эффективности алискирена в предотвращении развития нефрофиброза (см. рис. 3г)).
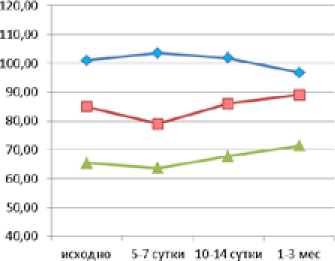
Любое хирургическое вмешательство так или иначе влияет на функциональное состояние почек. Сохранение или улучшение функциональной способности почек у большинства пациентов обеих групп после выполнения оперативных пособий свидетельствует об эффективности проводимого лечения (рис. 4).
Снижение функции почек через 1–3 месяца после лечения отмечается лишь у 4% пациентов 1-й группы. В то же время у больных 2-й группы подобная тенденция наблюдается у 12% больных.
Таким образом, восстановление функции почки у больных МКБ на фоне лечения алискиреном происходит быстрее, о чем свидетельствует достоверное снижение маркеров повреждения почечной паренхимы и нефрофиброза через 1–3 месяца после оперативного лечения. Кроме того, все пациенты, принимавшие алискирен, отмечали нормализацию показателей АД и хороший контроль в течение суток, отсутствие побочных эффектов.
Обсуждение. Несмотря на многофакторность возникающего при МКБ почечного повреждения, большинство существующих ренопротективных препаратов оказывают свое воздействие на общие для всех нефропатий компоненты патогенеза. При этом в основе современной нефропротективной стратегии лежит блокирующее воздействие на ренин-ангиотен-зинную систему [20], использование которого в виде прямой ингибиции ренина было предпринято в настоящем исследовании.
а)
б)
в)
г)
Рис. 3. Изменение активности TGF-β, MCP-1, β2-МГ и NGAL в моче больных МКБ через 1–3 месяца после хирургического лечения в группах больных
—♦—«ре-иинип
-е-сс
-*-MDRD
а)
Рис. 4. Функциональное состояние почек у больных МКБ 1-й (а) и 2-й (б) исследуемых групп в периоперационном периоде
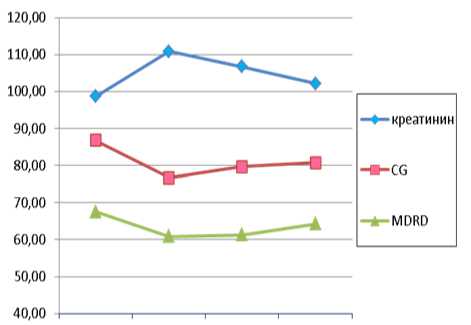
исходно 5-7 сутки 10-14 сутки 1-3 мес
б)
В качестве маркеров, характеризующих разноплановые влияния прямого ингибитора ренина на почечную паренхиму у больных нефролитиазом, выбраны медиаторы, действие на которые РАС считается доказанным. Так, по данным T. Matsusaka с соавт. (2000), АТ-ІІ оказывает профиброгенный эффект, вы- зывая высвобождение хемокинов, цитокинов и факторов роста, среди которых наиболее важное значение имеет TGF-β [21]. В проведенном исследовании более низкий уровень экскреции с мочой TGF-b через 1–3 месяца после вмешательства у больных, получающих прямой ингибитор ренина алискирен, свидетельствует о достаточно высокой эффективности данного препарата в предотвращении развития нефрофиброза. Применение подобной нефропро-текции алискиреном привело к ускоренному восстановлению функции почки у больных МКБ вне зависимости от вида оперативного лечения, что позволяет рекомендовать применение прямого ингибитора ренина (алискирена) в дозе 150–300 мг не менее чем в течение 1 месяца периоперационного периода в комплексном лечении пациентов, страдающих нефролитиазом. Данное заключение согласуется с концепцией ингибирования РАС, применяющейся практически у всех пациентов с прогрессирующей ХБП с целью замедления процессов развития терминальной почечной недостаточности [22].
Возможность использования современных биомаркеров в качестве мониторинга повреждения почечной паренхимы в периоперационном периоде как для оценки эффективности оперативного лечения, так и для определения возможностей нефропротек-ции подтверждают данные J. C. Dussaule с соавт. (2008), утверждающего, что для достижения регресса фиброзных изменений и обратимости почечной дисфункции необходимо четко определять мишени для терапии [10].
Выводы:
Список литературы Использование прямого ингибитора Ренина - Алискирена при оперативном лечении нефролитиаза
- Применение клеточных технологий для лечения хронической почечной недостаточности (экспериментальная работа)/Н.А. Лопаткин [и др.]//Урология. 2007. № 3. С. 3-6
- Rule A.D., Krambeck А.Е., Lieske J.C. Chronic kidney disease in kidney stone formers//Clin. J. Am. SocNephrol. 2011. Vol. 8, № 6. P. 2069-2075
- Risk factors for CKD in persons with kidney stones: a case-control study in Olmsted County, Minnesota/N.A. Saucier [etal.]//Am.J. Kidney Dis. 2010. №55(1). P. 61-68
- Бикбов Б.Т., Томилина Н.А. Состояние заместительной терапии больных с хронической почечной недостаточностью в Российской Федерации в 1998-2007 гг.: аналит отчет по данным Рос. регистра заместительной почечной терапии//Нефрология и диализ. 2009. Т. 11, № 3. С. 5-57
- Есилевский Ю.М. Реография органов мочеполовой системы. М.: МЕДпресс-информ, 2004. С. 673
- Arakawa Т. Surgical management for urolithiasis//Clin. Calcium. 2011. Vol. 10, №21. P. 1535-1541
- Дзеранов H.K. Единая согласованная терминология и преемственность -путь объективизации качества и результатов лечения мочекаменной болезни: на примере дистанционной ударно-волновой литотрипсии//Саратовский научно-медицинский журнал. 2011. Т. 7, № 2, прил. С. 36-40
- Казаченко А. В. Протекторная и регенерационная терапия при остром и хроническом повреждении почки: автореф. дис. д-ра мед. наук. М., 2009. С. 42
- Buchholz N.N., Hitchings A., Albanis S. The (soon forgotten) art of open stone surgery: to train or not to train?//Ann.R. Coll. Surg. Engl. 2006. Vol. 88, suppl. 2. P. 214-217
- Dussaule J.C, Chatziantoniou С Reversal of renal fibrosis: lessons from experimental models//Bull. Acad. Natl. Med. 2008. Vol. 192, suppl. 5. P. 987-1000
- Protective role of alpha-tocopherol and caffeic acid phenethyl ester on ischemiareperfusion injury via nitric oxide and myeloperoxidase in rat kidneys/A. Gure [et al.]//Clin. Chim. Acta. 2004. Vol. 339, № 1/2. P. 33-41
- Индуцируемые протеинурией механизмы ремо-делирования тубулоинтерстиция и возможности нефропро-текции при гломерулонефрите/Н.А. Мухин [и др.]//Вестник РАМН. 2005. №1.С. 3-8
- Carey Robert М. Antihypertensive and Renoprotective Mechanisms of Renin Inhibition in Diabetic Rats//Hypertension. 2008. Vol. 52. P. 63-64
- Jensen C, Herold P., Brunner H.R. Aliskiren: the first renin inhibitor for clinical treatment//Nat. Rev. Drug. Discov. 2008. Vol. 7, suppl. 5. P. 399-410
- Feldman D.L. New insights into the renoprotective actions of the renin inhibitor aliskiren in experimental renal disease//Hypertens. Res. 2010. Vol. 33. P. 279-287
- Aliskiren, a novel renin inhibitor, is renoprotective in a model of advanced diabetic nephropathy in rats/D. J. Kelly [et al.]//Diabetologia. 2007. Vol. 50, № 11. P. 2398-2404
- Rusai K, Schmaderer C, Hermans J.J. Direct renin inhibition in a rat model of chronic allograft injury//Transplantation. 2011. Nov 15. № 92 (9). P. 999-1004
- Sun C.Y., Cherng W.J., Jian H.Z. Aliskiren reduced renal fibrosis in mice with chronic ischemic kidney injury-beyond the direct renin inhibition//Hypertens. Res. 2012 Mar. Vol. 35 (3). P. 304-311
- Pilz В., Shagdarsuren E., WellnerM. Aliskiren, a human renin inhibitor, ameliorates cardiac and renal damage in double-transgenic rats//Hypertension. 2005. Vol. 46. P. 569-576
- Мухин Н.А. Современная нефропротективная стратегия лечения хронических прогрессирующих заболеваний почек//Клиническая фармакология и терапия. 2002. Т. 11, №2. С. 58-62
- Angiotensin II as a player in fibrosis/Т. Matsusaka [et al.]//Nephrol. Dial. Transplant. 2000. Vol. 15, № 6. P. 64-65
- CovicA., Gusbeth-Tatomir P., Goldsmith D.J. Current dilemmas in inhibiting the renin-angiotensin system: do not forget real life//Int. Urol. Nephrol. 2007. Vol. 39, suppl. 2. P. 571-576.


