Использование различных дериватизирующих агентов при определении гомоцистеина методом высокоэффективной жидкостной хроматографии
Автор: Рябуха А.Ф., Смирнова Л.А., Кузнецов К.А., Сучков Е.А., Перфилова В.Н.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 3 (39), 2013 года.
Бесплатный доступ
Проведен сравнительный анализ методик определения гомоцистеина в плазме крови. Воспроизведены две методики определения - количественное определение методом ВЭЖХ после дериватизации с SBD-F и ортофталевым альдегидом.
Гомоцистеин, вэжх, дериватизация
Короткий адрес: https://sciup.org/142149048
IDR: 142149048 | УДК: 615:547.466
Текст научной статьи Использование различных дериватизирующих агентов при определении гомоцистеина методом высокоэффективной жидкостной хроматографии
Гомоцистеин – серосодержащая аминокислота, которая может катаболизироваться в цистеин или реметилироваться в метионин. Избыток гомоцистеина (гипергомоцистеинемия) повышает риск раннего развития атеросклероза и тромбоза артерий и является прогностическим маркером летального исхода. В плазме крови гомоцистеин (ГЦ) присутствует в трех молекулярных формах: свободный ГЦ, дисульфид ГЦ (гомоцистин) и дисульфид ГЦ с цистеином. Большая часть (около 70 %) ГЦ связана с белками. Свободный и связанный с белком ГЦ составляют общий ГЦ [1].
Перед определением ГЦ и цистеина в плаз-ме/сыворотке крови их необходимо высвободить из дисульфидов и связи с белками. В качестве восстанавливающих веществ из различных дисульфидных связей используют соединения дитиоэритритол, дитиотрейтол, меркаптоэтанол, а также борогидриды натрия или калия.
Для высокоэффективной жидкостной хроматографии (ВЭЖХ) анализа тиолов чаще всего их превращают во флуоресцирующие производные путем реакции с биманами или галоген- сульфонилбензофуранами [аммоний-7-фтор-бензо-2-окса-1,3-диазол-4-сульфонат (SBD-F), 4-амино-сульфонил-7-фторбензо-2-окса-1,3-диа-зол (ABD-F)]. Эти методы имеют высокую чувствительность определения, но ряд недостатков – продолжительность реакции варьирует от 10 до 60 мин, а для анализа необходим флуориметрический детектор. Недостатком последних двух методов является также использование в ряде методик токсичного восстанавливающего реагента (три-п-бутил-фосфин) [4].
ГЦ и другие тиолы можно дериватизиро-вать с помощью ортофталевого альдегида/ 2-меркаптоэтанола (OФA-2ME). Реакция не является тиолспецифичной и помимо цистеина и ГЦ позволяет определять другие аминокислоты [2].
ЦЕЛЬ РАБОТЫ
Выбрать наиболее чувствительную, селективную и воспроизводимую методику для определения содержания гомоцистеина в плазме крови крыс.
МЕТОДИКА ИССЛЕДОВАНИЯ
Содержание вещества определяли методом ВЭЖХ на жидкостном хроматографе Shimadzu (Япония) с флуоресцентным детектором RF-10Axl, колонка SUPELCOSIL LC-18 (5 мкм; 150 мм х 4,6 мм). В работе использовали де-риватизирующие агенты: OФA-2MЭ (метод 1) и SBD-F (метод 2).
Метод 1
Подвижная фаза состояла из ацетонитрила (16 %), Na 2 HPO 4 (0,01 М), NaH 2 PO 4 (0,01 М), Na 2 -ЭДТА (0,002 М), рН 7,0. Скорость потока элюента 1 мл/мин, t = 26 ° C. Детектирование проводили при длине волны возбуждения 340 нм, испускания – 450 нм.
Для восстановления дисульфидных связей в плазме крови использовали 2-меркаптоэтанол (2-МЭ). Образующиеся сульфгидрильные группы алкилировали при помощи йодуксусной кислоты (0,8 М).
Ортофталевый/2-МЭ (ОФА/2-МЭ) реагент получали следующим образом: 27 мг ОФА растворяли в 0,5 мл метанола [раствор (1)]. Раствор (1) хранился при -20 ° С. Раствор (2), используемый для получения деривата гомоцистеина, готовили непосредственно перед использованием, смешивая 20 мкл раствора (1) с 40 мкл 2-МЭ и 140 мкл 0,1 М раствора Na 2 B 4 O 7 (рН = 12,5).
Перед реакцией модификации проводили депротеинизацию образцов плазмы метанолом.
Для перевода гомоцистеина в производное к 20 мкл супернатанта добавляли 20 мкл 0,8 М йодуксусной кислоты (для защиты сульфгидрильных групп), 20 мкл реагента (2) и 140 мкл 0,1 М Na 2 B 4 O 7 , перемешивали в течение 5 мин, после чего 10 мкл смеси вводили в хроматографическую систему.
Метод 2
Для дериватизации гомоцистеина этим методом использовали аммоний-7-фторбензо-2-окса-1,3-диазол-4-сульфонат (SBD-F). Подвижная фаза включала ацетонитрил (10 %), 0,1 М КН 2 PO 4 (90 %), рН 2,1. Скорость потока элюента 1 мл/мин, t = 30 ° С. Детектирование проводили при длине волны возбуждения 385 нм, испускания - 515 нм [3].
В качестве восстанавливающего агента мы использовали TCEP [трис-(2-карбоксиэтил)-фосфин], менее токсичный и более стабильный по сравнению с другими восстановителями.
Кровь откручивали, получали плазму. К 90 мкл супернатанта добавляли 10 мкл внутреннего стандарта (монопропионилглицин, в концентрации 10 мкг/мл) затем добавляли 10 мкл 10%-го TCEP, 30 минут инкубировали при температуре 4 ° С, добавляли 100 мкл холодной 10%-й ТХУ с 1 mM ЭДТА, центрифугировали 5 мин при 21000 g. Супернатант (100 мкл) переносили в эппендорф, к нему добавляли 20 мкл 1,55 M NaOH, 250 мкл 0,125 М боратного буфера (pH 9,5) c 4 mM ЭДТА и 50 мкл SBD-F (1 г/л) в 0,125 М боратном буфере, pH 9,5, инкубировали при 60 ° С 60 мин и охлаждали во льду для последующего хроматографического анализа.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Чувствительность методики ОФА/2-МЕ составила 1 мкг/мл, но средняя ошибка измерения была выше 20 % по всем концентрациям (табл. 1, рис. 1).
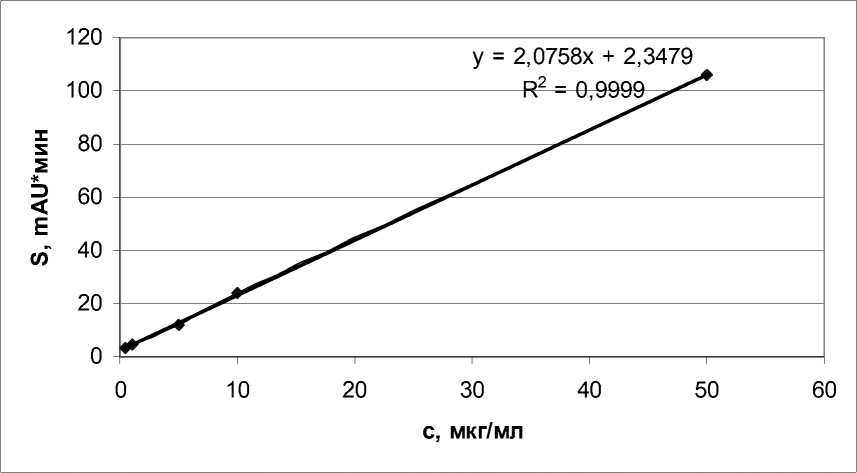
Рис. 1. График зависимости площади пика от концентрации гомоцистеина при дериватизации OФA-2MЭ
Таблица 1
|
С добавл., мкг\мл |
С получ., мкг/мл |
С ср. |
Ст. откл. |
Ошибка, % |
|
0,5 |
0,379902 |
0,402544 |
0,114064 |
28,3359 |
|
0,301498 |
||||
|
0,526231 |
||||
|
1 |
1,042562 |
0,970951 |
0,12318 |
12,68648 |
|
1,041574 |
||||
|
0,828717 |
||||
|
5 |
5,262598 |
4,76279 |
1,652619 |
34,69854 |
|
6,107814 |
||||
|
2,917959 |
||||
|
10 |
14,36897 |
10,41362 |
3,497936 |
33,59 |
|
9,144474 |
||||
|
7,72743 |
||||
|
50 |
67,37311 |
49,94609 |
18,85754 |
37,75579 |
|
29,92634 |
||||
|
52,53883 |
Статистические параметры определения гомоцистеина после дериватизации с OФA-2MЭ
Полученные дериваты были крайне нестабильны и для получения воспроизводимых резуль-тато зиро
Это существенно увеличивает время анализа и ной методики в рутинной клинической практике. Чувствительность методики дериватизации SBD-F ния ен-ток
(рис. 2, табл. 2).
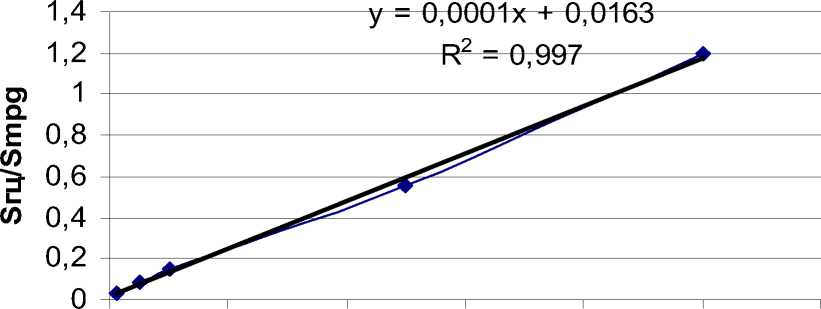
О 2000 4000 6000 8000 10000 12000
С гц, нг/мл
Рис. 2. График зависимости площади пика от концентрации гомоцистеина при дериватизации SBD-F
Таблица 2
|
С добавл. нг/мл |
C получ., нг/мл |
С ср. |
Ст. откл. |
Ошибка, % |
|
100 |
33,5807 |
125,5013 |
79,98326 |
63,731 |
|
179,225 |
||||
|
163,6983 |
||||
|
500 |
617,5297 |
664,2774 |
40,4864 |
6,094803 |
|
687,2823 |
||||
|
688,0203 |
||||
|
1000 |
1191,229 |
1333,91 |
126,6325 |
9,493326 |
|
1377,553 |
||||
|
1432,95 |
||||
|
5000 |
5426,054 |
5348,75 |
209,0908 |
3,909152 |
|
5508,181 |
||||
|
5112,014 |
||||
|
10000 |
11199,24 |
11830,22 |
618,2811 |
5,226287 |
|
12434,97 |
||||
|
11856,44 |
Статистические параметры определения гомоцистеина после дериватизации с SBD-F
ЗАКЛЮЧЕНИЕ
Таким образом, методика дериватизации гомоцистеина с SBD-F имеет высокую воспроизводимость, чувствительность и селективность, что позволяет использовать ее в клинической и лабораторной диагностике.


