Использование различных форм хитозана для экологически оправданных способов комплексной утилизации сыворотки из отходов переработки молока
Автор: Буткевич Татьяна Владимировна, Иванов Андрей Александрович, Курченко Владимир Петрович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
В растворе сывороточных белков хитозан связывает β-лактоглобулин и другие белки, образуя при этом нерастворимый комплекс. Показано, что основной вклад в процесс формирования нерастворимого комплекса хитозан-белки вносят силы электростатического взаимодействия. Применение различных форм хитозана: гранулированной, губчатой и его растворов при переработке молочной сыворотки дает возможность выделить из нее до 90% белка. Полученный белок может быть использован в качестве добавки, повышающей биологическую ценность пищевых продуктов. При этом сам хитозан после регенерации может быть вновь использован в реакции.
Хитозан, молочная сыворотка, β-лактоглобулин, α-лактальбумин, бычий сывороточный альбумин, лактоферрин
Короткий адрес: https://sciup.org/148202047
IDR: 148202047 | УДК: 577.156.07
Текст научной статьи Использование различных форм хитозана для экологически оправданных способов комплексной утилизации сыворотки из отходов переработки молока
В настоящее время Республике Беларусь занимает 5 место в мире по экспорту молочной продукции. Значительный рост производства молока, творога и творожных изделий, а также сыров, поставляемых за рубеж, приводит к получению большого количества молочной сыворотки, являющейся отходом переработки молока. Увеличение количества сыворотки, остающейся в пределах республики, ведет к загрязнению окружающей среды, т.к. ее дальнейшее использование составляет лишь 38%.
Таким образом, проблема утилизации отходов переработки молока неразрывно связана с проблемой охраны окружающей среды. В ряде стран ведётся интенсивный поиск наиболее рациональных и высокоэффективных методов и технологий очистки высококонцентрированных сточных вод предприятий молочной отрасли. Наиболее распространёнными решениями в этой области являются сочетание классических методов очистки (механической, физикохимической, биологической и т.д.) с новыми (обратный осмос, ультрафильтрация, микрофильтрация, электродиализ, усовершенствованные биологические методы и др.). Анализ методов очистки сточных вод молочных предприятий показал, что наиболее перспективными технологиями являются физикохимические, биологические, комбинированные методы [1].
Основную массу отходов переработки молока составляет подсырная сыворотка, которая содержит 0,55% белков, 4,8% лактозы, 0,05% жира и 0,5% минеральных веществ. Представляется целесообразным для комплексной переработки такой сыворотки выделить из нее белки как наиболее ценный продукт, обладающий высокой пищевой и биологической ценностью, а лактозу и минеральные вещества использовать
в других биотехнологиях. Биологическая ценность сывороточных белков: β-лактоглобулина (β-лг), α-лактальбумина (α-ла), бычьего сывороточного альбумина (БСА), лактоферрина определяется высоким содержанием незаменимых аминокислот. Белки молочной сыворотки широко применяются в качестве компонента при производстве различных продуктов питания [2, 3].
Для получения белковых препаратов с высокой степенью чистоты используют разнообразные хроматографические и другие методы. Однако они требуют больших временных затрат и наличия специального оборудования. Более простыми являются методы селективного осаждения белков с использованием специфических реагентов. К подобным сорбентам относится хитозан и его различные производные. Хитозан представляет собой природный полисахарид, получаемый в результате N-дезацетилирования хитина. Основным мономером хитозана является 2-амино-2-дезоксиглюкопираноза. Благодаря своему полимерному строению, наличию большого числа свободных гидроксильных и аминогрупп, хитозан эффективно связывает различные органические и неорганические соединения. К важным свойствам этого полисахарида относятся его низкая токсичность, способность к биоразложению, а так же невысокая стоимость [4, 5].
Механизм взаимодействия хитозана с белками сыворотки молока может быть различен. Так, возможно протекание реакции между карбонильной группой полисахарида и нуклеофильной группой аминокислоты, образование электростатических, гидрофобных и других типов взаимодействий между двумя биополимерами. В связи с этим, изучение факторов, влияющих на процесс взаимодействия белков сыворотки молока с различными формами хитозана: гранулированной, губчатой и его растворами, является необходимым условием разработки биотехнологии очистки отходов молокоперерабатывающих предприятий [4].
Целью данной работы являлось изучение сорбционной способности хитозана по отношению к различным белкам молочной сыворотки, а также факторов, определяющих эффективность данного процесса.
МАТЕРИАЛ И МЕТОДЫ
В работе использовали: концентрат сывороточных белков, полученный методом ультрафильтрации (КСБ-УФ-70, ОАО «Щучинский маслосырзавод», ТУ РБ 100377914.550-2008) с массовой долей белка 72,8%. Образцы хитозана различной молекулярной массы со степенью дезацетилирования (СД) 86% получали ферментативным гидролизом высокомолекулярного хитозана 200 кДа, СД 86% («Heppe», Германия) препаратом Целловиридин Г20х [4].
Для изучения взаимодействия хитозана с белками молочной сыворотки использовали 1% раствор КСБ в 0,1М буфере MES-NaOH рН 6,2, в который вносили 50 мкл. 1% раствора хитозана. Конечный объем реакционной смеси составлял 1,0 мл. Для проведения реакции хитозан растворяли в 2% уксусной кислоте с последующим титрованием раствора 0,1М NaOH до рН 6,2. Смесь инкубировали в течение 2 час при температуре 30ºС и центрифугировали 10 мин при 9000 g. Осадок ресуспендировали в 0,3М карбонатном буфере рН 9,0 и центрифугировали 10 мин при 9000 g [4].
Для получения гранулированной формы хитозана в стакан с 1М NaOH при медленном перемешивании вносили по каплям 5% раствор хитозана в 1М уксусной кислоте. Гранулы выдерживали в щелочи 12 час и промывали водой до нейтральной реакции. Для сорбции белков к гранулам хитозана добавляли раствор КСБ и инкубировали в течение часа. После удаления надосадочной жидкости гранулы промывали 0,1М буфером MES-NaOH, рН 6,2. Элюцию сорбированного белка проводили 0,5М раствором NaCl в буфере.
Криогели на основе высокомолекулярного хитозана получали при соотношении амминные группы хитозана / альдегидные группы глутарового диальдегида 5/1 по ранее описанной методике [5]. Для выделения белков через колонку с криогелем пропускали молочную сыворотку, после чего сорбент промывали дистиллированной водой и элюировали связавшийся с криогелем белок 0,5М водным раствором NaCl в 0,1М буфере MES-NaOH, рН 6,2.
Полученные образцы белков анализировали с использованием неденатурирующего и денатурирующего электрофореза [6]. Денситометрическую обработку электрофореграмм проводили с использованием специализированного программного обеспечения ImageQuant 5.1. Концентрацию белка измеряли методом Лоури [7].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение процесса взаимодействия хитозана с белками молочной сыворотки проводили путем добавления раствора хитозана, в концентрации 0,5 мг/мл, к 1% раствору сывороточных белков при рН 6,0. Хитозан, связываясь с белками, образовывал нерастворимый белково-полисахаридных комплекс, при этом увеличение оптической плотности при λ 580 нм происходило в течение 30 мин, после чего достигало максимума и в дальнейшем оставалось постоянным. С целью отделения образовавшихся нерастворимых частиц, раствор сывороточных белков, смешанный с хитозаном, был подвергнут центрифугированию в те- чение 10 мин при 9000g. Проводился электрофоретический анализ белков сыворотки молока, входящих в состав нерастворимого комплекса с полисахаридом.
Результаты исследований показали, что основными белками, связанными с хитозаном, являются β-лактоглобулин, α-лактальбумин, БСА. Лактоферрин и некоторые минорные белки участия в образовании комплекса не принимают.
Было установлено количество полисахарида, необходимого для наиболее полного извлечения основных белков сыворотки молока. Для этого хитозан Мv 200 кДа в различной концентрации (0,05-4,0 мг/мл) добавляли к раствору сывороточных белков при рН 6,2, после чего был проведен электрофоретический анализ осадка (рис. 1).
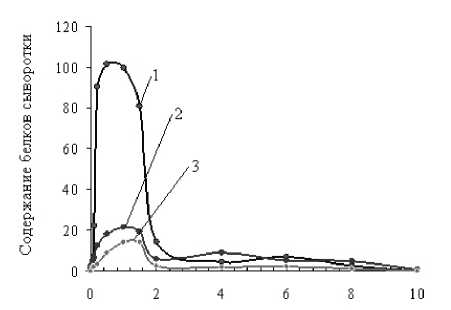
Хитозан, мг/мл
Рис. 1 . Зависимость относительного содержания сывороточных белков в осадке от содержания хитозана в реакционной смеси
Полученные данные свидетельствуют о том, что максимальное связывание β-лактоглобулина и других сывороточных белков с хитозаном наблюдается при содержании полисахарида в реакционной среде 0,5 мг/мл. При этом в осадок переводится 90% белка. При последующем увеличении содержание хитозана в растворе количество образовавшегося осадка значительно снижается. В случае, когда количество хитозана в 1% растворе сывороточных белков превышает 3 мг/мл, нерастворимый хитозан-белковый комплекс не образуется. Вероятно, при избытке полисахарида не все функциональные группы хитозана участвуют в процессе взаимодействия с белками, поэтому такой комплекс теряет способность к седиментации. На связывание белков с хитозаном могут оказать влияние ряд факторов. Их изучение представляет интерес не только с точки зрения понимания фундаментальных механизмов, лежащих в основе взаимодействия макромолекул, но и с практической – подбора оптимальных условий для получения белковых препаратов.
Одним из таких факторов является молекулярная масса хитозана, в зависимости от которой может изменяться эффективность образования нерастворимого хитозан-белкового комплекса. В результате экспериментов установлено, что, независимо от молекулярной массы используемого хитозана, наиболее полное выделение β-лактоглобулина происходит, когда концентрация полисахарида в реакционной смеси составляла 0,5 мг/мл. При добавлении хитозана в концен- трации 0,5 мг/мл в 1% раствор сывороточных белков в 0,1М буфере МЕS-NaOH при рН 6,2 эффективность образования нерастворимого комплекса хитозан-β-лактоглобулин увеличивается с ростом молекулярной массы хитозана от 15 до 200 кДа (рис. 2).
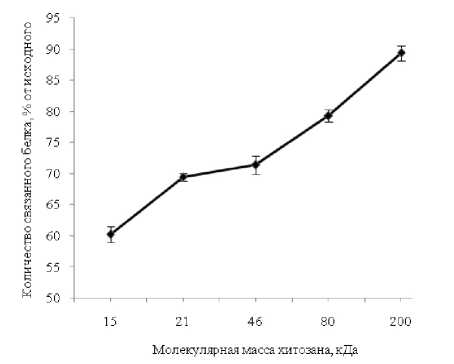
Рис. 2. Эффективность связывания β-лактоглобулина в зависимости от молекулярной массы используемого хитозана; концентрация полисахарида 20 мкг/мл; β-лактоглобулина 200 мкг/мл; рН 6,2, буфер MES-NaOH 0,1M
Это объясняется тем, что в случае использования хитозана с большей молекулярной массой, способность к седиментации образующегося комплекса выше за счет формирования агрегатов большего размера, нежели при использовании низкомолекулярного полисахарида.
Таким образом, высокомолекулярный хитозан наиболее эффективно связывает β-лактоглобулин и другие белки сыворотки молока. Несмотря на это, применение хитозана с молекулярной массой выше 200 кДа затруднено, т.к. с ростом молекулярной массы его растворимость при рН 6,2 уменьшается.
Фактор рН имеет большое значение для реализации многих межмолекулярных взаимодействий, поскольку влияет на ионизацию некоторых функциональных групп полимерных соединений. Изучение процесса взаимодействия хитозана Мv 200 кДа, СД 86% и β-лактоглобулина проводили в диапазоне рН от 5,2 до 6,2, что связано с низкой растворимостью полисахарида в нейтральных и щелочных средах. Результаты эксперимента представлены на рисунке 3. При рН 5,2 не происходит образование осадка, указывающего на формирование комплекса между белком и хитозаном. Наиболее эффективно образование комплекса протекает при рН 6,2. Последнее значение близко к рН подсырной сыворотки, получаемой путем ферментативной обработки коровьего молока. Следует отметить, что в изученном диапазоне рН хитозан находится в протонированной форме (рКа=6,5) [8]. Напротив, β-лактоглобулин имеет отрицательный заряд (рI=4,9–5,4, для разных форм) [9].
При снижении рН происходит нейтрализация отрицательно заряженных групп на поверхности белка, что снижает эффективность образования комплекса. Полученные данные свидетельствуют о важной роли ионогенных групп во взаимодействии β-лактоглобулина с хитозаном. Кроме того, они указы- вают на невозможность выделения белка из «кислой сыворотки», полученной путем изоэлектрической коагуляции казеинов. Однако, несмотря на важную роль электростатических взаимодействий, нельзя исключать существование других типов связей, возникающих при образовании белково-полисахаридного комплекса.
Участие ионогенных групп в формировании нерастворимого комплекса хитозан-β-лактоглобулин можно подтвердить, путем изменения ионной силы раствора. Для этого реакцию проводили в буфере MES-NaOH при рН 6,2 с концентрацией соли от 0,01М до 0,2М.
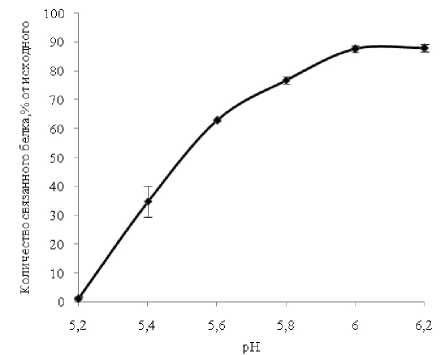
Рис. 3 . Влияние рН среды на эффективность связывания β-лактоглобулина (200 мкг/мл) хитозаном (20 мкг/мл, МV 200 кДа, СД 86%) в 0,1М MES-NaOH буфере
Установлено, что лучше всего хитозан связывается с белком, когда ионная сила раствора минимальна (рис. 4). В то время как в 0,2М буфере взаимодействия не происходит. Полученные данные подтверждают электростатическое взаимодействие в образовании нерастворимого комплекса между хитозаном и β-лактоглобулином.
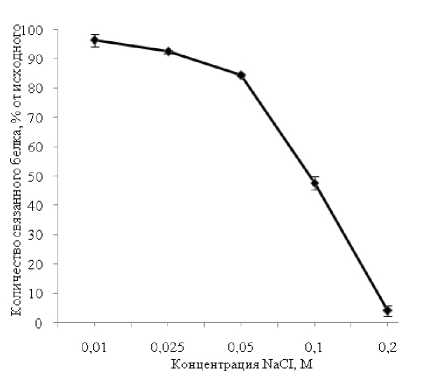
Рис. 4 . Влияние ионной силы раствора на процесс образования нерастворимого хитозан-белкового комплекса. Хитозан Mv 200 кДа, СД 86% в концентрации 20 мкг/мл; концентрация β-лактоглобулина 200 мкг/мл
Молочная сыворотка содержит в своем составе ионы различных металлов, в том числе кальций, который является одним из основных минеральных ком- понентов сыворотки. Исследовано влияние роста концентрации ионов кальция в молочной сыворотке на образование нерастворимого комплекса белков с хитозаном. При достижении концентрации ионов кальция 0,05М практически прекращается образование нерастворимого комплекса. Использование раствора хитозана в оптимальных условиях позволяет выделять 90% белка из молочной сыворотки. Полученный комплекс хитозана с белками сыворотки молока может быть использован в качестве комбикорма для кормления рыб и других животных.
Исследование гранулированной формы хитозана показало его высокую сорбционную емкость по отношению к β-лг. Кроме этого белка происходит частичное связывание и других сывороточных белков: БСА, α-ла и капа-казеина. При использовании этой формы хитозана удаляется до 80% белка из сыворотки молока. Эту методику отличает простота использования и возможность регенерации гранулированной формы хитозана без использования дорогостоящего центрифужного оборудования.
Полученная с использованием криотехнологий [5], губчатая форма хитозана имела степень набухания геля - 250,5% и удерживала до 3000% сыворотки. Использование губчатой формы хитозана в качестве сорбента для выделения белков из молочной сыворотки методом колоночной хроматографии позволяет вести хроматографический процесс с высокой скоростью, достигающей 200 мл/час. При этом сорбент проявлял высокую селективность и большую емкость по белку.
Таким образом, использование раствора хитозана позволяет выделять 90–95% белка из молочной сыворотки. Полученный белок, после удаления хитозана, может быть использован в пищевых целях, а сыворотка с высоким содержанием лактозы - для последующей переработки и получения лактулозы. Использование гранулированной формы хитозана показало его высокую сорбционную емкость по отношению к сывороточным белкам: БСА, β-лг, α-ла и капа- казеина. Методика выделения белков из молочной сыворотки отличается простотой использования и возможностью регенерации гранулированной формы хитозана. Криогель хитозана, в качестве сорбента для выделения белков из сыворотки молока методом колоночной хроматографии, позволяет вести хроматографический процесс с высокой скоростью. При этом сорбент обладал большой сорбционной емкостью по белку.
Список литературы Использование различных форм хитозана для экологически оправданных способов комплексной утилизации сыворотки из отходов переработки молока
- Храмцов А.Г., Полянский К.К., Василисин С.В., Нестеренко П.Г. Промышленная переработка вторичного молочного сырья. Воронеж: Изд-во ВГУ, 1986. С. 8-15.
- Madureira A.R., Pereira С.I., Gomes A.M.P., Pintado M.E., Malcata F.X. Bovine whey proteins -Overview on their main biological properties//Food Res. Int. 2007. V. 40. P. 1197-1211.
- Головач Т.Н., Курченко В.П. Аллергенность белков молока и пути ее снижения//Труды Белорус. гос. ун-та. Сер. Физиол., биохим. и молек. основы функционирования биосистем. 2010. Т. 5. Ч. 1. С. 9-55.
- Бакулин А.В., Гавриленко Н.В., Червяковский Е.М., Курченко В.П., Варламов В.П. Использование хитозана для выделения β-лактоглобулина из смеси белков молочной сыворотки//Биотехнология. 2011. № 1. С. 34-41.
- Никоноров В.В., Иванов Р.В., Кильдеева Н.Р., Булатникова Л.Н., Лозинский В.И. Синтез и свойства криогелей хитозана, сшитого глутаровым альдегидом//Высокомолекулярные соединения. Сер. А. 2010. Т. 52. № 8. С. 1436-1443.
- Остерман Л.А. Методы исследования белков и нуклеиновых кислот: Электрофорез и ультрацентрифугирование (практическое пособие). М.: Наука, 1981. 288 с.
- Rosebrough N.J. Protein measurement with the Folin phenol reagent/O. H. Lowry [et al.]//J. Biol. Chem. 1951. V. 193. P. 265-275.
- Claesson P.M., Ninham B.W. pH-dependent interactions between adsorbed chitosan layers//Langmuir. 1992. V. 8. P. 1406-1412.
- Sawyer L., Kontopidis G. The core lipocalin, bovine β-lactoglobulin//Biochim. Biophys. Acta. 2000. V. 1482. P. 136-148.


