Исследование аминокислотного состава кормовой добавки методом ионообменной хроматографии
Автор: Волнин А.А., Мишуров А.В., Михина А.А., Коротаева А.А., Севко А.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (75), 2018 года.
Бесплатный доступ
Определение содержания аминокислот в кормах для сельскохозяйственных животных имеет большую научно-практическую значимость. Это необходимо для более точной детализации норм кормления и балансирования рационов животных по содержанию аминокислот и белка, а, следовательно, способствует повышению продуктивности животных. В данной работе рассмотрены вопросы применения ионообменной хроматографии с постколоночной дериватизацией проб нингидрином для исследования аминокислотного состава кормов для сельскохозяйственных животных. Определено общее содержание аминокислот (кроме триптофана) в кормовой добавке. Концентрация треонина составила 3,26 г/100г протеина, лейцина – 6,43, изолейцина – 3,24, валина – 4,77, метионина – 2,18, лизина – 2,90, фенилаланина – 3,16, гистидина – 2,03, тирозина – 2,33, суммы аспарагина и аспарагиновой кислоты – 6,76, серина – 3,97, суммы глутамина и глутаминовой кислоты – 12,04, глицина – 6,00, аланина – 6,71, аргинина – 6,93, пролина – 3,08, суммы цистина и цистеина – 1,38. Выполнена оценка полноценности добавки по содержанию незаменимых аминокислот в сравнении с референтным белком ФАО/ВОЗ и определены лимитирующие аминокислоты. Аминокислотный скор треонина составил 81,5%, лейцина – 91,9%, изолейцина – 81%, валина – 95,4%, лизина – 52,7%, суммы фенилаланина и тирозина – 91,5%, суммы метионина и цистеина – 101,7%. Определено соотношение незаменимых и заменимых аминокислот: 0,57. Установлена относительно низкая биологическая ценность (относительно референтного белка ФАО/ВОЗ) исследованной кормовой добавки по содержанию незаменимых аминокислот. Данная добавка может быть использована в кормлении сельскохозяйственных животных в комплексе с другими кормовыми компонентами, содержащими свободные аминокислоты и / или белки, в составе рациона, сбалансированного по содержанию незаменимых аминокислот.
Аминокислоты, ионообменная хроматография, аминокислотный скор, постколоночная дериватизация, кормовая добавка
Короткий адрес: https://sciup.org/140229959
IDR: 140229959 | DOI: 10.20914/2310-1202-2018-1-199-205
Текст научной статьи Исследование аминокислотного состава кормовой добавки методом ионообменной хроматографии
Повышение потребности населения в продуктах питания является основным стимулом развития отрасли животноводства. При этом одной из тенденций является повышение продуктивности сельскохозяйственных животных за счет использования молекулярно-генетических методов селекции в сочетании с оптимизацией условий содержания, обеспечивающей наиболее полную реализацию высокого генетического потенциала животных. Повышение эффективности кормления является одним из решающих факторов в этой системе. Кормление животных в настоящее время динамично развивается благодаря поступлению новых экспериментальных данных о составе и качестве кормов и их конверсии в организме животных [1–3, 18, 19].
Аминокислоты являются одними из ключевых компонентов питания животных, как в составе белковой диеты, так и в качестве дополняющих продуктов [1, 4]. Считается, что белок не является питательным веществом. Животные нуждаются в аминокислотах, а не в белке как таковом. Качество кормового белка определяется его потенциалом для покрытия физиологических требований в отношении аминокислот на поддержание жизнедеятельности и продуктивность (рост, воспроизводство, моло-кообразование и т. д.). Потребность в кормовом белке зависит от вида животных, возраста, генотипа и пола. Отсюда следует, что существуют два важных фактора, определяющих качество белка, а) профиль аминокислот, который представляет собой соотношение незаменимых аминокислот в белке и b) их усвояемость [1]. В рационе животных возможен недостаток одной или нескольких незаменимых аминокислот, необходимых для поддержания оптимального роста и здоровья [1, 4]. Исследование аминокислотного состава кормов имеет крайне важную роль в оптимизации систем кормления, детализации и нормировании рационов сельскохозяйственных животных [5-7].
Наиболее распространенными методами количественного аминокислотного анализа являются высокоэффективная жидкостная хроматография (ВЭЖХ) и ионообменная хроматография с постколоночной дериватизацией проб нингидрином. Однако в практике рутинного анализа, при значительном количестве исследуемых проб метод ионообменной хроматографии имеет ряд существенных преимуществ по сравнению с ВЭЖХ: более высокая точность определения, воспроизводимость результата и надежность (высокая производительность этого метода является следствием того, что большинство загрязнений быстро перемещаться по колонке и выходят из системы, прежде чем начинается разделение аминокислот), а также более простая подготовка проб (по сравнению с методами предколоночной дериватизации) [8–14].
Метод ионообменной хроматографии с постколоночной дериватизацией проб нингидрином стандартизирован Международной организацией по стандартизации (EN ISO 13903), а также Регламентом Европейской Комиссии № 152/2009; рекомендован к использованию для анализа аминокислотного состава сырья и кормов, а также контроля полноценности аминокислотного питания животных Европейской федерацией производителей кормовых добавок и кормов для животных (FEFANA, фр. Fédération Européenne des Fabricants d’Adjuvants pour la Nutrition Animale) [1].
В данной работе рассмотрены вопросы применения ионообменной хроматографии с постколоночной дериватизацией проб нингидрином для исследования аминокислотного состава кормов для сельскохозяйственных животных. Определено общее содержание аминокислот (кроме триптофана) в кормовой добавке на основе продуктов переработки отходов мясной промышленности, выполнена оценка полноценности добавки по содержанию незаменимых аминокислот в сравнении с референтным белком ФАО/ВОЗ и определены лимитирующие аминокислоты.
Материалы и методы
Для подготовки проб использовали кислотный гидролиз в растворе 6 М соляной кислоты, с добавлением норлейцина в качестве внутреннего стандарта. Гидролиз выполняли в термостате при 110 °С в течении 24 ч. Для определения цистина и метионина пробы окисляли 50% раствором надмуравьиной кислоты, которую предварительно готовили из муравьиной кислоты и перекиси водорода, с добавлением фенола.
Определение содержания сырого протеина выполняли методом Кьельдаля [15].
Для расчёта аминокислотного скора белка аминокислотный скор каждой незаменимой аминокислоты в «идеальном» референтном белке ФАО/ВОЗ [16] принимали за 100%, а в исследуемом – определяли процент соответствия. Если значение скора для определенной аминокислоты ниже 100%, данную аминокислоту определяли как лимитирующую.
Результаты и обсуждение
Метод ионообменной хроматографии с постколоночной дериватизацией работает на основе того факта, что аминокислоты являются катионами при рН 2,2, удерживаются ионообменной смолой колонки и при элюировании градиентом с повышением рН смываются с нее согласно изоэлектрическим точкам молекул. На выходе с колонки разделившиеся аминокислоты вступают в специфическую реакцию с нингидрином, при высокой температуре, с образованием окрашенного продукта, который количественно определяют используя фотометрическое детектирование при 440 нм – для пролина и 570 нм – для всех других аминокислот [1, 10, 12].
Анализ аминокислот проводят после кислотного гидролиза белков (кроме триптофана). Для более полного нахождения метионина и цистеина (с димером последнего – цистином), кислотный гидролиз проводят с предварительно окисленными (количественно) серосодержащими радикалами аминокислотных остатков. В результате образуются соответствующие продукты окисления – метионинсульфон и цистеиновая кислота. Данный метод позволяет определить 17 протеиногенных аминокислот (за исключением триптофана, разрушающегося при кислотном гидролизе, аспарагина и глутамина, которые гидролизуются в аспарагиновую и глутаминовую кислоты, соответственно). Сумма определяемых аминокислот включает свободные аминокислоты и аминокислоты, которые были связанные в составе белка до гидролиза [12]. Схема аминокислотного анализатора представлена на рисунке 1.
В исследуемой кормовой добавке было установлено содержание сырого протеина: 18,29%. Было определено содержание незаменимых и заменимых аминокислот. Аминокислотный состав кормовой добавки представлен в таблице 1.
Был рассчитан аминокислотный скор, соотношение незаменимых и заменимых аминокислот и определены лимитирующие аминокислоты. Результаты исследования представлены в таблице 2.
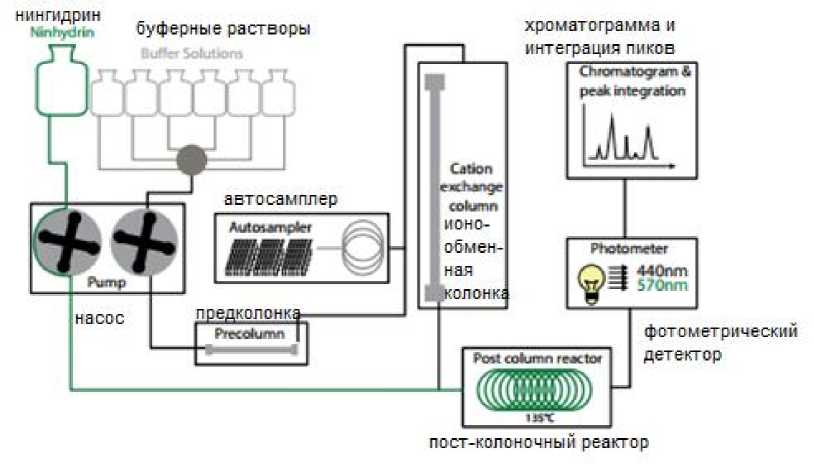
Рисунок 1. Общая схема аминокислотного анализатора [1]
Figure 1. The General scheme of amino acid analyzer [1]
Таблица 1.
Аминокислотный состав кормовой добавки, г/100 г. протеина
Amino acid composition of feed additive, g/100 g of protein
Table 1.
Незаменимые аминокислоты | Essential amino acids
|
THR |
LEU |
ILE |
VAL |
MET |
LYS |
PHE |
HIS |
|
|
3,26 |
6,43 |
3,24 |
4,77 |
2,18 |
2,90 |
3,16 |
2,03 |
|
|
Заменимые аминокислоты | Non-essential amino acids |
||||||||
|
TYR |
ASP |
SER |
GLU |
GLY |
ALA |
ARG |
PRO |
CYS |
|
2,33 |
6,76 |
3,97 |
12,04 |
6,00 |
6,71 |
6,93 |
3,08 |
1,38 |
Таблица 2.
Аминокислотный скор и соотношение незаменимых и заменимых аминокислот
Amino acid score and ratio of essential and non-essential amino acids
Table 2.
|
«Идеальный белок» ФАО/ВОЗ | «Ideal protein FAO/WHO»[9] |
Незамени- |
||||||
|
THR |
LEU |
ILE |
VAL |
MET 1 CYS |
LYS |
PHE 1 TYR |
мые/заменимые |
|
4 |
7 |
4 |
5 |
3,5 |
5,5 |
6 |
essential/non-es- |
|
Аминокислотный скор | Amino acid score, % |
sential |
||||||
|
81,5* |
91,9* |
81,0* |
95,4* |
101,7 |
52,7* |
91,5* |
0,57 |
* – лимитирующая аминокислота
Исходя из результатов очевидно, что исследуемая кормовая добавка наименее полноценна по содержанию лизина, скор этой аминокислоты составил 52,7%. Среди основных протеиногенных аминокислот, лизин является одной из ключевых незаменимых аминокислот [1]. Лизин необходим для синтеза гемоглобина и нуклеопротеидов [17].
Аминокислотный скор изолейцина, лейцина и валина составил 81; 91,9 и 95,4% соответственно. Изолейцин, лейцин и валин являются аминокислотами, имеющими разветвленные алифатические цепи в радикалах. Их метаболизм интересен тем, что данные аминокислоты имеют общие пути катаболизма и, следовательно, могут создавать помехи друг другу при усвоении. Лейцин является сильным регулятором катаболизма аминокислот с разветвленной цепью, поэтому избыток лейцина в рационе нежелателен для животных [1, 3–4]. Лейцин и изолейцин обладают сильно выраженным кетогенным свойством. Валин связан с обменом холестерола, каротиноидов, метилмасляных кислот, служит источником образования гликогена и кофермента А [17]. Аргинин является незаменимым для молодых животных [1]. Установлено, что кормовая добавка содержит аргинин в количестве 6,93 г./100г протеина. Аргинин, превращаясь в орнитин (орнитиновый цикл, совокупность процессов образования мочевины), участвует в обезвреживании конечных продуктов азотистого обмена (аммиак), связан с функцией паращитовидных желез, служит источником образования креатина и креатинина, играя важную роль в энергетическом обмене [17]. Аминокислотный скор треонина составил 81,5%. Треонин, превращаясь в глицин, используется для синтеза протопорфирина, холестерола, жирных кислот и углеводов. В обмене веществ он тесно связан с лейцином и является антагонистом метионина и серина [17]. Аминокислотный скор суммы фенилаланина и тирозина составил 91,5%. Фенилаланин и тирозин являются «взаимо-превращаемыми» аминокислотами, имеющиеся данные показывают, что тирозин может частично обеспечить потребность в фенилаланине и наоборот [1]. Фенилаланин и тирозин служат источником образования в организме таких гормонов как тироксин, адреналин и норадреналин, а также пигментов меланинов. Нарушение обмена этих аминокислот сопровождается тяжелыми расстройствами общего обмена веществ, приводящими не только к снижению продуктивности, но и к гибели животных [17].
В представленной добавке аминокислотный скор более 100% был установлен лишь у суммы метионина и цистеина. Метионин участвует в ряде важных биосинтетических процессов, участвуя в обмене холина, креатина и адреналина через высвобождение метильной группы [1, 17]. Метионин является первой аминокислотой, встраивающейся в рибосомы при биосинтезе полипептидных цепей белков в клетках [10]. В настоящее время гистидин рассматривается как незаменимая аминокислота [1]. Установленное содержание гистидина в исследованной кормовой добавке составило 2,03 г./100г протеина. Гистидин необходим для синтеза гемоглобина, входит в состав карнозина и ансерина, содержащихся в мышцах. При декарбоксилировании гистидина образуется гистамин, являющийся физиологически активным соединением [17].
Полученные результаты свидетельствуют об относительно низкой биологической ценности (относительно референтного белка ФАО/ВОЗ) исследованной кормовой добавки по содержанию незаменимых аминокислот. Данная добавка может быть использована в кормлении сельскохозяйственных животных в комплексе с другими кормовыми компонентами, содержащими свободные аминокислоты и/или белки, в составе рациона, сбалансированного по содержанию незаменимых аминокислот.
Заключение
Исследование аминокислотного состава кормовых компонентов имеет важное значение в рационализации норм кормления сельскохозяйственных животных и балансировании рационов. В данной работе выполнен анализ
Список литературы Исследование аминокислотного состава кормовой добавки методом ионообменной хроматографии
- Dalibard P., Hess V., Tutour L., Peisker M. et al. Amino Acids in Animal Nutrition//FEFANA Publication, FEFANA. Brussels, 2014.
- Эрнст Л.К., Зиновьева Н.А. Биологические проблемы животноводства в XXI веке. М., 2008.
- D’Mello J.P. Felix Amino acids in animal nutrition, Second Edition//CABI Publishing. 2003
- Karau A, Grayson I. Amino acids in human and animal nutrition//AdvBiochemEngBiotechnol. 2014. № 143. Р. 189-228 DOI: 10.1007/10_2014_269
- de Sousa Prado J.P., Oliveira Cavalheiro J.M., da Silva J.A., Cavalheiro T.B. et al. Amino acid profile and percent composition of meals and feeds used in shrimp farming//Gaia Scientia. 2016. № 10,4. Р. 347-360.
- Purwin C., Fija?kowska M., Lipi?ski K., Wierzbowska J. et al. Changes in amino acid composition during ensiling lucerne and red clover in round bales//J. Elem. 2015. № 20.4. P. 965-973. doi: 10.5601/jelem.2015.20.1.863.
- Adejumo I. O., Adetunji C. O., Ogundipe K., Osademe S. N. Chemical composition and amino acid profile of differently processed feather meal//Journal of Agricultural Sciences, 2016. № 61,3. P. 237-246 DOI: 10.2298/JAS1603237A
- Ween O., Stangeland J.K., Fylling T.S., Aas G.H. Nutritional and functional properties of fishmeal produced from fresh by-products of cod (Gadus morhua L.) and saithe (Pollachius virens)//Heliyon. 2017. № 3, 7 DOI: 10.1016/j.heliyon.2017.e00343
- Silvao C.F., Nunes A.J.P. Effect of dietary amino acid composition from proteins alternative to fishmeal on the growth of juveniles of the common snook, Centropomus undecimalis//R. Bras. Zootec. 2017. № l.46. Р. 7
- Шапошников М.Н., Севко А.В., Севко Д.А., Волнин А.А. и др. Анализ аминокислотного состава молока коров симментальской породы//Ветеринария, зоотехния и биотехнология. 2015. № 11. С. 70-75
- Volnin A.A., Sheraliev F.D., Shaposhnikov M.N., Zaitsev S.Y. et al. Amino acid score of milk proteins of the interspecific hybrids of argali and domestic sheeps//RJOAS. 2017. № 4,64. P. 240-247. 10.18551/RJOAS.2017-04.31 DOI: 10.18551/rjoas.2017–04.31
- Волнин А.А., Шералиев Ф.Д., Шапошников М.Н., Зайцев С.Ю. и др. Применение ионообменной хроматографии при оценке биологической ценности белков молока овец//Актуальные вопросы биологической физики и химии. 2017. № 1, 2. C./494-498./
- Jaji? I., Krstovi? S., Glamo?i? D., Jak?i? S. et al. Validation of an HPLC method for the determination of amino acids in feed//J. Serb. Chem. Soc. 2013. № 78, 6. P. 839-850.
- Dai Z, Wu Z, Jia S, Wu G Analysis of amino acid composition in proteins of animal tissues and foods as pre-column o-phthaldialdehyde derivatives by HPLC with fluorescence detection//J Chromatogr B AnalytTechnol Biomed Life Sci. 2014. № 27. Р. 964, 116. DOI: 10.1016/j.jchromb.2014.03.025
- ISO 5983-1:2005 Feeds, mixed feeds and raw material. Determination of mass fraction of nitrogen and calculation of mass fraction of crude protein. Part 1. Kjeldahl method
- FAO. Energy and protein requirements. Report of a Joint FAO/WHO/UNU Expert Consultation. Geneva: World Health Organization, 1985. 112 p.
- Алиев А.А. Обмен веществ у жвачных животных. М.: НИЦ «Инженер», 1997
- Дерканосова А. А., Коротаева А. А. Особенности российского рынка комбикормов и перспективы его развития//Экономика. Инновации. Управление качеством. 2013. № 3. С. 107.
- Дерканосова А.А. Анализ перспективы производства отечественных кормовых препаратов//Вестник Воронежского государственного университета инженерных технологий. 2012. № 2. С. 194-196.


