Исследование анеугенных эффектов с помощью панцентромерных зондов в условиях резидентного воздействия радона
Автор: Ларионов Алексей Викторович, Волобаев Валентин Павлович, Сердюкова Екатерина Сергеевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 5-4 т.20, 2018 года.
Бесплатный доступ
Низкодозовое воздействие включает ряд непрямых радиационных эффектов в том числе «эффект свидетеля» и феномен увеличения генетической нестабильности. В представленной работе предпринята попытка оценить хроническое влияние сверхмалых доз радона при хроническом облучении на формирование анеугенных эффектов, являющихся признанным маркером действия плотноионизирующего излучения. Для проведения исследования использовался метод флуоресцентной гибридизации in situ (FISH) с панцентромерными зондами, специфически связывающимися с областью центромеры. Одновременно проводилось измерение радиационных параметров: объемной активности радона (ОА 222Rn) в воздухе жилого помещения и показатель бета- и гамма-фона. Установлено, что средняя частота двуядерных клеток с микроядром составляет 15,4‰. Доля С+ составляет 23,9%. При этом значимых различий в частоте показателей между группой мужчин и женщин не обнаружено. Обнаруженное увеличение частоты микроядер с увеличением ОА радона может быть вызвано дополнительным хроническим экспонированием радоном. В то же время тенденция к увеличению доли центромер-позитивных микроядер в группе с наибольшим уровнем радона не получила статистического подтверждения.
Микроядерный тест, радон, панцентромерные зонды
Короткий адрес: https://sciup.org/148314102
IDR: 148314102 | УДК: 575.043
Текст научной статьи Исследование анеугенных эффектов с помощью панцентромерных зондов в условиях резидентного воздействия радона
Современные подходы к радиационной безопасности предусматривают наиболее полный учет всех источников ионизирующего излучения (ИИ) в среде обитания человека. Риски, связанные с воздействием относительно высоких доз (более 0,1 Гр), определяются по современной консенсусной оценке 5% на Зиверт. В то же время данная оценка, предусмотренная линейной беcпороговой концепцией, не характеризует в полной мере долговременное воздействие низких доз ИИ [1]. Низкодозовое воздействие включает ряд непрямых радиационных эффектов, в том числе «эффект свидетеля» и феномен увеличения генетической нестабильности. Данные риски нашли отражение в концепции наименьшего из возможных достижимых радиационных воздействий (ALARA) [2]. При этом низко интенсивные источники являются крайне сложными с точки зрения оценки биологических эффектов, но крайне важными, учитывая глобальные масштабы радоновой проблемы. Проблеме радона в современных исследованиях справедливо уделяется большое внимание как проблеме основного
радиационного фактора непрофессионального (резидентного) облучения населения Земли.
Радон – радиоактивный газ, признанный одним из наиболее опасных канцерогенов, действующих на организм человека. Его выделение в атмосферу происходит постоянно в результате распада природного изотопа урана-238. Очаги выделения радона расположены неравномерно на земной поверхности; их расположение зависит от географического положения объекта, форм микрорельефа, состава материнской горной породы, а также дефектов конструкции строений, используемых строительных материалов и т.д. В природных условиях радиоактивный газ быстро рассеивается в атмосфере и достаточно быстро распадается (период полураспада изотопа Rn222=3,82 суток), поэтому данный радиационный фактор не играет большой роли на открытой местности. Однако, закрытые пространства – жилые и производственные помещения – являются своеобразными «ловушками», которые способны накапливать радон, и его концентрация может в 10 раз превышать таковую на открытом воздухе. Это становится причиной серьезного радиоактивного облучения людей, находящихся в таких помещениях в течение длительного времени. Таким образом, радоновое облучение составляет не менее 50% от общего радиационного облучения современного человека.
Установлено, что облучение радоном может приводить к развитию рака легкого в условиях как профессионального, так и бытового облуче- ния людей. В настоящее время обсуждается роль низкодозового облучения радоном в индукции лейкемии [3], немеланомного рака кожи [4] и злокачественных образований желудочно-кишечного тракта [5].
Микроядерный тест в условиях цитокине-тического блока признан простым и эффективным методом, который позволяет выявить хромосомные нарушения в результате воздействия неблагоприятных факторов окружающей среды. В настоящее время он является одним из основных методов биологической дозиметрии, также как и метод оценки частоты дицентри-ческих хромосом [6,7]. Оба метода показывают наличие стабильной корреляции с суммарной поглощенной дозой ионизирующего излучения, накопленной объектом.
Информативность метода микроядерного теста была повышена за счет дискриминации между спонтанными и кластоген-индуцированными микроядрами (МЯ) [8,9] – современная методика флюоресцентной гибридизации in situ (FISH) с панцентромерными зондами, которые связываются специфически с областью центромеры. Микроядра (МЯ), содержащие метки, обозначаются С+, не содержащие С-, соответственно.
Этот же метод позволяет провести косвенный анализ потерь хромосом и их фрагментов в клетках. По сравнению с ним, обычная рутинная окраска не дает возможности различить микроядра, вызванные поломками в хромосомном материале, и микроядра, вызванные анеуплоидией. Кроме того, рутинные методы не позволяют оценить степень тяжести хромосомного повреждения, так как невозможно определить, содержится в ядре целая хромосома или только ее часть.
Однако, данный метод делает цитоплазму трудно различимой при микроскопировании вследствие специфики подготовки препаратов. Поэтому стандартный подход подсчета числа микроядер в фиксированном количестве клеток, основанный на дифференцировке двуядерных клеток от клеток других типов, не представляется возможным. Вследствие этого, ряд исследователей предпочитают подход, основанный на подсчете определенного числа микроядер, с последующим расчетом доли центромер-пози-тивных МЯ [10, 11].
МАТЕРИАЛЫ И МЕТОДЫ
Обследованная выборка
Материалом для исследования послужили образцы биоматериала, полученные у 52 жителей г. Кемерово, не занятых на вредных производствах. Одновременно проводилось измерение радиационных параметров: объемной активности радона (ОА 222Rn) в воздухе жилого помещения и показатель бета- и гамма-фона.
Всего было обследовано 26 мужчин (средний возраст – 30 лет, от 24 до 41 года) и 26 женщин (средний возраст 36 лет, от 24 до 50 лет).
Исследование проводили, руководствуясь требованиями Комиссии по этике Кемеровского государственного универсистета. Протокол заседания комиссии по этике утвержден на заседании Комиссии № 4 от 10.10.2016 г. Участники исследования подписывали форму информированного согласия, содержащую информацию о целях исследования.
Микроядерный тест
Образцы венозной крови собирались в гепа-рин-содержашие вакутейнеры объемом 4 мл и хранились при температуре 4 'С не более 24 часов до культивирования. Образец цельной крови объемом 200 мкл переносился в культуральный флакон площадью 25см2 (TPP, Швейцария). Культуральная среда включала 3 мл RPMI-1640 (Па-нэко, Москва), 0,8 мл эмбриональной телячьей сыворотки (Hyclone, США), 55 ЕД/мл пеницилли-на-стрептомицина. Фитогемагглютинин добавлялся в концентрации 30 мг\флакон, и культуры инкубировались в течение 44 часов при 37% в атмосфере 5% CO2. На 44-м часу добавлялся цитохалазин В (Aplichem, США) в концентрации 6 мг\ мл. Затем клетки культивировались еще 24 часа, после чего переносились в пробирки и обрабатывались 0,125М KCl в течение 30 с. Затем добавлялся 1 мл свежего фиксатора Карнуа (3 части метанола на 1 часть ледяной уксусной кислоты). После 3 смен фиксатора (5 мл фиксатора Карнуа), клеточные суспензии помещались на хранение при -20 'С [12]. Супернатант при этом удалялся после центрифугирования, объем клеточного осадка не превышал 200 мкл. Суспензии раскапывались на холодные сухие стекла, окрашивались азур-эози-ном и анализировались с помощью микроскопа Nikon Eclipse 80i в проходящем свете при увеличении 1000х с использованием масляной иммерсии. Для каждого препарата исследовалась 1000 двуядерных клеток, учитывались клетки с микроядрами согласно протоколу, разработанному M.Fenech, 2000 [13].
Флуоресцентная гибридизация (FISH)
Для приготовления препаратов использовали сухие стекла, на которые раскапывалась клеточная суспензия. Полученные препараты отмывались трехкратно в 2х SSC (высокосолевой цитратный буфер) по 5 минут в 3-х кюветах Шиффердеккера. Далее на 5 минут предметные стекла помещались в раствор пепсина для гидролиза белков (0,01% пепсина (70 мл воды + 70 мкл 10% пепсина + 70 мкл HCl (к)), раствор применяется теплым при 37 'С). Затем препараты фиксировались в течение 10 минут в параформальдегиде (0,5 г сухого параформальдегида + 50 мл 1х PBS + 5 мкл 5 M NaOH) и отмывались 5 минут в 1х PBS буфере (Amresco, США).
После этого стекла высушивались в батарее спиртов (70%, 80%, 96/100%) по 5 минут в каждом из сосудов. После стекла просушивали на нагревательном столике. Наносили по 10 мкл зондов на стекло, убирали пузыри, накрывали покровным стеклом, после чего заклеивали края стекла быстрозатвердевающим клеем. Препараты с нанесенными зондами помещались в ги-бридайзер (Termobrite, США) в условиях влажной среды на 5 мин при 75 градусах, от 16 до 24 часов при 37 градусах. Режим Denat and Hyb. После гибридизации флуоресцентные зонды надежно связывались с маркерным участком, для предотвращения быстрого выцветания флуорофора проводили обработку. Готовили WT1 (2 мл 20х SSC + 98 мл воды + 300 мкл Nonidet) и WT2 (10 мл 20х SSC + 90 мл воды + 100 мкл Nonidet), NONIDET P-40 (NP40) – мягкий неионный неденатурирующий детергент [14].
С предметных стекол снимали покровные и помещали в разогретый до 72 'С раствор WT1. Дальнейшие операции с препаратами проводились в темноте. Стекла экспонировались в растворе WT2 в течение 5 минут. После просушивания препаратов от остатков воды добавляли каплю реактива Prolong Gold antifade with DAPI. Затем на препараты наносили быстросохнущий лак.
Полученные препараты просматривались на флуоресцентном микроскопе Carl Zeiss Axio Imager 2 при увеличении 1000. Критерии отбора двуядерных лимфоцитов и учет микроядер проводили согласно стандартной методике. Учитывалась 1000 двуядерных лимфоцитов на каждом препарате. Микроядро со светящейся меткой содержит центромеру.
Статистические методы
Статистический анализ данных проводили с использованием пакета Statistica 10.0. Для количественных показателей рассчитывались средние значения и пределы 95% доверительного интервала (ДИ 95). Сравнение групп выполняли с использованием U-теста Манна-Уитни. Уровень значимости был принят на уровне 5%. Корреляцию между показателями для случая непараметрических данных рассчитывали с использованием коэффициента корреляции Пирсона для рангов.
РЕЗУЛЬТАТЫ
Среднее значение объемной активности (ОА) радона в воздухе помещений составило 113,5 Бк/м3, значение МАЭД гамма-фона составило 0,11 мкЗв/ч, плотность потока бета-излучения 0,5 с-1.
Установлена средняя частота двуядерных клеток с микроядром (15,4‰). Доля С+ составила 23,9% (табл. 1). При этом значимых различий в частоте показателей между группой мужчин и женщин не обнаружено.
Частота клеток с микроядром увеличивалась с возрастанием ОА радона в воздухе помещений. Доля центромер-позитивных микроядер также возрастала в группе обследованных с уровнем ОА более 200 Бк/м3 в сравнении с первой группой (менее 50 Бк/м3) (табл. 2).
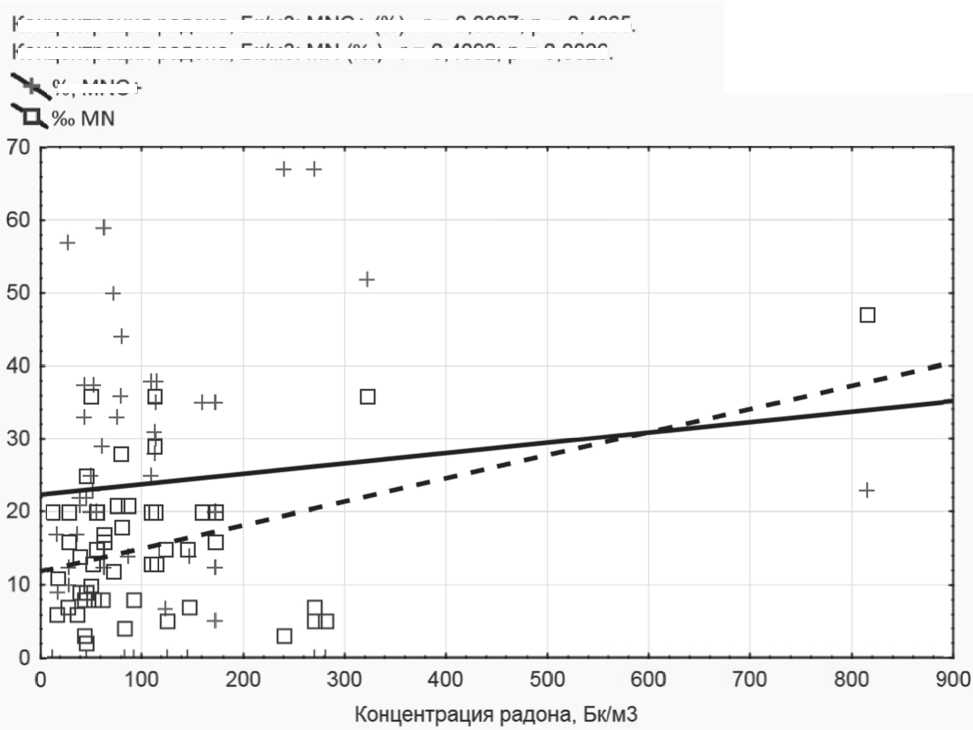
Также была рассчитана возможная корреляция между исследованными показателями и ОА радона (рисунок 1). Отмечена корреляция между долей 2-ядерных клеток с МЯ и ОА радона в воздухе (р=0,0026), в то же время доля С+МЯ несколько увеличивалась с возрастанием ОА, однако данная тенденция не подтверждена при расчете коэффициента корреляции (р=0,48). Не было найдено корреляции между частотой
Таблица 1. Частота микроядер и доля центромер-позитивных микроядер в обследованной группе
|
MN %о, [95% ДИ] |
c+ MN, %, [95% ДИ] |
||
|
Муж |
Жен |
Муж |
Жен |
|
14,0 [10,2-17,8] |
16,9 [13,1-20,7] |
21,3 [14,2-28,3] |
26,6 [19,6-33,7] |
|
N=26 |
N=26 |
N=26 |
N=26 |
Примечание. Приведено значение частоты двуядерных лимфоцитов с микроядром (‰), а также доля центро-мер-позитивных микроядер (%) и 95% доверительный интервал (ДИ)
Таблица 2. Частота 2-ядерных клеток с микроядром и доля центромер-положительных микроядер (С+МЯ/С-МЯ) в условиях разного уровня радона в помещении
|
ОА радона в воздухе помещения, Бк/м3 |
N |
Частота 2-яд. с МЯ, %о (95% ДИ) |
Доля С+ МЯ, % (95% ДИ) |
|
<50 Бк/м3 |
14 |
11,1 [6,0-16,2] |
18,4 [8,9 - 28,0] |
|
50 - 100 Бк/м3 |
16 |
15,9 [11,2 -20,7] |
26,5 [17,6 - 35,4] |
|
100 - 200 Бк/м3 |
16 |
18,1 [13,3-22,8] |
22,1 [13,2 - 31,0] |
|
>200 Бк/м3 |
6 |
17,2 [9,4-24,9] |
34,7 [20,2 - 49,3] |
|
Всего |
52 |
15,4 [8,0-11,9] |
23,9 [15,1 - 22,3] |
Примечание. Приведена частота микроядер (‰) и доля центромер-позитивных микроядер (%) и 95% доверительный интервал (ДИ)
%, MNC+
Рис. 1. Корреляция частоты 2-ядерных клеток с микроядром и доли центромер-положительных микроядер (С+МЯ/С-МЯ) с ОА радона в помещении
Концентрация радона, Бк/мЗ: MNC+ (%) - г = 0,0987; р = 0,4865.
Концентрация радона, Бк/мЗ: MN (%0) - г = 0,4092; р = 0,0026.
микроядер в двуядерных лимфоцитах и долей центромер-позитивных микроядер и возрастом обследованных.
ОБСУЖДЕНИЕ
Показатели цитогенетических повреждений считается чувствительным к воздействиям различных факторов, включая накопленную дозу радиации. Накопленная доза радиации может приводить к формированию разрывов ДНК, не-репарированные разрывы могут приводить к формированию цитогенетических аномалий. Микроядра формируются в результате отставания фрагментов хромосом или целых хромосом в анафазе деления. Данный метод показал хорошие перспективы в качестве средства оценки биологического эффекта накопленной дозы радиации, в частности отмечена чувствительность на уровне 0,25 Гр для показателя спонтанных микроядер. Данный подход показал эффективность при обследовании пострадавших в Чернобыльской аварии [15] и Стамбульской аварии (декабрь 1998 - январь 1999) [16].
Подавляющее большинство случаев формирования МЯ связано с их формированием в результате потери и не включения в дочерние ядра крупных фрагментов: ацентрических хромосомных фрагментов, ацентрических хроматидных фрагментов или целых хромосом. Подобные крупные фрагменты не прикрепляются к веретену деления во время сегрегации ядер [17]. Вокруг таких хромосом и их участков формируется ядерная мембрана, что придает микроядрам морфологическое сходство (за исключением размеров) с ядрами клеток после проведения окрашивания.
В дальнейшем микроядра могут провоцировать нарушение деления клетки вследствие активации путей репликации или репарации ДНК. Клетка может закончить свое существование путем апоптоза [18]. Возможно, процесс образования микроядер занимает важное место в геномной пластичности опухолевых клеток [19]. Высказывалось мнение, что вскоре после формирования микроядра в клетке, уничтожаются или вытесняются [20]. Более полное описание судьбы микроядер и содержащих их клеток, является приоритетным направлением будущих исследований.
Если процесс деления все же осуществляется, то содержащаяся в микроядре хромосома способна к нормальной репликации. При нормальной сегрегации в последующем митозе возможно образование двух нормальных диплоидных клеток. Также в некоторых случаях, в микроядре могут наблюдаться дефекты сегрегации и репликации, что может приводить к формированию двух дочерних клеток, одна из которых содержит сохранившееся микроядро. Если микроядро способно реплицироваться, но не может быть сегрегировано должным образом в последующем митозе, то клеточное деление ингибируется с формированием двуядерной клетки [21].
Образование ацентрических хромосомных фрагментов может быть обусловлено несколькими механизмами. Несколько десятилетий назад было установлено, что к симметричным и несимметричным хроматидным и хромосомным обменам могут приводить ошибки репарации разрывов двойной спирали ДНК. Таким образом образуются как хроматидные, так и хромосомные фрагменты. Небольшое количество хромосомных фрагментов может образоваться в результате ошибок процесса репарации разрывов молекулы ДНК. Это происходит в том случае, когда нагрузка, ведущая к повреждению ДНК, превосходит репаративный потенциал клетки. Вероятность ошибок репарации увеличивается при наличии ошибок гомологичной рекомбинации ДНК, в которой нарушения связаны с дефектами в соответствующих генах, таких как BRCA1 и BRCA2. Также известно, что разрывы ДНК, приводящие к образованию МЯ, могут быть неотрепарированы в связи с дефектами ферментов, связанных с репарацией по типу негомологичного слияния концов [22].
К формированию микроядер также могут приводить такие механизмы, как одновременное повреждение эксцизионной репарации (например, 8-оксо-диоксогуанозин), миноргые ошибочные основания, включаемые в состав нити ДНК (например, урацил), в том случае, если они находятся в непосредственной близости и на противоположной комплементарной нити ДНК. Действуя одновременно, эти события эксцизионной репарации приводят к разрывам двойной спирали ДНК и образованию МЯ, особенно в случаях, когда разрыв не заполняется (репарируется).
Знание этих процессов может быть использовано для увеличения чувствительности микроядерного теста путем конвертирования эксцизионно-отрепарированных повреждений ДНК в разрыв цепи ДНК и соответственно МЯ посредством обработки цитозин-арабонозидом (во время G1 фазы клеточного цикла), который ингибирует заполнение разрыва (репарацию разрыва) на стадии эксцизионной репарации. Таким образом, тест становится более чувстви- тельным к воздействию основных генотоксических агентов, индуцирующих образование ДНК-аддуктов.
Недавние исследования также показали, что формирование МЯ может быть связано с фрагментированным хромосомным материалом, образующимся во время формирования моста, растянутого и сломанного во время телофазы [23].
У здоровых людей микроядра в лимфоцитах обычно образуются как из ацентрических фрагментов, так и из целых хромосом в соотношении между 30 к 70% и 70 к 30% в зависимости от пола и возраста. Частота образования МЯ повышается с увеличением возраста; у женщин она в целом выше по сравнению с мужчинами. Половые хромосомы определяют повышение потерь хромосом в процессе митоза с возрастом. У женщин X-хромосома может составлять до 72% от всех МЯ, при этом 37%, по видимости, связано с дефектами кинетохора, что, вероятно, связано с инактивацией Х-хромосомы [24].
Одним из механизмов образования микроядер являются нарушения расхождения хромосом в анафазе. Например, вследствие гипометилирования цитозина в цетромерных и перицентромерных повторяющихся последовательностях (классические сателлитные повторы в перицентромерных регионах и повторы высшего порядка в центромерной ДНК). В норме классическая сателлитная ДНК подвергается метилированию остатками цитозина, но при синдроме ICF (иммунодефицит) метилирование не происходит, как и в результате обработки 5-азацидином (ингибитором ДНК-метилтрансферазы).
При гипометилированной цитозине перицентромерные регионы 1, 9 и 16 хромосом значительно удлиняются. Это служит причиной нарушения сегрегации хромосом, а также их потери и реализации в МЯ, вероятно, из-за неверной сборки кинетохора. Объединения кине-тохорных белков (например, CENPA и CENPB) в центромерах, обычно, связано со статусом метилирования цитозина, а также метилирования гистонов. В последнем случае уменьшение целостности гетерохроматина может помешать прикреплению микротрубочек к кинетохору.
Ключевая роль кинетохорных белков при соединении хромосом с нитями веретена деления может быть причиной того, что дефекты в ки-нетохорных белках и микротрубочках приводят к формированию микроядер из потерянных в анафазе хромосом. Отставшие хромосомы могут быть материалом для формирования МЯ также в случае дефектов веретена деления, дефектов чек-пойнт генов, контролирующих митоз, а также ненормальной амплификации центросом. Установлено, что дицентрические хромосомы, сформированные по итогам объединения концов теломер, зачастую способны вовлекаться в события сегрегации. Это происходит, если в анафазе центромеры дицентрических хромосом растягиваются к разным полюсам клетки с достаточными силами, чтобы оторвать хромосомы от веретена деления [25].
Для распознавания МЯ, образованных целыми хромосомами и ацентрическими фрагментами, использован метод панцентромерных ДНК-зондов. Специфичные хромосомные пробы позволяют разделять хромосомные потери, приводящие к формированию МЯ даже в случае отсутствия сформированных МЯ.
ЗАКЛЮЧЕНИЕ
Модифицированный метод микроядерного теста, который позволяет дифференцировать анеугенные и кластогенные эффекты, является перспективным методом биодозиметрии. Представленные данные являются частью проекта по исследованию влияния низкодозового облучения радоном на организм человека, и в дальнейшем планируется существенное расширение группы обследованных. Обнаруженное увеличение частоты микроядер с увеличением ОА радона может быть вызвано дополнительным хроническим экспонированием радоном. В то же время тенденция к увеличению доли центромер-позитивных микроядер в группе с наибольшим уровнем радона не получила статистического подтверждения, что не исключает перспектив подобного показателя для оценки хронического экспонирования радоном.
Список литературы Исследование анеугенных эффектов с помощью панцентромерных зондов в условиях резидентного воздействия радона
- Burtt J.J., Thompson P.A., Lafrenie R.M. Non-targeted effects and radiation-induced carcinogenesis: a review // J. Radiol. Prot. 2016. Vol. 36. R23-R35.
- Valentin J. The 2007 recommendations of the International Commission on Radiological Protection. ICRP publication 103. Ann ICRP. 2007. Vol. 37(2-4). P. 1-332.
- Henshaw D.L., Eatough J.P., Richardson R.B. Radon: A causative factor in the induction of myeloid leukaemia and other cancers in adults and children? // The Lancet. 1990. Vol. 335. P. 1008 - 1012.
- Radon and skin cancer in southwest England: an ecologic study / B.W. Wheeler, J. Allen, M.H. Depledge, A. Curnow // Epidemiology. 2012. Vol. 23 (1). P. 44-52.
- Kjelberg S., Wiseman J.S. The relationship of radon to gastrointestinal malignancies // Am. Surg. 1995. Vol. 61 (9). P. 822-825.


