Исследование анодной поляризации границы раздела Ag (Hg) / Ag4RbI5
Автор: Остапенко Г.И.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая физика и электроника
Статья в выпуске: 2 т.4, 2002 года.
Бесплатный доступ
Методом потенциостатических импульсов исследовано электрохимическое поведение границы раздела Ag(Hg)/Ag4RbI5. Выяснено, что скоростьопределяющей стадией электродной реакции является перенос электрона при плотности тока обмена 68 мА/см2 и коэффициенте переноса около 0,45. Из поляризационных исследований амальгамы серебра с различной концентрацией определен порядок электрохимической реакции окисления серебра. Сделано заключение, что при анодной поляризации ртуть ионизируется и внедряется в электролит вместе с серебром согласно эмпирическому уравнению: 15Ag + 85Hg. 100e = 15Ag+ + 85Hg+. Из сравнения электрохимического поведения границ раздела Ag(Hg)/Ag4RbI5 и Ag/ Ag4RbI5 сделан вывод, что скорость анодного растворения серебра на границе раздела Ag/Ag4RbI5 лимитируется кристаллизационными эффектами.
Короткий адрес: https://sciup.org/148197706
IDR: 148197706 | УДК: 537.9+541.12/13
Текст научной статьи Исследование анодной поляризации границы раздела Ag (Hg) / Ag4RbI5
Для оптимизации эксплуатационных характеристик различных электрохимических устройств с твердыми электролитами требуется тщательное исследование возможных электродных материалов. Поэтому было опубликовано до статочно много работ по кинетике серебряного электрода в контакте с низкотемпературным твердым электролитом Ag4RbI5. Эти работы можно условно разделить на три группы. В одних работах утверждается, что скоростьопределяющей стадией электродного процесса является электрокристаллизация серебра [1, 2]. В других указывается, что электрокристаллизация не есть скорость определяющая стадия процесса [3, 4]. И, наконец, в некоторых работах утверждается, что для объяснения кинетических закономерностей нужно привлекать специальные теории для твердых электролитов [5]. Во всяком случае, до сих пор отсутствует единое мнение о природе скоростьопределяющей стадии на границе раздела Ag/Ag4RbI5.
В то же врямя известно, что на амальгамированных электродах кристаллизационные эффекты исключены [6]. В работах [7, 8] было показано, что скорость электрохимической реакции значительно возрастает на амальгамированном серебряном электроде в контакте с твердыми электролитами. Кажется логичным, что детальное исследование амальгамированного серебряного электрода позволит внести большую ясность относительно скоро стьопределяющей стадии электродной реакции на границе раздела Ag/ Ag4RbI5.
В представленной работе импульсным потенциостатическим методом исследована кинетика амальгамированного серебряного электрода и амальгамы серебра в контакте с твердым электролитом Ag4RbI5.
Эксперимент
Твердый электролит приготовлен по известному методу, описанному в [9].
Ячейки: Ag (Hg) / Ag4RbI5 / Ag были приготовлены в атмосфере сухого воздуха (осушитель Р2О5). Сначала давлением 2,2 108 Па прессовали таблетку Ag4RbI5. Затем припрессовывали порошок серебра как противоэлек-трод. Диаметр ячейки составляет 12 мм и толщина слоя электролита - около 1 мм. Электрод сравнения из серебряной проволоки диаметром 0,2 мм впрессовывали в середину слоя электролита. Плоский амальгамированный серебряный электрод или амальгаму серебра помещали на слой электролита как рабочий электрод.
Концентрированную амальгаму серебра получали длительным выдерживанием металлического серебра в ртути. Концентрацию серебра в амальгаме снижали посредством разбавления концентрированной амальгамы.
Поляризацию ячеек проводили через два часа после их изготовления. Импульсы потенциала подавали на ячейки посредством потенциостата П-5848 (Россия) при комнатной температуре. Потенциостатические отклики ток - время регистрировали с помощью запоминающего осциллографа С8-1 (Россия).
Результаты и дискуссия
Сразу после изготовления ячеек потенциал рабочего электрода медленно увеличивался в течение 1…2 часов до 0,08…0,1 В в зависимости от концентрации амальгамы. По-видимому, ртуть медленно химически взаимодействует с Ag4RbI5 [8]. Однако это не мешает протеканию тока через границу элек-трод/электролит.
Анодные потенциостатические отклики ток i ‒ время t амальгамированного серебряного электрода показаны на рис.1 (Наклон фронта обусловлен быстродействием потенциостата). Видно, что ток не зависит от времени. Следовательно, скоростьопределяю-щей стадией электродной реакции является перенос заряда. Вольт-амперная характеристика амальгамированного электрода (рис.2, кривая 1) соответствует уравнению для переноса заряда:
i, A см -2
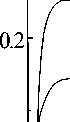
0.1
80 мВ
60 мВ
40 мВ
20 мВ
10 мВ
0.5
1.0 1.5 t, мс
Рис.1. Потенциостатические отклики ток-время на границе раздела амальгамированный серебряный электрод / Ag4RbI5 при различных перенапряжениях η
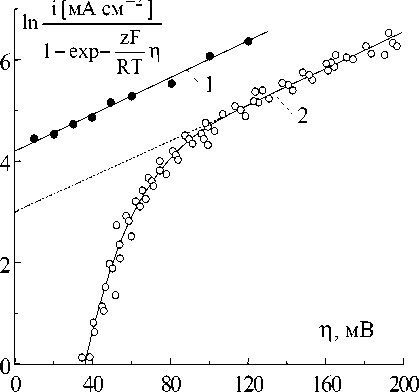
Рис.2. Вольт-амперные характеристики на границах раздела.
1 - амальгамированный серебряный электрод / Ag4RbI5, 2 ě Ag / Ag4RbI5[2]
i zF
ln = ln i0 +α η (1)
zF 0 RT
1 - exp- η
RT
(где η ‒ перенапряжение) при плотности тока обмена i 0 = (68 ± 5) мА см-2 и коэффициенте переноса α около 0,45.
Вольт-амперная характеристика границы раздела Ag/Ag4RbI5 показана на рис.2 (кривая 2) для сравнения. Эта характеристика получена согласно результатам аналогичных потенциостатических исследований [2] при временах переходов 0,5…2 мс. При этих временах нарушение контакта электрод/электро-лит вследствие образования пустот при электрохимическом растворении серебра практически не имеет места. Видно, что при перенапряжениях более 0,1 В эта характеристика описывается уравнением (1) для переноса заряда при i 0 = (20 ± 2) мА см-2 и α ≈ 0,45. Но при напряжениях менее 0,1 В вольт-амперная характеристика не соответствует уравнению (1). Следовательно, при этих перенапряжениях возникают именно кристаллизационные эффекты, т.к. на амальгамированном электроде такие эффекты не наблюдаются.
Проанализируем механизм влияния ртути на поведение серебряного электрода. Takahashi и другие [7] утверждают, что ртуть
-1
c Ag,sat (насыщенная амальгама)
-2
о 9"-'"' .-'О''
ln i [ м A c м -2 ]
x'b 0.1 cAg,sat о/ * 0.01Ag,sat
-0.8
-3 100
ϕ , мВ
ln i [ м A c м -2 ]
-1.0
-1.2
-1.4
-1.6
ln c Ag c Ag,sat
0 -1 -2 -3 -4 -5
-1.8
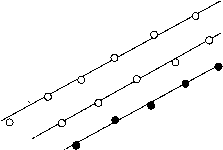
Рис.3. Вольт-амперные характеристики на границе раздела амальгама серебра / Ag4RbI5 при различной концентрации амальгамы взаимодействует с междуузельными ионами серебра и этим устраняет скоростьопределя-ющую стадию их взаимодействия с вакансиями ионов серебра. Raleigh [10] предполагает улучшение микроконтакта на границе элект-род/электролит при жидкой границе, что приводит к увеличению эффективной площади этой границы.
Для выяснения механизма влияния ртути мы предположили, что ртуть может взаимодействовать с Ag4RbI5 не только химически, но и электрохимически. Для проверки этого предположения также потенциостати-ческим методом было исследовано анодное поведение амальгамы серебра с различной концентрацией.
Анодные вольт-амперные характеристики амальгам серебра показаны на рис.3. Видно, что положение поляризационных кривых зависит от концентрации сAg амальгамы. Это дает возможность определить порядок электрохимической реакции окисления серебра [6]:
∂ ln i RT
ZAg = при η >> .
∂ ln cAgzF
Зависимость ln i от ln cAg при потенциале ϕ = 200 мВ показана на рис.4. Наклон этой прямой, т.е. ZAg , равен приблизительно 0,15. Для жидкого металлического электрода при единичной валентности переноса электрона, порядок электрохимической реакции равен стехиометрическому числу окисляющегося серебра. Следовательно, 0,15 атома серебра
Рис.4. Зависимость тока (при ϕ = 200 мВ) от концентрации амальгамы (из рис.3)
требуется для переноса одного электрона через границу. Поэтому необходимо предположить, что недостаток заряда поставляется (предоставляется) атомами ртути в соответствии с эмпирическим уравнением:
15 Ag + 85 Hg ‒ 100e = 15 Ag+ +85 Hg+.
Следовательно, при анодной поляризации границы раздела Ag (Hg)/Ag4RbI5, ртуть ионизируется и внедряется в электролит вместе с серебром.
Выводы
Скоростьопределяющей стадией электродного процесса на границе раздела Ag(Hg)/Ag4RbI5 является перенос электронов. При анодной поляризации ртуть вместе с серебром ионизируется и внедряется в Ag4RbI5.
На границе раздела Ag/Ag4RbI5 при перенапряжениях менее 0,1 В скорость анодного растворения серебра лимитируется кристаллизационными эффектами.
Закономерности исследованных электрохимических реакций хорошо соответствуют классическим уравнениям электрохимической кинетики и для описания реакции переноса электронов для твердых электролитов разработка специальных уравнений не требуется.
По-видимому эти выводы могут быть полезны при исследовании других твердофазных электрохимических реакций с участием металлических электродов.


