Исследование аутофлюоресценции и флюоресценции «Фотодитазина» в органах мышей при различных методах введения
Автор: Кузнецова Юлия Олеговна, Саидов Аюбджон Саймуродович, Калягина Нина Анатольевна, Брехов Евгений Иванович, Ягудаев Даниэль Меерович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 6-1 т.15, 2013 года.
Бесплатный доступ
В данной работе представлен спектральный анализ особенностей диффузного отражения органов и флуоресценции фотосенсибилизатора «Фотодитазин» в органах мышей, в соответствии с их оптическими свойствами. Для этого, сначала были изучены особенности поглощения, рассеяния и аутофлуоресценции, а затем проведено исследование динамики накопления фотосенсибилизатора в органах мыши в зависимости от времени. Для каждого исследуемого органа мыши и для каждой временной точки были разработаны алгоритмы анализа и обработки данных, позволяющие избежать интерпретационных ошибок.
Аутофлюоресценция, флюоресценция, рассеяние и поглощение
Короткий адрес: https://sciup.org/148202488
IDR: 148202488 | УДК: 535.37
Текст научной статьи Исследование аутофлюоресценции и флюоресценции «Фотодитазина» в органах мышей при различных методах введения
На сегодняшний день существует несколько методов для отслеживания движения и накопления препаратов в органах. Самыми известными из них являются радиоизотопная диагностика, рентгенологическое исследование, и высокоэффективная жидкостная хроматография [1, 2, 3]. Однако, помимо наличия недостатков, связанных с использованием радиоактивных соединений, рентгеновского аппарата [1] и йодистых препаратов [2], эти методы не позволяют сделать комплексной и количественной оценки препаратов во всех органах. Методы оценки/детектирования флюоресценции, в свою очередь, способны визуализировать и количественно оценивать содержание препаратов-красителей в организме. Поэтому, целью нашей работы является разработка алгоритма анализа динамики накопления препаратов в организме с помощью флюоресцентного анализа. Для достижения данной цели мы проведем спектральный анализ органов мыши до и после введения флюоресцентного маркера -фотосенсибилизатора (ФС), проследив, таким образом, динамику накопления препарата в за-
висимости от времени. При разработке алгоритма анализа полученных спектральных данных будут учтены различия в поглощении, рассеянии и аутофлюоресценции исследуемых тканей.
Несмотря на то, что в медицинской практике лимфотропное введение препарата применяется уже более 320 лет [4], все еще остаются не изученным характер распределения препаратов в различных органах, расположенных в лимфо-зоне и на расстоянии от нее. Поэтому, разработанный алгоритм будет апробирован на примере анализа распределения ФС в организме мышей при сравнении двух методов введения: внутривенном и лимфотропном. Акцент такого исследования будет сделан на паховой области, поскольку в настоящее времени в клинической медицине проблема лечения воспаления яичек остается актуальной и, по данным авторов [5, 6, 7], пациенты с острыми воспалительными заболеваниями яичка и его придатка составляют до 10,2 % в структуре экстренных урологических заболеваний. Однако стоит также обратить внимание на распределение препарата и в паренхиматозных органах, таких как печень, почки и селезенка, т.к. они участвуют в кроветворении и являются естественными фильтрами организма.
-
2. МАТЕРИАЛЫ И МЕТОДЫ
-
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для проведения эксперимента в качестве биологических моделей были взяты белые лабораторные мыши, а в качестве фотосенсибилизатора – “Фотодитазин”. ФС вводился в организм мыши двумя способами: лимфотропно и внутривенно. При лимфотропном методе инъекция “Фотоди-тазина” производилась подкожно, в паховую зону (слева) - в область скопления лимфотических со- судов, а при внутривенном методе - в хвостовую вену мыши в концентрации 5 мг/кг в объеме 20 мкл/мышь. В качестве источника излучения для передачи излучения к исследуемым органам и возбуждения флюоресценции использовался He-Ne лазер с длиной волны 632,8 нм и выходной мощностью из торца волокна 5 мВт. Детектирование сигнала осуществлялось с помощью лазерного спектроанализатора «LESA-01-BIOSPEC» посредством волоконно-оптического зонда [8]. При измерениях зонд находился «в контакте» с тканями мыши. Сначала проводились измерения спектров диффузного отражения и аутофлуоресценции различных органов мышей, а затем оценивалось накопление препарата в промежутки времени между 15-ой минутой и 24-мя часами.
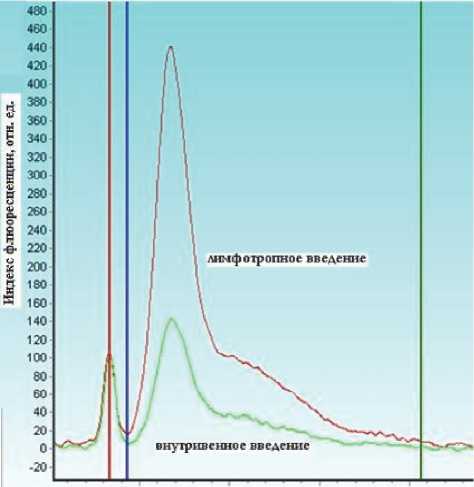
После преобразования и обработки сигнала посредством лазерного спектроанализатора «LESA-01-BIOSPEC», были получены спектрограммы от различных участков органов мышей. При измерениях без введенного ФС в организм мыши, спектрограммы представляли собой кривые с одним выраженным пиком (диффузного отражения), отвечающим за рассеяние и поглощение лазерного излучения (пик слева в диапазоне 625-642 нм), и небольшим подъемом, отвечающим за аутофлюоресценцию органов (пик справа в диапазоне 642-810 нм) (рис.1). Для пика диффузного отражения (в области длины волны излучения) было характерно более сильное поглощение почками и печенью по сравнению с поглощением яичком. Это связано с тем, что кровенаполненность этих органов выше и гемоглобин, содержащийся в этих органах, поглощает в данном диапазоне длин волн [9]. При измерениях с введенным ФС, спектрограммы представляли собой кривые с двумя выраженными пиками: одним - отвечающим за рассеяние и поглощение (пик слева) и другим - отвечающим за флюоресценцию препарата (пик справа) (рис. 2).
Спектральные данные анализировались в ограниченных диапазонах, в пределах которых оценивались рассеяние, поглощение, аутофлюоресценция и флюоресценция, обусловленная ФС, а также определялись границы данных диапазонов (посредством расстановки «маркеров»). Маркер М1 (красный) был поставлен на первый пик нашего спектра (отвечающий за рассеяние и поглощение, (рис. 1)). Маркеры М2 и М3 (синий и зеленый) были размещены таким образом, чтобы площадь, заключенная между этими маркерами и спектром флюоресценции не включала в себя часть спектра, соответствующую шумам. Границы диапазонов были выбраны индивидуально для каждого из органов и тканей, согласно их оптическим свойствам.
Для яичка маркеры были распределены следующим образом (по длинам волн): М1=632.82 нм, М2=646.15 нм и М3=793 нм. Далее к спектрограммам была применена функция (Р2_3)/М1, позволяющая получить соотношение площади под кривой флюоресценции (P2_3) к соответствующему пику обратного рассеяния (M1). Если спектрограммы находились на разных уровнях относительно оси абсцисс, то, во избежание ошибок в вычислениях, они были приведены к одному уровню.
После обработки сигналов были выбраны спектрограммы, имеющие максимальное значе-
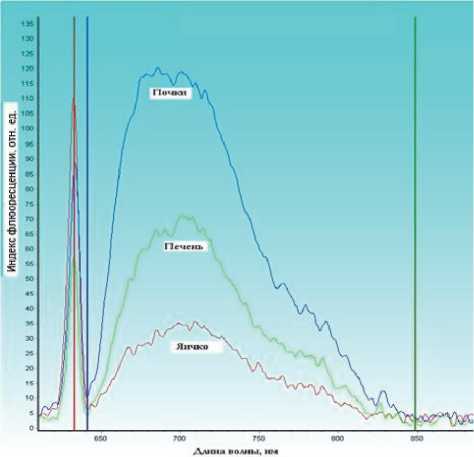
Рис. 1. Пример спектров поглощения, обратного рассеяния и аутофлюоресценции яичка, печени и почек
650 700 750 800
Диша волны, нм
Рис. 2. Пример детектирования различий в флюоресцентных сигналах при различных способах введения (в яичках, на 60 мин)
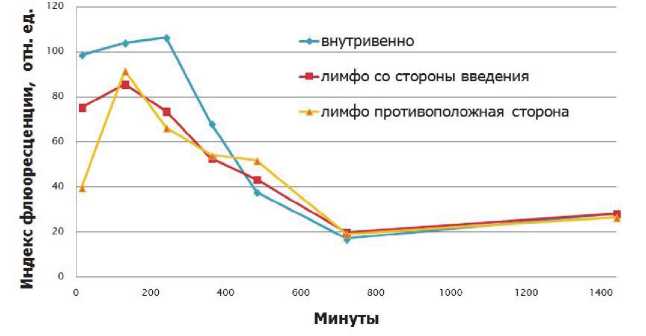
Рис. 3. График зависимости индекса флюоресценции ФС от времени для яичек
ние индекса флюоресценции (интенсивности флюоресценции) для каждого органа и исследуемой временной точки. На основе полученных данных были получены зависимости интенсивности флюоресценции от времени для яичка, печени и почек (рис. 3, 4 и 5).
На первых минутах при лимфотропном введении наблюдается избирательное накопление препарата в яичке, находящемся на стороне места введения по сравнению с противоположенным (рис. 3). В связи с медленным оттоком ФС из места лимфотропного введения, в первые часы (15мин-6 часов) накопление Фотодитазина при внутривенном введении выше, чем при лимфотропном. С течением времени наблюдается увеличение содержания препарата при лимфотропном введении по сравнению с внутривенным (рис. 3). Также было выявлено, что при внутривенном введении накопление ФС происходит до 240 мин, а затем преобладает его постепенное выведение из органа. В то время как при лимфотропном способе препарат удерживается плоть до 480 мин, что говорит о более пролонгированном нахождении ФС при данном способе введения. Протекание данного процесса также связано с тем, что “Фотодитазин” постепенно поступает из места введения препарата и подпитывает лимфатическую систему. После временной точки в 12 часов концентрация препарата в яичке уменьшается и графики, отвечающие обоим способам введения, устремляются в одну точку.
При внутривенном введении содержание ФС в печени и почках достигает своего максимума (рис. 4 и 5) намного быстрее, чем в яичках, а при лимфотропном его содержание остается намного ниже до тех пор, пока они не сойдутся в одну точку (к 240-360 мин соответственно). Однако, в почках после 360 мин наблюдается более высокое содержание препарата при лимфотропном введении по сравнению с внутривенным.
3. ЗАКЛЮЧЕНИЕ
Проведенные исследования позволили определить наиболее эффективный алгоритм обработки и анализа спектральных данных различных органов и тканей (содержащих и не содержащих ФС), благодаря которому, предоставляется возможным отслеживание накопления препарата в органах в зависимости от времени, избегая интерпретационных ошибок.
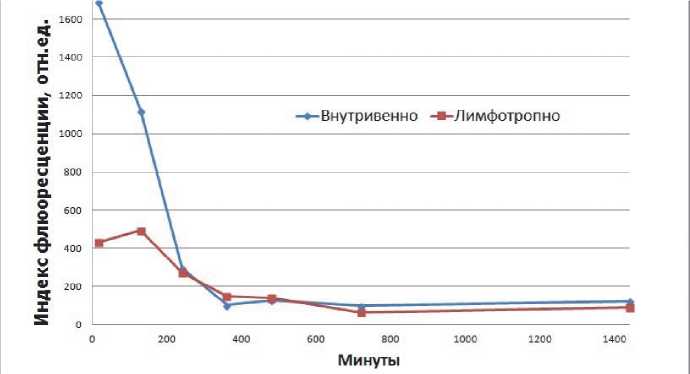
Рис. 4. График зависимости интенсивности флюоресценции ФС от времени для печени
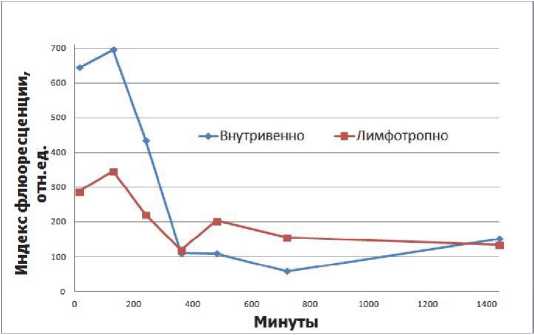
Рис. 5. График зависимости интенсивности флюоресценции ФС от времени для почек
Полученные результаты апробации данного алгоритма показывают, что лимфотропный метод введения может потенциально повысить эф- 2. фективность лечения, т.е. снизить гепето-, нефротоксичность, т.к. на определенных временных 3. промежутках накопление препарата в печени и 4. почках заметно ниже. Однако, для подтверждения этого, требуется провести дальнейшие иссле- 5.
дования на мышах с воспалением и новообразованиями, в т.ч. с целью выявления наиболее эф- 6. фективных и минимально токсичных методов воздействия препаратов на ткани и органы. 7.
Список литературы Исследование аутофлюоресценции и флюоресценции «Фотодитазина» в органах мышей при различных методах введения
- Важенин А.В., Яйцев С.В., Васильева Е.Б., Сырчикова Е.А., Радионуклидная диагностика и терапия как современное перспективное направление развития ядерной медицины на Южном Урале, Вестник Уральской медицинской академической науки, номер 2, с.123, 2012
- Aichinger H. Radiation exposure and image quality in x-ray diagnostic radiology: physical principles and clinical applications. -Springer, 2012
- Хенке Х. Жидкостная хроматография. -Litres, 2013.
- Ю.M. Левин, П.К. Ионов, Н.И. Косякова, Лимфотропное введение лекарственных препаратов: средства и методы практической лимфологнии, Москва, 1987г.
- Cафаров Ш.А. Cовременные подходы к лечению острого эпидидимоорхита.//дисс. канд. мед.наук. -М. 2007.
- Корюков Д.В. Современные аспекты диагностики и лечения острого неспецифического эпидидимоорхита. дис. на соиск. уч. ст. канд. мед. наук, 2010 г.
- Белый Л.Е., Оострый эпидидмит: этиология, патогенез, диганостика и лечение. Урология. № 2, 2010 г.
- Loschenov V.B, Konov V.I., and Prokhorov A.M., Photodynamic Therapy and Fluorescence Diagnostics, Laser Physics, 10, No. 6, 2000, pp. 1188-1207
- Рогаткин, Д. А. "Физические основы оптической оксиметрии." медицинская физика, 2 (2012)


