Исследование белков, связывающих токсины гуанидинового ряда в морском черве Cephalothrix simula: поиск потенциальных антидотов морских токсинов
Автор: Власенко Анна Евгеньевна, Кротов Антон Сергеевич, Горобец Екатерина Алексеевна, Магарламов Тимур Юсифович, Мельникова Дарья Игоревна, Кузнецов Василий Геннадьевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-3 т.18, 2016 года.
Бесплатный доступ
В работе в морском черве Cephalotrix simula впервые обнаружены и исследованы белковые соединения, обладающие способностью связывать сильнейшие нейротоксины гуанидинового ряда - тетродотоксин-подобные вещества. Методами дот-блот иммуноанализа и нативного белкового электрофореза показана токсин-связывающая активность этих соединений и определена их молекулярная масса 200-220 кДа.
Гуанидиновые токсины, тетродотоксин-связывающие белки, нейротоксины, антидот
Короткий адрес: https://sciup.org/148204546
IDR: 148204546 | УДК: 615.279
Текст научной статьи Исследование белков, связывающих токсины гуанидинового ряда в морском черве Cephalothrix simula: поиск потенциальных антидотов морских токсинов
Тайваня и Юго-Восточной Азии. Однако все больше токсичных животных обнаруживается и в европейских водах. Их появление объясняется двумя факторами: использованием судами балластных вод и открытием Суэцкого канала, связывающего Индийский и Атлантический океаны. Немаловажную роль в распространении животных, содержащих гуанидиновые токсины, играют и глобальные катаклизмы, такие, как цунами. Так, в 2004 г. цунами, возникшее в Индийском океане, привело к появлению токсичных рыб фугу у берегов Таиланда [2].
Большую роль в распределении животных, содержащих гуанидиновые токсины, играет температура. Повышение или понижение температуры приводит к изменению скорости накопления токсина. Микробные популяции, являясь первоисточником гуанидиновых токсинов в морской среде, также в значительной степени зависят от внешних факторов, в том числе и от температуры. Исследования микробного состава различных органов токсичной рыбы фугу T. niphobles показали, что понижение температуры уменьшает разнообразие и выживаемость ассоциированных бактерий [3].
ТТХ и его аналоги являются водорастворимыми и термостабильными, т.е. термическая обработка морепродуктов не убирает, а более того увеличивает их токсичность [4]. Токсический эффект самого ТТХ в сотни раз выше цианистого калия, а антидота от отравления ТТХ-подобными токсинами на сегодняшний день не существует. Попытки поиска препаратов для лечения отравлений токсинами гуанидинового ряда предпринимаются и по сей день. Так, в 1984 г. Кру с соавторами предложили использовать антихолинэстеразные препараты (неостигмин и атропин) для ослабления симптоматики токсического эффекта [5]. Лекарственная терапия не доказала своего положительного эффекта. Еще одним перспективным антидотом являются антитела к ТТХ. Ксу с соавторами синтезировал моноклональные антитела и показал эффективность их использования в нейтрализации ТТХ и сакситоксина как in vitro, так и in vivo [6]. Однако антитела слабо связывали токсины и потому в медицинской практике так и не нашли применения в качестве лекарств против отравлений морепродуктами. Симптомами отравления токсинами гуанидинового ряда являются: перио-ральная нечувствительность, парестезия, паралич, дыхательная недостаточность, гипоксия, гипотония, брадикардия, рвота, раздражение пищеварительного тракта и др. [7]. В настоящий момент во всех случаях отравления морскими токсинами используется наблюдение и поддерживающая терапия [8]. Так, например, ТТХ выводится из организма в течение 4 дней вместе с мочой и в этот период, в наиболее тяжелых случаях отравления, пациенты находятся на искусственной вентиляции легких.
При поиске антидотов к токсинам гуанидинового ряда целесообразно обратить внимание на ТТХ-носящих животных и выяснить причины их резистентности к токсину. Существует две гипотезы возникновения такой резистентности. Было обнаружено, что белки некоторых наземных ТТХ-носящих животных, формирующие натриевый канал, мутированы, т.е. конформация канала изменена [9-11]. Из чего можно сделать вывод, что на такие мутированные каналы ТТХ не садится. Согласно второй гипотезе, резистентность связана с наличием ТТХ-связывающих белков. Белки, чувствительные к ТТХ и его аналогам, были выявлены в крабе Hemigrapsus sanguineus , в некоторых брюхоногих моллюсках [12] и в рыбах фугу Fugu pardalis [13] и Takifugu niphobles [14].
Немертины - единственные животные, которые целенаправленно используют токсин как «орудие лова» или защиты от врагов, и для этого накапливают его в определенных органах. Так, ультраструктурное изучение немертины Lineus alborostratus показало, что ТТХ-подобные токсины локализуется только в секреторных клетках покровного эпидермиса и в железистых клетках эпителия хобота [15]. Столь «жесткая» и «целенаправленная» локализация токсина косвенно указывает на наличие механизма и молекулярных структур, ответственных за его перенос и «удержание». Кроме того, изучение распределения ТТХ и его аналогов на ультра-микроскопическом уровне показало, что токсины ассоциированы с органоидами белкового синтеза - т.е. предположительно, токсины ассоциированы с белками.
Цель работы: произвести поиск токсин-связывающих белков в морском черве Cephalo-thrix simula , как потенциальных антидотов низкомолекулярных токсинов гуанидинового ряда из морских гидробионтов.
Методика исследований. Немертины C.simula были собраны в ризоидах бурых водорослей Saccharina sp. в заливе Восток залива Петра Великого (Японское море) в июле-августе 2016 г. Немертин содержали в аэрируемых аквариумах с проточной морской водой (t=17°C).
Для оценки концентрации гуанидиновых токсинов общую пробу из 5 немертин весом 102 мг тщательно растирали до гомогенного состояния в стерильном ручном гомогенизаторе (EMS, USA). К полученному гомогенату добавляли 0,1% водный раствор уксусной кислоты в соотношении 1:10 и помещали в ультразвуковой гомогенизатор HD 2070 (Bandelin Sonopuls, Германия) на 15 мин, с частотой 20 kHz, амплитудой 228 мкм, с рабочим циклом 0,8 с и интервалом 0,2 с. Полученный экстракт центрифугировали при 10000 g в течение 10 мин, а затем надосадочную жидкость упаривали в вакуумном испарителе при 500°С. Оставшийся после упаривания осадок доводили 0,1% водным раствором уксусной кислоты до 2 мл. Раствор затем фильтровали с помощью 3 кДа фильтров Microcon Ultarcel YM-3 (Millipore, США). Для удаления белковой фракции раствор нагревали до 85°С в течении 20 мин, затем коагулированные белки осаждали, а супернатант хранили при -80°С для дальнейших исследований.
Определение концентрации токсинов гуанидинового ряда проводили на культуре клеток мышиной нейробластомы Neuro-2a (ATCC, CCL131), предоставленной банком клеточных культур эукариот университета Лозанны (Швейцария). Культивация велась в среде Игла в модификации Дюльбекко DMEM (Gibco, США) содержащей 4,5 г/л D-глюкозы, а также глютамин, пируват и антибиотики - 1000 U/ml пенициллина и 10 mg/ml стрептомицина (Sigma, США), дополненной 10% эмбриональной сывороткой крупного рогатого скота FBS (Sigma, США). Культура клеток содержалась в СО 2 -инкубаторе при 37oC, 5% CO 2 и 80% важности. Пассирование клеток проводилось по достижению 80% конфлюэнт-ности раз в 2 дня.
Для проведения эксперимента клетки 2-х дневной культуры собирали из культурального флакона с помощью 0,25% раствора трипсина на фосфатном буфере (PBS) pH 7,4 и ресуспендиро-вали в культуральной среде (DMEM + 5% FBS) до плотности 4х105 клеток/мл. Посев клеток производили в 96-луночный планшет (Greiner-Bio-One, Германия) по 50 мкл суспензии в каждую лунку, итоговое содержание клеток в каждой лунке составляло 2х104. Клетки преинкубировали 24 ч в СО2-инкубаторе при 37оС и 5 % СО2. После 24 ч преинкубации в каждую лунку добавили по 100 мкл тестовых и контрольных растворов и инкубировали 24 ч в СО2-инкубаторе при 37оС и 5 % СО2. Для приготовления тестовых растворов использовали среду DMEM с 5% FBS, содержащую различные разведения экстрактов C. simula, а также 133 цМ вератридина (Sigma, США) в ДМСО и 0,4 мМ водного раствора уабаина (Sigma, США). Оценку жизнеспособности клеток проводили с помощью красителя МТТ (3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide; thiazolyl blue) (Sigma, США). Раствор красителя 5 мг/мл в PBS pH 7,4 стерилизовали фильтрованием через 0,22 мкм фильтр (Millipore, США) и добавили по 15 мкл в каждую лунку 96-луночного планшета. После инкубации в течение 4-х часов при 37оС и 5% СО2, образовавшиеся кристаллы формазана растворили добавлением 150 мкл изопропанола c 0,04 М HCl, и перемешиванием на шейкере PST-60HL4 (Biosan, Латвия) при 37оС и 450 rpm в течение 10 мин. Измерение поглощения растворенного красителя для каждой лунки, проводили на спектрофотометре ELx800uv (Bio-TekInstruments Inc, США) при длине волны 595 нм с референсной длинной волны 630 нм.
Определение содержания ТТХ осуществлялось при помощи высокоэффективной жидкостной хроматографии и масс-спектрометрии (ВЭЖХ-МС) на хроматографе Shimadzu-LC20 с масс-детектором LCMS-2010EV. Колонка Ascentis Express C18 (зернение 2,7 мкм, длина 15 см и диаметр 2,1 мм). Температура колонки составила 50°C, скорость потока 0,2 мл/мин, элюирование градиентное, начальная фаза - метанол:вода:1% муравьиная кислота (5:90:5) в течении первых 5 мин, далее за 5 мин следовало линейное изменение состава до 90:0:5, и промывка такой системой в течении 20 мин. Образец вводился автосэмплером в объеме 5 мкл. Масс-детектор использовался в режиме ионизации распылением в электростатическом поле (ESI), напряжение на капилляре 4.5 кВ. Регистрация ионов в режиме селективного мониторинга (SIM) положительного иона [M+H]+ с m/z 320.1. Количество ТТХ рассчитывалось по площади пика по иону 320.1 с использованием калибровочной кривой, полученной при анализе стандартных образцов ТТХ (Alomone Labs Ltd., Израиль).
Для приготовления белковых экстрактов червей C. simula предварительно промывали водой, взвешивали и механически гомогенизировали в буферном растворе в соотношении 1:5, содержащего 1,25 мл 0,5 М Трис-HCl (pH=6,8), 0,1 мл 10% ДСН, 1 мл глицерина, 0,1 мл 0,2 М Na-EDTA, 7,55 мл H 2 O. Гомогенат центрифугировали 7 мин при 14000 g, затем отделяли супернатант, прибавляли к нему на каждые 100 мкл по 1 мкл ингибитора трипсина соевых бобов, 1,5 мкл 1М PMSF в ацетоне. Для получения делипидизиро-ванного образца полученный гомогенат встряхивали с хлороформом в соотношении 1:5 в течение 15 мин.
Для проведения дот-блота предварительно смоченную в метаноле мембрану помещали на 10 мин в трансфер буфер, точечно наносили три образца (делипидизированый экстракт C. simula , стандартный экстракт C.
Simula и бычий сывороточный альбумин (БСА), растворенный в буфере для образцов для положительного контроля) и выдерживали 2 ч во влажной камере. После этого отмывали мембрану в TBST (20 мМ Трис, 0,02% твин-20,9 г/л хлорида натрия, рН=7,4) 5 раз по 5 мин, помещали в 3% раствор молока (BioRad, США) в TBST на ночь при 4оС. Затем инкубировали мембрану с раствором цитрата ТТХ в ТBST в соотношении 1:1000 в течение 2 ч, отмывали 5 раз по 5 мин в TBST. За этим следовало выдерживание мембраны в поликлональных IgG против ТТХ в разведении 1:200 в 0,5% растворе молока в TBST в течение 1,5 ч при непрерывном перемешивании. Мембрану отмывали 5 раз по 5 мин TBST. Затем вносили антитела против IgG кролика, конъюгированные с пероксидазой хрена в разведении 1:200 в 0,5% растворе молока в TBST, инкубировали 1 ч при перемешивании. Мембрану отмывали 5 раз по 5 мин TBST, после чего вносили субстрат (1 мг/мл диаминобензидин (ДАБ) в фосфат-цитратном буферном растворе, (pH=7,5), перед внесением добавляли H 2 O 2 до концентрации 0,02-0,03%), инкубировали 5 мин при встряхивании. Для остановки реакции мембрану промывали дистиллированной водой 5 раз.
Для разделения белков в нативных условиях модифицировали ДСН-ПААГ-электрофорез, используя 10% разделяющий гель с уменьшенной в 10 раз концентрацией ДСН. Для приготовления 30 мл 10% разделяющего геля смешивали 7,5 мл 40% акриаламида (содержащего 0,8% метилен-бис-акриламида), 14,08 мл H 2 O, 7,5 мл 1,5 М Трис-HCl (pH=8,8), 0,03 мл 10% ДСН, 0,15 мл 0,2 М Na-EDTA, 21 мкл TEMED, 72 мкл 2% ПСА. Полученный раствор заливали между стеклянными пластинами, после окончания полимеризации отмывали гель дистиллированной водой, заливали 4% концентрирующий гель, для приготовления 10 мл которого смешивали 1 мл 40% акриаламида, 5,88 мл H 2 O, 2,5 мл 0,5 М Трис-HCl (pH=6,8), 0,01 мл 10% ДСН, 0,1 мл 0,2 М Na-EDTA, 0,0125 мкл TEMED, 400 мкл 2% ПСА. Образцы вносили по 520мкл в каждый карман геля, погруженного в электродный буферный раствор (0,025 M Трис, 0,192 M глицин, 0,01% ДСН, pH=8,3). В отдельный карман наносили стандарты молекулярных масс на 10, 15, 20, 25, 37, 50, 75, 100, 150 и 250 кДа (BioRad, США). Электрофорез проводили при силе тока 7 мА для концентрирующего слоя, 10 мА - для разделяющего. После окончания электрофореза гель оставляли на 1,5 ч в фиксирующем растворе. Белковые зоны окрашивали нитратом серебра.
После проведения нативного электрофореза гель инкубировали в буферном растворе для переноса (25 мМ Трис, 192 мМ глицин, 0,01% ДСН, 20% метанол) 15 мин. Затем гель помещали на нитроцеллюлозную мембрану и собирали сэндвич для переноса. Перенос проводили в течение 1,5 ч при силе тока 150 мА в буферном растворе для переноса. Затем оставляли мембрану в 3% растворе молока (BioRad, США) в TBST (20 мМ Трис, 0,02% твин-20, 9 г/л хлорида натрия, рН=7,4) на ночь при 4оС. Затем мембрану разрезали на полосы согласно схеме нанесения образцов в карманы геля при нативном электрофорезе, повторяли обработку мембраны по схеме, описанной в методике проведения дот-блота.
Результаты и их обсуждения. Согласно данным японских исследователей, немертины из рода Cephalothrix являются наиболее токсичными ТТХ-содержащими животными [16]. Однако токсичность экстрактов из С. simula сильно варьируется в зависимости от условий обитания немертин и инструментальных методов оценки токсичности. Асакава с соавторами показали недостаточно четкую сезонную зависимость концентрации ТТХ и его аналогов в С. simula, которая, тем не менее, демонстрирует, что наибольшей усредненной токсичностью обладают животные, выловленные в заливе Хиросима Японского моря в конце июня и в период с конца июля по начало сентября [16]. Также было отмечено, что в 80% исследованных немертин токсичность в среднем составляла более 1000 МЕ/г, в 45% - более 2000 МЕ/г, а диапазон концентрации ТТХ и его аналогов в полученных экстрактах варьировался от 169 до 25590 МЕ/г. Интересно, что корреляции между токсичностью и массой тела животных не было установлено.
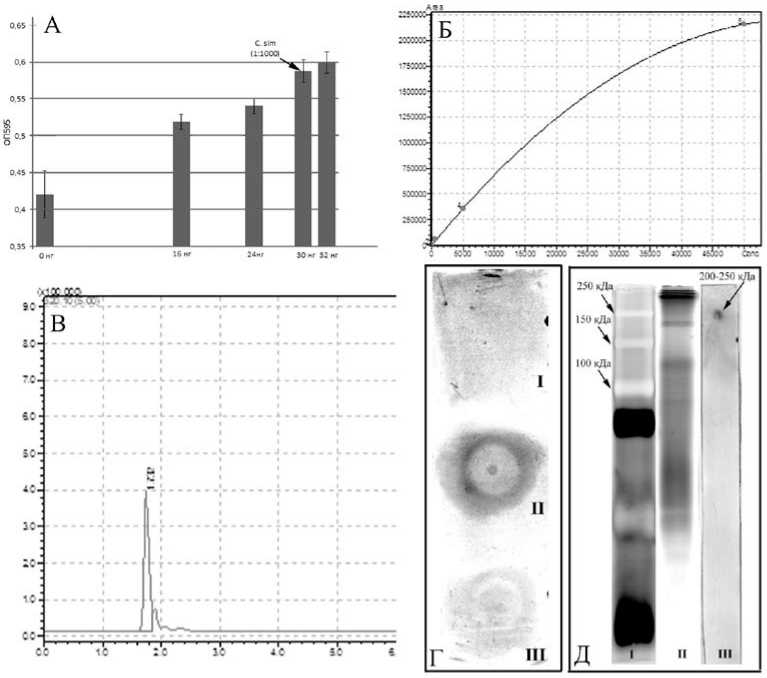
Рис. 1. Концентрация ТТХ-подобных токсинов (А, Б, В) и детекция ТТХ-положительных структур в белковых экстрактах немертины C. simula (Г, Д):
А - Биотесты на культуре мышиной нейробластомы Neuro-2a. Б - Калибровочный график для ТТХ концентрации 50нг - 50мг/мл. В - Хроматограмма экстракта C. simula по иону m/z 320.1. Г - Дот-блот: I - БСА, II - белковый препарат немертины C. Simula, III - обезлипиженный экстракт C. simula. Д - Нативный электрофорез в ПААГ с минимальным количеством ДСН белковых препаратов немертины С. simula в 10 % геле, окраска нитратом серебра: I - стандарты молекулярных масс, II - белковый препарат С. simula , 0,2 мг, III - иммуноблоттинг этого же препарата
Для идентификации ТТХ и оценки токсичности немертин C. simula, были использованы методы ВЭЖХ-МС в сочетании с биотестированием на культуре клеток нейробластомы Neuro-2. Стоит отметить, что биотесты на культуре клеток позволяют определить концентрацию не только ТТХ, но и других токсинов, блокирующих потен-циал-чувствительные натриевые каналы (ПЧНК), таких как сакситоксин, цилиндроспермин, гуанотоксины I-IV и т.д., в то время как метод ВЭЖХ-МС детектирует только те токсины, для которых имеются тестовые стандартные образцы. В ходе биоиспытаний нами было показано, что экстракты C. simula, оказывают сильнейший эффект на культуру клеток, эквивалентный 30 нг ТТХ на 1/1000 часть экстракта, что соответствует
294 мкг/г тела животных или токсичности равной 1336 МЕ/г (рис. 1А). Методом ВЭЖХ-МС был определен только ТТХ, и его концентрация составила 100 мкг/г, что соответствует токсичности равной 445 МЕ/г (рис. 1Б, 1В). Суммируя полученные данные можно сказать, что кроме самого ТТХ в экстракте C. simula встречаются и другие ПЧНК-блокирующие токсины, концентрация которых эквивалента 196 мкг/г ТТХ. Для более точной качественной оценки токсинов гуанидинового ряда в экстракте С. simula необходимо провести дополнительные ВЭЖХ-МС анализы с использованием тестовых образцов на эти токсины.
В соответствие с ранее высказанной гипотезой о наличии у немертин С. simula специальных белков, обладающих ТТХ-связывающей активностью, дот-блот иммуноанализ позволил впервые установить наличие подобных соединений в немертинах. Нами было показано, что в экстрактах C.simula , полученных в ходе первичной очистки, а также в ходе дальнейшей очистки с использованием хлороформа для удаления липидов, присутствуют соединения, предположительно, белковой природы, обладающие способностью связывать ТТХ (рис. 1Г). Примечательно, что при использовании хлороформа для удаления липидов из экстрактов ТТХ-связыва-ющая активность этих соединений заметно снижается, возможно, вследствие взаимодействия соединений с органическим растворителем. Известно, что характер связывания с токсином у ТТХ-связывающих белков достаточно вариабелен и во многом зависит от условий экстракции белков. Матсуи с соавторами [13] показали, что белок из Takifugu niphobles теряет способность связывать ТТХ при добавлении даже небольших количеств уксусной кислоты до 0,05% и восстанавливает ее при нейтрализации. Йотсу-Ймашита с коллегами [17] выяснили, что связывание белка PSTBP из T. pardalis с [H]3STX — радиоактивно меченным структурным гомологом ТТХ - ингибируется на 20, 20, 60 и 80% в присутствии 10 мМ MgCl2, CaCl2, L-аргинина и креатина, соответственно. Нагашима с соавторами [18] продемонстрировали заметное ингибирующее влияние ряда детергентов, среди которых 1% додецилсульфат натрия, 1% дитеотрие-тол, 8М мочевина и 6М гуанидин гидрохлорид, на связывание ТТХ с белком из краба Hemigrapsus sanguineus .
Для подтверждения белковой природы обнаруженных веществ и для определения их молярной массы был использован метод нативного белкового электрофореза в полиакриламидном геле с минимальным количеством додецилсульфата натрия. Нами было показано, что ТТХ-связывающие белки из червя C. simula , которые являются первыми токсин-связывающими белками, обнаруженными в немертинах, обладают массой около 200-220 кДа (рис. 1Д).
Отсутствие каких-либо структурных данных о белках из С. simula не позволяет сравнить их с известными ТТХ-связывающими белками, однако данные о молекулярной массе дают возможность соотнести их с массой ранее исследованных соединений. Так, Матсуи с соавторами [13] впервые обнаружили в плазме крови T. niphobles ТТХ-связывающий белок, который обладает наименьшей массой среди остальных впоследствии выделенных белков -116 кДа по данным ДСН-ПААГ-электрофореза и 91 кДа по данным масс-спектрометрии. Позже из плазмы крови T. pardalis Йотсу-Ймашита с коллегами [17] выделили димерный белок PSTBP, образованный двумя нековалентно связанными мономерами массой 104 кДа. Мономеры PSTBP представляют собой кислые гликопротеины (pI=5,0), которые состоят из белковой части массой 42 кДа и N-гли-кана массой 62 кДа. Гомологи PSTBP, обнаруженные у других видов фугу, отличаются, в основном, по составу и размеру N-гликана. В зависимости от вида животного молекулярные массы гомологов PSTBP варьируют в пределах от 105 кДа до 140 кДа. ТТХ-связывающие белки, выделенные из морских беспозвоночных, отличаются бóльшими молекулярными массами, чем белки, выделенные из рыб фугу. Нагашима с соавторами [18] впервые обнаружили в гемолимфе краба H. sanguineus ТТХ-связывающий белок массой около 400 кДа. Белок представляет собой кислый гликопротеин (pI=3,5), состоящий, как минимум, из субъединиц двух типов - массой 72 кДа и 82 кДа. Из токсичных брюхоногих моллюсков Natica lineata Хванг с коллегами [19] выделили самый большой из известных ТТХ-связывающих белков массой около 400 кДа, состоящий из субъединиц двух типов - 272 кДа и 47 кДа, соответственно. Таким образом, установленная молекулярная масса белков из C. simula находится в диапазоне от 105 кДа у рыб T. niphobles до 400 кДа у морских беспозвоночных H. sanguineus и N. lineata .
Выводы: немертины C. simula содержат белки с молекулярной массой 200-220 кДа, обладающие ТТХ-связывающией активностью, и могут являться перспективным объектом для поиска природных антидотов против ТТХ и токсинов гуанидинового ряда.
Исследование выполнено при поддержке ДВФУ, проект №14-08-06-19_и. и программы фундаментальных научных исследований «Дальний Восток» №15-1-3-036.
Список литературы Исследование белков, связывающих токсины гуанидинового ряда в морском черве Cephalothrix simula: поиск потенциальных антидотов морских токсинов
- Bane, V. Tetrodotoxin: Chemistry, Toxicity, Source, Distribution and Detection/V. Bane, M. Lehane, M. Dikshit et al.//Toxins. 2014. V. 6. P. 693-755.
- Chulanetra, M. Toxic marine pufferfish in Thailand Seas and tetrodotoxin they contained/M. Chulanetra, N. Sookrung, P. Srimanote et al.//Toxins. 2011. V. 3. P. 1249-1262.
- Sugita, H. Identification of a Tetrodotoxin producing Bacterium Isolated from the Xanthid Crab Atergatis floridus/H. Sugita, R. Ueda, T. Noguchi et al.//Nippon Suisan Gakkaishi. 1987. V. 53. № 5. P. 1693.
- Noguchi, T. TTX accumulation in pufferfish-Review/T. Noguchi, O. Arakawa, T. Takatani//Comp. Biochem. Physiol. D 2006. V. 1. P. 145-152.
- Chew, S. Anticholinesterase drugs in the treatment of tetrodotoxin poisoning/S. Chew, L. Chew, K. Wang et al.//Lancet. 1984. V. 2(8394). P. 108.
- Xu, Q. Toxin-neutralizing effect and activity-quality relationship for mice tetrodotoxin-specific polyclonal antibodies/Q. Xu, C. Wei, K. Huang, K. Rong//Toxicology. 2005. V. 206(3). P. 439-448.
- Noguchi, T. Tetrodotoxin-distribution and accumulation in aquatic organisms, and cases of human intoxication/T. Noguchi, O. Arakawa//Mar. Drugs. 2008. V. 6. № 2. P. 220-242.
- Noguchi, T. Puffer poisoning: Epidemiology and treatment/T. Noguchi, J.S.M. Ebesu//Toxin Rev. 2001. V. 20. P. 1-10.
- Arakawa, A. Toxins of Pufferfish that Cause Human Intoxications. In Coastal Environmental and Ecosystem Issues of the East China Sea/A. Arakawa, D.-F. Hwang, S. Taniyama et al.//Terrapub and Nagasaki University: Tokyo, Japan, 2010. P. 227-244.
- Kaneko, Y. TTX resistivity of Na/channel in newt retinal neuron/Y. Kaneko, G. Matsumoto, Y. Hanyu//Biochem. Biophys. Res. Commun. 1997. V. 240. P. 651-656.
- Maruta, S. Two critical residues in p-loop regions of pufferfish Na+ channels on TTX sensitivity/S. Maruta, K. Yamaoka, M. Yotsu-Yamashita//Toxicon 2008. V. 51. P. 381-387.
- Hwang, P.-A. Tetrodotoxin-binding proteins isolated from five species of toxic gastropods/P.-A. Hwang, Y.-H. Tsai, H.-P. Lin, D.-F. Hwang//Food Chem. 2007. V. 103. P. 1153-1158.
- Matsui, T. Purification and some properties of a tetrodotoxin binding protein from the blood plasma of kusafugu, Takifugu niphobles/T. Matsui, K. Yamamori, K. Furukawa, M. Kono//Toxicon. 2000. V. 38. P. 463-468.
- Yotsu-Yamashita, M. Purification, characterization, and cDNA cloning of a novel soluble saxitoxin and tetrodotoxin binding protein from plasma of the puffer fish, Fugu pardalis/M. Yotsu-Yamashita, A. Sugimoto, T. Terakawa et al.//Eur. J. Biochem. 2001. V. 268. P. 5937-5946.
- Magarlamov, T.Yu. Distribution of tetrodotoxin in the ribbon worm Lineus alborostratus (Takakura, 1898) (nemertea): Immunoelectron and immunofluores-cence studies/T.Yu. Magarlamov, O.A. Shokur, A.V. Chernyshev//Toxicon. 2016. V. 112. P. 29-34.
- Asakawa, M. Highly toxic ribbon worm Cephalothrix simula containing tetrodotoxin in Hiroshima Bay, Hiroshima Prefecture, Japan/M. Asakawa, K. Ito, H. Kajihara//Toxins (Basel). 2013. V. 5(2). P. 376-395.
- Yotsu-Yamashita, M. Localization of pufferfish saxitoxin and tetrodotoxin binding protein (PSTBP) in the tissues of the pufferfish, Takifugu pardalis, analyzed by immunohistochemical staining/M. Yotsu-Yamashita, N. Okoshi, K. Watanabe et al.//Toxicon. 2013. V. 72. P. 23-28.
- Nagashima, Y. A tetrodotoxin-binding protein in the hemolymph of shore crab Hemigrapsus sanguineus: purification and properties/Y. Nagashima, K. Yamamoto, K. Shimakura, K. Shiomi//Toxicon. 2002. V. 40(6). P. 753-760.
- Zhu, S. High-pressure destruction kinetics of Clostridium sporogenes spores in ground beef at elevated temperatures/S. Zhu, F. Naima, M. Marcotte//International Journal of Food Microbiology. 2008. V. 126. Р. 86-92.


