Исследование биопленок микобактерий при воздействии йодсодержащего препарата
Автор: Ленченко Е.М., Ху Бинхун, Удавлиев Д.И., Ватников Ю.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 3, 2018 года.
Бесплатный доступ
В статье представлены данные по изучению мор-фологических и денситометрических особенностей формирования микобактериями биопленок до и после воздействия йодсодержащего препарата «Йодлукман». В опытах использовали культуры микроорганизмов Mycobacterium B5, которые культивировали на среде Левенштейна-Йенсена при 37 ºС. Формирование био-пленок микобактерий исследовали до и после воздейст-вия препарата «Йодлукман». Оптическую плотность жидкости определяли в фотометрическом анализато-ре. В лунки вносили по 200 мкл культур микроорганиз-мов и культивировали 24 ч при 37 0С. В каждую лунку вносили по 200 мкл 0,1 %-го раствора кристаллвиоле-та. Через 20 мин лунки трижды промывали буферным раствором, подсушивали и фиксировали в течение 30 мин 200 мкл 95° этилового спирта. Для изучения этапов формирования биопленок применяли способ культивирования бактерий в МПБ. Для контроля роста и развития бактерий использовали окраску 1,0 %-м вод- ным раствором метиленового синего. Наряду с обще- принятым методом применяли фиксацию парами 25,0 %-го раствора глутарового альдегида в течение 3-5 ч, контрастирование препаратов проводили парами 2,0-4,0 %-го водного раствора осмиевой кислоты (OsO4) в течение 2-3 мин. При исследовании биопленок микобактерий выявляли этапы: седиментация; фикса-ция; коаггрегация, рост микроколоний; формирование кластеров и архитектоники биопленки; дисперсия. Воз-действие препарата «Йодлукман» в концентрации 2,5 %, при расходе рабочего раствора 250 мл/м² и экспо-зиции не менее 3 ч полностью обеззараживало поверх-ности тест-объектов, которые были эксперименталь- но контаминированы микобактериями. Происходило разрушение межклеточного матрикса, целостность клеток, находившихся под биопленкой, нарушалась, что сопровождалось увеличением светопреломления и сни-жением оптической плотности. Для обеззараживания поверхностей тест-объектов, контаминированных микобактериями, установлена эффективность дезин-фицирующего препарата «Йодлукман», представляю-щего собой комплекс йода кристаллического и полимер-ного поверхностно-активного компонента.
Препарат "йодлукман", адгезия, микобактерии, матрикс, биопленки, сканирующая электронная микроскопия, оптическая микроскопия
Короткий адрес: https://sciup.org/140224415
IDR: 140224415 | УДК: 579.8
Текст научной статьи Исследование биопленок микобактерий при воздействии йодсодержащего препарата
Введение . В структуре инфекционной патологии значительную долю составляют хронически протекающие заболевания, в том числе широко распространенные во всем мире микобактериозы, социальную и экономическую значимость которых трудно переоценить [9]. Применение композиционных препаратов, в том числе йодсодержащих, позволяет уменьшить вредное и агрессивное воздействие активнодействующего вещества (АДВ) на обрабатываемую поверхность за счет снижения концентрации йода в рабочих растворах препарата, как правило, обеспечивающего основной эффект обеззараживания [4, 5]. Для расширения ассортимента дезинфицирующих средств во избежание появления резистентных форм микроорганизмов необходима ротация применяемых бактериальных препаратов, поэтому приоритетным направлением научных изысканий является исследование взаимосвязи процессов формирования биопленок, гетерогенной структуры популяции бактерий при воздействии эффективных дезинфицирующих препаратов для снижения временных и экономических затрат.
Цель исследования : изучение структурнофункциональных особенностей формирования микобактериями биопленок до и после воздействия йодсодержащего препарата.
Материалы и методы исследования . В опытах использовали паспортизированные тест-культуры микроорганизмов Mycobacterium B5 № 12 – штамм для контроля качества дезинфекции относится к IV группе патогенности. Микроорганизмы культивировали на среде Левен-штейна-Йенсена при 37 ºС, фенотипические признаки бактерий определяли общепринятыми методами.
В опытах использовали препарат «Йодлукман», общая концентрация входящего в состав композиции йода составляет 13,5 %, препарат используется как 100 %, так как на протяжении 5 лет хранения не теряет своей активности, а концентрация йода остается неизменной [4, 5].
Исследования устойчивости микроорганизмов к дезинфицирующим препаратам проводили в соответствии с методическими указаниями «О порядке испытания новых дезинфицирующих средств для ветеринарной практики» (М., 1987), «Проведение дезинфекции и дезинвазии объектов государственного ветеринарного надзора» (М., 2002).
Оптическую плотность (D) жидкости определяли в фотометрическом анализаторе « Immunochem-2100 HTI » (США) при длине волны 490 нм. В лунки вносили по 200 мкл культур микроорганизмов, выращенных в мясопептонном бульоне с 1,0 % глюкозы и разведенных 1 : 100, и культивировали 24 ч при 37 °С. Из лунок удаляли жидкость, трижды промывали их фосфатносолевым раствором (рН 7,2), подсушивали и 60 мин фиксировали при 60 °С. В каждую лунку вносили по 200 мкл 0,1 %-го раствора кристаллвиолета. Через 20 мин лунки трижды промывали буферным раствором, подсушивали и фиксировали в течение 30 мин 200 мкл 95° этилового спирта [10].
Для изучения этапов формирования биопленок применяли способ культивирования бактерий в МПБ. Для этого 5,0 мл взвеси 18-часовых культур микроорганизмов Mycobacterium B5 (концентрация 105 КОЕ/мл), шейкирова-ли на аппарате «Vortex» и вносили в чашки Петри с 20 мл МПБ, на дно которых помещали обезжиренные покровные стекла. Образцы культивировали при 37 ºС и экспозиции 6, 18, 24, 36, 48, 72, 96, 120 ч. Для контроля роста и развития бактерий использовали окраску 1,0 % водным раствором метиленового синего; фиксацию парами 25,0 %-го (по ДВ) раствора глутарового альдегида в течение 3–5 ч, контрастирование препаратов проводили парами 2,0–4,0%-го водного раствора осмиевой кислоты (OsO4) в течение 2–3 мин [4].
Для получения репрезентативной информации исследование проводили методом случайного отбора полей зрения оптического микроскопа «H604 Trinocular» (Unico, США), стереоскопического микроскопа «МС-1 Стерео» (Биомед, Россия), настольного сканирующего электронного микроскопа «TM 3030 plus» (Holland).
Данные экспериментов обрабатывали методом статистического анализа с использованием критерия достоверности Стьюдента, считая различия достоверными при р ≤ 0,05.
Результаты исследования . При исследовании биопленок выявляли седиментацию; фиксацию; коаггрегацию (монослой, межклеточных связей); рост микроколоний; формирование кластеров и архитектоники биопленки; дисперсию.
На начальном этапе (6–8 ч культивирования) наблюдали седиментацию и адгезию вегетативных форм бактерий к исследуемой поверхности. Причем выявляли как отдельно расположенные бактерии, так и несколько бактериальных клеток, объединенных матриксом в цепочки.
Через 18–24 ч культивирования формировался межклеточный матрикс, через 24–36 ч – уплотненные участки в виде диффузного слоя на поверхности покровного стекла.
При культивировании в течение 48–120 ч были выявлены плотно упакованные и объединенные межклеточным матриксом бактерии, прикрепившиеся к поверхности и образующие микроколонии различного размера, состоявшие из закрытых межклеточным матриксом бактериальных клеток. В биопленках выявлялся плотный слой диффузного вещества, на периферии микроколоний выявлялись палочковидной формы бактерии (рис.).
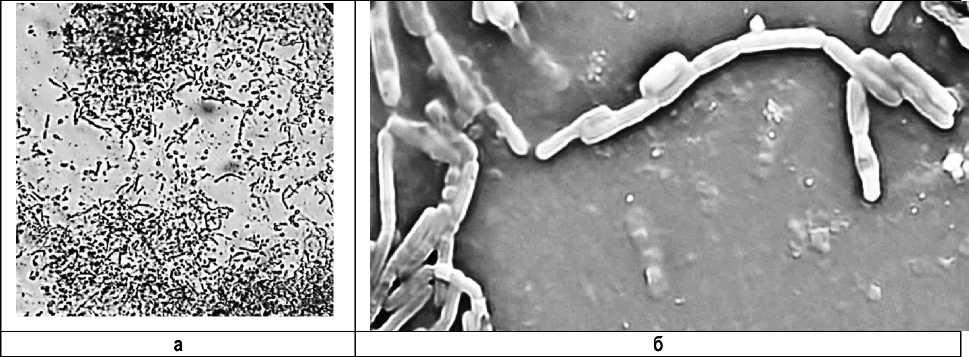
Особенности формирования биопленок штамма Mycobacterium B5: а – оптическая микроскопия. Ок. 10, об. 40; б – сканирующая электронная микроскопия, ×7000
Микроколонии постепенно становились крупными, выявлялись окрашенные плотные участки, разделенные матричными пустотами, в дальнейшем наблюдали формирование кластеров, вдоль которых проходили содержащие жидкость округлые каналы.
Через 72–96 ч культивирования микроорганизмов клетки, способные прикрепляться к поверхности, откреплялись от края микроколоний и образовывали новые колонии.
Во многих участках происходило разрушение межклеточного матрикса, целостность клеток, находившихся под биопленкой, нарушалась, что сопровождалось увеличением светопреломления и снижением оптической плотности.
Способ подготовки препаратов микробактерий в мо-нослойной культуре микроорганизмов и окраска клеток парами осмиевой кислоты позволяет прижизненно изучать морфологию клеток в процессе формирования микроколоний, сохраняя естественную архитектонику бипо-ленок.
Результаты бактериологических исследований показывают, что препарат «Йодлукман» в концентрации 2,5 %, при расходе рабочего раствора 250 мл/м² и экспозиции не менее 3 ч полностью обеззараживает поверхности тест-объектов (дерево, металл, бетон, кирпич), которые были экспериментально контаминированы микобактериями (табл.).
Изучение эффективности препарата «Йодлукман» при контаминации микобактериями тест-объектов
|
Тест-объект |
Расход, мл/м² |
Концентрация препарата |
Экспозиция, ч |
Исследовано проб |
I |
II |
|
|
Всего |
Обеззаражено |
||||||
|
Дерево |
250 |
2,5 |
3 |
30 |
30 |
+ |
- |
|
Металл |
250 |
2,5 |
3 |
30 |
30 |
+ |
- |
|
Бетон |
250 |
2,5 |
3 |
30 |
30 |
+ |
- |
|
Кирпич |
250 |
2,5 |
3 |
30 |
30 |
+ |
- |
Примечание: (-) – обеззаражено; (+) – не обеззаражено; I – контроль; II – опыт.
При воздействии препарата происходило разрушение межклеточного матрикса, целостность клеток, находившихся под биопленкой, нарушалась, что сопровождалось увеличением светопреломления и снижением оптической плотности ( density , D). В частности, исследуемые культуры микроорганизмов Mycobacterium B5 по величине оптической плотности (D = 0,699–1,510) были отнесены к сильным продуцентам биопленок, так как оптическая плотность выше контрольной, более чем в 4 раза. После воздействия препарата «Йодлукман» культуры микроорганизмов были отнесены к слабым продуцентам биопленок, так как оптическая плотность (D ≤ 0,197) выше контрольной менее чем в 2 раза.
Результаты собственных исследований, сопоставление и анализ ранее опубликованных работ позволяют заключить, что способность микобактерий продуцировать биопленки приводит к смене фенотипических признаков популяции, переход в «некультивируемое состояние», персистенцию в организме восприимчивых видов и окружающей среде [2, 4]. При формировании биопленок происходит адгезия микобактерий, синтез экзпополисаха-ридного матрикса [7]. Биопленки микобактерий представляют собой многоклеточные сообщества микроорганизмов, способные переносить более чем в 50 раз минимальные ингибиторные концентрации противотуберкулезных препаратов, например изониазида и рифампицина [6]. Морфофункциональная стабильность биопленок способствует конкурентному выживанию в различных экологических нишах и защищает популяцию лекарственно устойчивых микобактерий [8]. Учитывая, что биопленки – превалирующая форма существования микроорганизмов, перспективным направлением комплексной терапии и профилактики инфекционной патологии является эрадикация биопленок [1]. Для предотвращения формирования биопленок перспективными признаны препараты, снижающие адгезию бактериальных клеток и содержащие биоциды, проникающие в матрикс [1, 7, 10].
Заключение. При изыскании антибактериальных препаратов следует учитывать, что составной частью жизненного цикла бактерий является формирование биопленок, образованных клетками и внеклеточным матриксом. Для обеззараживания поверхностей тест-объектов, контаминированных микобактериями, установлена эффективность дезинфицирующего препарата «Йодлук-ман», представляющего собой комплекс йода кристаллического и полимерного поверхностно-активного компонента.
Список литературы Исследование биопленок микобактерий при воздействии йодсодержащего препарата
- Голуб А.В. Бактериальные биопленки -новая цель терапии?//Клин. микробиол. и антимикроб. химиотер. -2012. -Т. 14, № 1. -С. 23-28.
- Ленченко Е.М., Бинхун Ху, Ломова Ю.В. Исследова-ние антагонистических свойств и чувствительности микроорганизмов к антибактериальным препаратам//Аграрная наука. -2017. -№ 6. -С. 17-23.
- Ленченко Е.М., Антонова А.Н. Исследование биопленок и фенотипических признаков бактерий//Ветеринария. -2017. -№ 5. -С. 31-35.
- Павлова И.Б., Ленченко Е.М. Изучение морфологии популяции микобактерий методами оптической и электронной микроскопии//Проблемы ветеринар-ной санитарии, гигиены и экологии. -2017. -№ 4 (24). -С. 76-82.
- Попов Н.И., Удавлиев Д.И., Шутеева Е.Н. Изучение эффективности препарата йодез в композиции с со-временными инсектоакарицидными препаратами для одновременной дезинфекции и дезакаризации свиноводческих помещений//Проблемы ветеринарной санитарии, гигиены и экологии. -2013. -№ 1 (9). -С. 23-25.
- Kulka K., Hatfull G., Ojha A.K. Growth of Mycobacte-rium tuberculosis biofilms//Journal of visualized exper-iments. -2012. -№ 60. -P. 3807-3820.
- Kumar T.S., Kumar V., ShoorVir S. et al. Chemical and Ultrastructural Characteristics of Mycobacterial Biofilms//Asian Journal of Animal and Veterinary Advances. -2015. -Vol. 10. -p. 592-622.
- Ojha A.K., William R., Jacobs J.R. et al. Genetic dissec-tion of Mycobacterial Bioflms//Mycobacteria Protocols. -2015. -V. 1285. -P. 215-226.
- World Health Organization: Library Cataloguing-in-Publication Data Global tuberculosis report 2016. WHO I. ISBN 978 92 4 156539 4 (NLM classification: WF 300) Ending TB by 2030 www.who.int/tb/data.
- Wolber J.M., Urbanek B.L., Meints L.M. et al. The tre-halose-specific transporter LpqY-SugABC is required for antimicrobial and anti-biofilmactivity of trehalose analogues in Mycobacterium smegmatis//Carbohydr Res. -2017. -V. 450. -P. 60-65.


