Исследование биосовместимости желатинов А и В после стерилизации различными способами
Автор: Ким И.И., Суровцева М.А., Журавлева И.Ю., Бондаренко Н.А., Чепелева Е.В., Зайцева И.В., Зайцева Ю.В., Суровцев Н.В., Повещенко О.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 1 т.29, 2025 года.
Бесплатный доступ
Актуальность. Надежная стерилизация гидрогелей на основе желатина имеет решающее значение для клинического применения многих функциональных конструкций биопроизводства для кардиохирургии. Однако методы стерилизации могут оказывать нежелательное воздействие на свойства гидро¬гелей природного происхождения, которые используются как герметики сосудов, биочернила в 3D-биопечати, скаффолды в тканевой инженерии. Цель. Изучить влияние различных способов стерилизации на биосовместимость и структурную организацию желатинов А и В. Методы. Желатины А и В стерилизовали ультрафиолетовым облучением, автоклавированием и этиленоксидом. После стерилизации оценивали цитотоксичность желатиновых гидро¬гелей; пролиферацию и адгезию эндотелиальных клеток линии EA.hy926, уровень экспрессии молекул адгезии на клетках. Для оценки структуры гидрогелей использовали комбинационное рассеяние света и спектроскопию инфракрасного поглощения; процесс денатурации желатинов изучали методом дифференциальной сканирующей калориметрии. Результаты. Исследуемые способы стерилизации не вызывали цитотоксического эффекта желатинов А и В. Стерилизация желатина В1 ультрафиолетовым облучением и этиленоксидом снижала уровень пролиферации клеток линии EA.hy926 через 168 ч культивирования. Все виды стерилизации, за исключением ультрафиолетового облучения желатинов А1 и В1, уменьшали адгезию эндотелиальных клеток на ранних сроках по сравнению с контролем. Увеличение количества адгезированных клеток на всех желатинах по сравнению с контролем через 168 ч культивирования было обусловлено повышением уровня экспрессии молекул адгезии на эндотелиальных клетках. Исследуемые виды стерилизации не вызывали существенных химических изменений молекул желатина А и В. Однако стерилизация автоклавированием снижала температуру перехода денатурации в желатинах всех видов. Заключение. Стерилизация ультрафиолетовым облучением и этиленоксидом существенно не влияет на химическую структуру и биосовместимость желатина А1, но сопровождается снижением биосовместимости других стерилизованных видов желатинов. Стерилизация желатинов А и В автоклавированием сопровождается изменением конформационного состояния образцов.
Автоклавирование, биосовместимость, желатин, стерилизация, ультрафиолетовое облучение, этиленоксид
Короткий адрес: https://sciup.org/142244001
IDR: 142244001 | DOI: 10.21688/1681-3472-2025-1-75-88
Текст научной статьи Исследование биосовместимости желатинов А и В после стерилизации различными способами
Цитировать: Ким И.И., Суровцева М.А., Журавлева И.Ю., Бондаренко Н.А., Чепелева Е.В., Зайцева И.В., Зайцева Ю.В., Суровцев Н.В., Повещенко О.В. Исследование биосовместимости желатинов А и В после стерилизации различными способами. Патология кровообращения и кардиохирургия. 2025;29(1):75-88. https://doi. org/10.21688/1681-3472-2025-1-75-88
How to cite: Kim I.I., Surovtseva M.A., Zhuravleva I.Yu., Bondarenko N.A., Chepeleva E.V., Zaytseva I.V., Zaytseva Yu.V., Surovtsev N.V., Poveshchenko O.V. Biocompatibility of gelatins A and B after sterilization by different methods. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2025;29(1):75-88. (In Russ.) https://doi.
I.I. Kim,
M.A. Surovtseva, https://orcid.
I.Yu. Zhuravleva, https://orcid.
N.A. Bondarenko, https://orcid.
E.V. Chepeleva,
I.V. Zaytseva,
Yu.V. Zaytseva,
N.V. Surovtsev, O.V. Poveshchenko, https://orcid.
Желатин представляет собой частично гидролизованный белок коллаген. Его часто используют в качестве биочернил при 3D-биопечати как заменитель экстрацеллюлярного матрикса для клеток [1; 2]. Вещество растворимо в физиологических условиях. Ковалентное сшивание желатина позволяет стабилизировать его в течение длительного срока инкубации при физиологических температурах и получать прозрачные гидрогели с высоким потенциалом объединения биомиметических моделей «органов-на-чипе». Благодаря способности желатина образовывать маловязкие гидрогели его также применяют как герметик тканых и трикотажных протезов крупных сосудов [3; 4]. Герметизация желатином тканых гофрированных сосудистых протезов создает равномерное тонкое покрытие, обеспечивающее нулевую водопроницаемость изделия [5].
По способу получения различают желатины А и В. Первый получают из свиной кожи путем кислотного гидролиза, второй — из бычьей кожи или костей путем щелочного гидролиза [6]. Виды различаются изоэлектрической точкой, которая для желатина А составляет около 9,0, для желатина B — 5,0, а также радиусом, вязкостью, линейным вязкоупругим диапазоном, степенью набухания, гидродинамическими и другими свойствами [6; 7]. Желатин А легче сорбирует и десорбирует биологически активные молекулы, поэтому его чаще используют для индукции неоангиогенеза [8], желатин В предпочтителен в биопечати [9].
Эффективность стерилизации имеет решающее значение для минимизации микроорганизмов и их спор в биочернилах и на поверхностях имплантатов, использующихся в кардиохирургии. Однако требования к стерилизации материалов для биопечати и имплантатов различаются. Медицинские устройства или каркасы из биоматериала обычно стерилизуют на конечной стадии, непосредственно перед имплантацией или упаковкой, в то время как биочернила для печати живыми клетками необходимо стерилизовать гораздо раньше, по крайней мере до инкапсуляции клеток. Техники стерилизации протезов, герметизированных желатином, могут различаться, но требования, предъявляемые к ним, предполагают, что после стерилизации покрытие изделия должно оставаться эластичным, однородным по толщине, прочно сцепляться с поверхностью, не отслаиваться при хранении и интраоперационных манипуляциях, не изменять ригидность тканых и трикотажных протезов. С учетом того, что 95 % протезов, используемых при замене аорты, являются ткаными или трикотажными и проходят герметизацию в том числе желатином, подбор оптимального метода стерилизации протезов, герметизированных желатином, внесет существенный вклад в создание протезов с био-совместимыми свойствами для кардиохирургии.
Наиболее часто для стерилизации желатина используют ультрафиолетовое (УФ) облучение [10], автоклавирование [11–13], кратковременное (в течение 4–10 с) [14] и многократное нагревание [15]. Самыми эффективными методами стерилизации желатиновых растворов являются их прогрев при температуре 130–140 °С, стерилизация с помощью фильтра [12; 16]; реже используют газ этиленоксид [12; 13] и гамма-облучение [13]. Стерилизация может влиять на печатные и механические свойства желатина, его реологию и биосовместимость, приводить к деградации и/или разложению материалов, поскольку гидрогели чувствительны к обычным стерилизующим агентам, таким как тепло и радиация. Критические характеристики биочернил, помимо реологических и механических свойств, включают биосовместимость, наличие мест клеточной адгезии и разлагаемость. Поскольку биочернила также предназначены для формирования «биокаркасов» для инкапсуляции клеток в 3D-моделях, необходимо, чтобы они были структурно стабильными и сохраняли форму после стерилизации. Потенциально каждый из подходов к стерилизации может изменить стерилизуемый биоматериал. Таким образом, существует необходимость определить вид стерилизации, который сводит к минимуму ухудшение биосовместимости гидрогелей, сохраняя их стерильность.
Цель работы — изучить влияние различных способов стерилизации на биосовместимость и структурную организацию желатинов А и В.
Методы
Объекты исследования — желатины А и В — стерилизовали УФ-облучением, автоклавированием и этиленоксидом. Использовали реактивы: 4% раствор гелофузина для внутривенного введе- ния (B.Braun Medical, Земпах, Швейцария), желатин типа А1 из свиной кожи (No. G2500, Sigma Aldrich, Сент-Луис, США), желатин типа В1 из бычьей кожи (No. G9391, Sigma Aldrich, Сент-Луис, США), желатин типа А2 из свиной кожи (X-Pure 10P, Rousselot BV, Гент, Бельгия), желатин типа В2 из бычьей кости (X-Pure 10B, Rousselot BV, Гент, Бельгия).
Приготовление желатиновых растворов
При стерилизации этиленоксидом желатины сначала стерилизовали в сухом виде, потом готовили растворы. На первом этапе готовили 8% раствор желатина добавлением дистиллированной воды. Раствор тщательно перемешивали при температуре 24–26 °C в течение 10–15 мин, затем выдерживали в течение 24 ч при температуре 37 °C для набухания геля. Далее добавляли 4% гелофузин для получения 6% раствора желатина.
Стерилизация желатина
УФ-облучение. Перед стерилизацией лунки 6-лу-ночных планшетов обрабатывали растворами желатина в течение 30 мин при комнатной температуре. Затем обработанные планшеты выдерживали с открытой крышкой в течение 30 мин в ламинарном боксе под УФ-лампой (30 Вт, длина волны 253,7 нм, плотность мощности УФ-С потока — 1,2 мВт/см2).
Стерилизация в автоклаве. Растворы желатина стерилизовали при температуре 121 °C, давлении 1,1 атм в течение 45 мин в автоклаве BES-12L-B-LED (Youjoy, Нинбо, Китай).
Газообразный этиленоксид . Стерилизацию сухих желатинов этиленоксидом проводили в газовом стерилизаторе/аэраторе Steri-Vac 5XL (3M Company, Сент-Пол, США). Концентрация этиленоксида составляет 750 мг/л, температура в камере — 37 °C, влажность — 70 %, время стерилизации — 3 ч. Аэрацию проводили при температуре стерилизации не менее 8 ч.
Культивирование клеток
Клетки EA.hy926 культивировали в среде DMEM/F12 (Gibco, Thermo Fisher Scientific, Уолтем, США) с добавлением 10% фетальной телячьей сыворотки (HyClone, Cytiva, Мальборо, США), 2 мМ L-глютамина (ICN Biomedicals, Коста-Меса, США) и 40 мкг/мл сульфата гентамицина (ОАО «Дальхим-фарм», Хабаровск, Россия) во влажной атмосфере с 5 об. % CO2 при температуре 37 °C до образования плотного монослоя. Клетки культивировали в культуральных флаконах, питательную среду меняли каждые 3–4 дня и снимали с помощью раство- ра Трипсина-Версена (ООО «БиолоТ», Санкт-Петербург, Россия).
Тест цитотоксичности
Дно лунок 96-луночных планшетов обрабатывали растворами стерилизованных желатинов в течение 30 мин при комнатной температуре. Далее в обработанные планшеты высевали клетки EA.hy926 из расчета 1 × 104 клеток на лунку и инкубировали в течение 3 сут. Жизнеспособность клеток определяли с помощью реактива МТТ (3-(4,5-диметил-тиазол-2-ил)-2,5-дифенил-2Н-тетразолия бромид) (Sigma-Aldrich, Тауфкирхен, Германия) в соответствии с инструкциями производителя. Кристаллы фор-мазана растворяли в 150 мкл диметилсульфоксида (PanReac AppliChem, Дармштадт, Германия). Оптическую плотность растворенных кристаллов форма-зана измеряли при длине волны 492 нм спектрофотометром Stat Fax-2100 (Awareness Technology Inc., Палм-Сити, США). В качестве контрольной группы использовали клетки, культивируемые в среде DMEM/F12 без покрытия желатином.
Пролиферация эндотелиальных клеток
Пролиферацию клеток EA.hy926 оценивали с помощью МТТ-теста на спектрофотометре Stat Fax-2100 через 72 и 168 ч культивирования. Предварительно плоскодонные 96-луночные планшеты обрабатывали растворами желатина А и В, стерилизованными разными методами. Контролем служили клетки, культивируемые на культуральном пластике, не обработанном желатином.
Адгезия и жизнеспособность эндотелиальных клеток
В 96-луночный планшет, покрытый растворами стерилизованных желатинов, высевали 1 × 104 клеток EA.hy926 на лунку и инкубировали в течение 2, 24, 72 и 168 ч. Адгезию и жизнеспособность клеток определяли путем окрашивания флуоресцентными красителями: акридиновым оранжевым (ООО «Диаэм», Москва, Россия; 100 мкг·мл-1) и бромистого этидия (ООО «Медиген», Новосибирск, Россия; 100 мкг·мл-1). Клетки визуализировали с помощью микроскопа Axio Observer (Zeiss, Оберкохен, Германия). Живые клетки имели зеленое окрашивание, апоптотиче-ские — оранжевое, некротические — красное. Плотность адгезии клеток подсчитывали, используя программное обеспечение ImageJ (National Institutes of Health, Бетесда, США). Контролем служили клетки, культивируемые на культуральном пластике, не обработанном желатином.
Проточная цитометрия
Для оценки экспрессии поверхностных молекул использовали антитела: CD29-PE (клон MAP4), CD184-APC (клон 12G5), CD309-PE (клон 89106) (все от BD Biosciences, Франклин-Лейкс, США); CD31-FITC (клон WM59), CD54-PE (клон HA58), CD62e-PE (клон HAE18), CD144-APC (клон BV9) (все от BioLegend, Сан-Диего, США). Клетки анализировали на проточном цитометре BD FACSCanto II (BD, Biosciences, Франклин-Лейкс, США). Контролем служили клетки, культивируемые на культуральном пластике, не обработанном желатином.
Комбинационное рассеяние света
Метод спектроскопии комбинационного рассеяния света (КРС) заключается в измерении спектра света, неупруго рассеянного исследуемым материалом за счет генерации молекулярных колебаний. Так как значения частот внутримолекулярных колебаний определяются видом конкретной молекулы, по спектру КРС можно судить о составе исследуемого материала или об изменении (или неизменности) его химического состава. Измерение спектров КРС проводили с использованием однорешеточного спектрометра (Princeton Instrument, Teledyne, Трентон, США) с многоканальным детектором. Упругое рассеяние от образца вырезали в спектре рассеянного света краевым интерференционным фильтром. Основные измерения проводили с использованием лазера с длиной волны 532 нм в качестве накачки. Также осуществляли контрольные измерения с длиной волны лазера 780 нм, чтобы убедиться, что возможные эффекты из-за вклада фотолюминесценции не искажают анализируемые спектры и не влияют на выводы. Полученные спектры КРС от желатинов в диапазонах 500–1800 см-1 и CH (1500–3600 см-1) корректировали на вклад от фотолюминесценции вычитанием полинома. Кусочки исследуемых гидратированных желатинов высушивали, а спектры КРС от сухих остатков на металлической подложке измеряли в 9 различных точках, используя микрообъектив, и усредняли для анализа.
Спектроскопия инфракрасного поглощения
Метод спектроскопии инфракрасного (ИК) поглощения заключается в измерении спектра поглощения в области частот, соответствующих частотам молекулярных колебаний. Аналогично спектроскопии КРС по спектру поглощения ИК-излучения можно судить о составе исследуемого материала или об изменении (или неизменности) его химического состава. Отличием от спектроскопии КРС являются
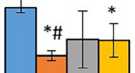
Рис. 1. Жизнеспособность эндотелиальных клеток линии EA.hy926 после культивирования на желатинах А и В, стерилизованных ультрафиолетовым облучением, автоклавированием и этиленоксидом (М ± SD)
Примечание. * — р < 0,05 по сравнению с желатином А1; # — р < 0,05 по сравнению с группой автоклавирования.
ялортнок то % ,котелк ьтсонбосопсензиЖ
о о о о о
0 8 6 4 2

0 J-------- LI ~~L
Ультрафиолет Автоклавирование Этиленоксид
□ желатин А1 □ желатин В1 □ желатин А2 □ желатин В2
другие правила отбора, нечувствительность к фотолюминесценции, но бóльшая чувствительность к другим экспериментальным проблемам. Поэтому совместное применение спектроскопии КРС и поглощения ИК-излучения позволяет более достоверно оценить изменения составов при различных режимах стерилизации. Измерение спектров поглощения ИК-излучения проводили в режиме диффузного рассеяния. Образцы гидратированных желатинов наносили на стеклянную подложку, покрытую алюминием с защитным слоем диоксида кремния. Для измерения спектров ИК-поглощения образцы высушивали при температуре, близкой к комнатной. ИК-спектры измеряли с помощью ИК-Фурье-спектрометра Vertex 80 (Bruker, Биллерика, США) при комнатной температуре. Каждый образец желатина измеряли несколько раз (в различные дни). Сравнение различных спектров с одного образца после обработки дает оценку воспроизводимости спектров поглощения. Проблемой схемы диффузного рассеяния является необходимость вычитания широкого фона, которая зависит от оптического качества конкретного образца.
Дифференциальная сканирующая калориметрия
Метод дифференциальной сканирующей калориметрии (ДСК) позволяет характеризовать температуры фазовых переходов, включая денатурацию белков и стеклование. Знание этих температур позволяет оценить, в каком температурном диапазоне материал находится в твердоподобном или жидкоподобном (вязком) состоянии. Кроме того, изменения в температурах конформационных переходов длинных молекул косвенно характеризуют изменения в конформационном состоянии при комнатной температуре. Мы использовали метод ДСК для характеристики процесса денатурации желатинов и его зависимости от способа стерилизации. Образец массой 10–20 мг запечатывали в алюминиевый тигель. Измерения кривых ДСК проводили в температурном диапазоне от 10 до 50 °С со скоростью 5 К/мин (Кельвин/мин) на нагрев и охлаждение.
Статистический анализ
Количественные данные обработаны с помощью Statistica 13.0 (StatSoft, Талса, США) и представлены в виде среднего значения и стандартного отклонения (M ± SD), а также в виде медианы и интерквартильного диапазона (Me (LQ; UQ)). Нормальность распределения данных определяли с помощью теста Шапиро – Уилка. Для сравнения двух групп использовали непараметрический U-критерий Манна – Уитни, установили уровень значимости p < 0,05.
Результаты
При изучении цитотоксичности желатинов, стерилизованных различными способами, мы руководствовались международным стандартом ISO 10993-5 определения цитотоксичности in vitro [17]. Не выявили влияния методов стерилизации на цитотоксичность желатинов А и В (рис. 1). Через 3 сут. жизнеспособность эндотелиальных клеток, культивированных на желатинах А, ранжировалась от 83 % (желатин А2, стерилизованный УФ-облучением) до 105 % (желатин А1, стерилизованный этиленоксидом), а на желатинах В — от 83,9 % (желатин В1, стерилизованный этиленоксидом) до 97 % (желатин В2, стерилизованный автоклавированием).
Уровень пролиферации клеток линии EA.hy926 через 72 и 168 ч культивирования на желатинах А2 и В2, стерилизованных УФ-облучением, автоклавированием и этиленоксидом, не отличался от значений контроля (рис. 2). Через 168 ч куль-
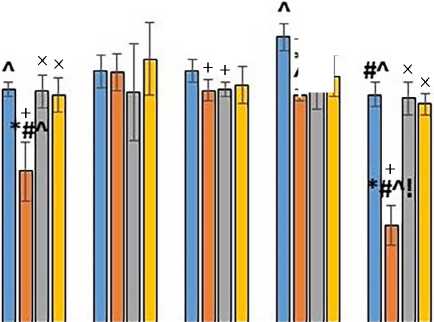
Рис. 2. Пролиферация эндотелиальных клеток линии EA.hy926, культивируемых на желатинах А и В, стерилизованных ультрафиолетовым облучением, автоклавированием и этиленоксидом (М ± SD)
Примечание. * — р < 0,05 по сравнению с группой контроля; # — р < 0,05 по сравнению с 72 ч;
^ — р < 0,05 по сравнению с группой автоклавирования;
! — р < 0,01 по сравнению с группой ультрафиолетового облучения;
+ — р < 0,05 по сравнению с желатином А1;
× — р < 0,05 по сравнению с желатином В1.
итсонтолп йоксечитпо ыциниде ,яицарефилорП
1 户^ 7 用力^乃^ j0 n^n^n^n^n^-n^n^n^n^

+
+ *
72 ч 168 ч 72 ч 168 ч 72 ч 168 ч 72 ч 168 q
тивирования эндотелиальных клеток на желатине В1, стерилизованном УФ-облучением, выявили снижение пролиферации на 42 % по сравнению с контролем (р < 0,05). Также наблюдали снижение уровня пролиферации на 16 % (р < 0,05) по сравнению с группой контроля для эндотелиальных клеток, культивированных в течение 72 ч на желатине В1, стерилизованном этиленоксидом. Дальнейшее культивирование клеток линии EA.hy926 на этом желатине в течение 168 ч сопровождалось снижением уровня пролиферации клеток на 62 % по сравнению с контролем и на 57 % по сравнению с 72 ч (р < 0,05). Кроме того, через 168 ч отметили снижение на 20 % уровня пролиферации по сравнению с 72 ч для эндотелиальных клеток, культивированных на желатине А1, стерилизованном этиленоксидом (р < 0,05).
При сравнении методов стерилизации между собой выявили, что через 72 ч наибольшая пролиферация эндотелиальных клеток была на желатине А1, стерилизованном этиленоксидом, а через 168 ч — на желатине А1, стерилизованном автоклавированием.
Эндотелиальные клетки лучше пролиферировали на желатине А1, стерилизованном УФ-облучением, по сравнению с желатином А2 (72 ч) и В1 (72 и 168 ч), автоклавированием по сравнению с желатином А2 (168 ч) и В1 (168 ч) и этиленоксидом по сравнению с желатином В2 (72 ч), В1 (72 и 168 ч) (р < 0,05).
Жизнеспособность эндотелиальных клеток на желатинах А и В, стерилизованных разными методами, не изменялась в течение всего срока культивирования (2, 24, 72 и 168 ч), оставаясь на высоком уровне. Так, количество живых клеток ранжирова- лось в пределах 92–99 % через 2 ч культивирования, 91–99 % через 24 ч, 96–99 % через 72 ч и 92–97 % через 168 ч. Апоптоз и некроз эндотелиальных клеток на всем сроке культивирования были на низком уровне (0,5–3,3 % и 0,1–5,4 % соответственно) (данные не представлены).
На ранних сроках адгезии (через 2 ч) в сравнении с контролем количество клеток линии EA.hy926 возрастало только на желатине А1, стерилизованном УФ-облучением, и не менялось на желатине В1, стерилизованном тем же способом (табл. 1). Для всех других режимов стерилизации желатинов А и В выявили снижение количества адгезированных клеток. При сравнении методов стерилизации обнаружили, что количество клеток на всех желатинах, стерилизованных УФ-облучением, было значимо выше по сравнению с другими методами стерилизации, за исключением желатина В2, стерилизованного автоклавом. Из всех желатинов наибольшее количество адгезированных эндотелиальных клеток отметили на желатине А1. Через 24 ч количество адгезированных клеток возрастало (желатин А1; В1, стерилизованный автоклавированием и этиленоксидом; желатин В2, стерилизованный автоклавированием), не менялось (желатин В1, стерилизованный УФ-облучением) или снижалось (желатин А2 и желатин В2, стерилизованный УФ-облучением и этиленоксидом). Отметим, что через 72 и 168 ч наблюдения в сравнении с 2 и 24 ч количество адгезированных клеток возрастало на всех желатинах, стерилизованных разными методами. Однако наибольшее количество эндотелиальных клеток через 72 и 168 ч выявили на
Табл. 1. Плотность адгезии эндотелиальных клеток линии EA.hy926, культивируемых на желатинах А и В, стерилизованных ультрафиолетовым облучением, автоклавированием и этиленоксидом
|
Группа |
Плотность адгезии, клеток/мм2 |
|||
|
2 часа |
24 часа |
72 часа |
168 часов |
|
|
Контроль |
94,45 ± 33,10 |
74,07 ± 20,98 |
231,00 ± 25,60 |
310,30 ± 41,89 |
|
Желатин А1 |
||||
|
Ультрафиолет |
162,49 ± 59,70* |
163,88 ± 89,27* |
281,99 ± 56,30* |
530,18 ± 111,44* |
|
Автоклавирование |
64,63 ± 12,32*# |
117,16 ± 13,88* |
306,53 ± 42,39* |
570,97 ± 59,76* |
|
Этиленоксид |
73,11 ± 27,89# |
132,69 ± 25,88* |
274,40 ± 26,74*^ |
649,59 ± 62,96*^ |
|
Желатин B1 |
||||
|
Ультрафиолет |
97,65 ± 18,14+× |
51,44 ± 24,53+× |
240,01 ± 40,00 |
310,68 ± 96,08+× |
|
Автоклавирование |
60,36 ± 13,54*#× |
115,85 ± 13,43*#× |
317,61 ± 45,86*#× |
552,12 ± 42,68*#× |
|
Этиленоксид |
48,74 ± 16,33*#^+× |
113,72 ± 20,77*#× |
287,89 ± 35,67*#× |
446,34 ± 92,94*#^+ |
|
Желатин А2 |
||||
|
Ультрафиолет |
63,09 ± 13,99*+ |
29,48 ± 15,47*+! |
224,24 ± 32,26+ |
518,80 ± 59,44*!& |
|
Автоклавирование |
20,87 ± 12,92*#+! |
70,32 ± 20,48#+!& |
224,33 ± 15,41+!& |
556,15 ± 70,18*+ |
|
Этиленоксид |
24,01 ± 7,31*#+! |
59,66 ± 13,22#+! |
197,91 ± 30,31*#^+! |
528,04 ± 78,79*+& |
|
Желатин B2 |
||||
|
Ультрафиолет |
30,52 ± 15,52*+×! |
31,54 ± 18,31*+ |
191,98 ± 44,06+! |
368,08 ± 44,32*+× |
|
Автоклавирование |
59,41 ± 9,09*#× |
113,01 ± 37,46*#× |
349,58 ± 36,89*#+× |
545,59 ± 40,63*#+! |
|
Этиленоксид |
17,40 ± 9,37*#^+×! |
53,01 ± 9,47#^+! |
228,03 ± 40,04^+! |
432,59 ± 46,47*#^+× |
Примечание. Данные представлены как М ± SD. Контролем выступали клетки, культивируемые на культуральном пластике, не обработанном желатином. * — р < 0,05 по сравнению с группой контроля; # — р < 0,05 по сравнению с группой ультрафиолетового облучения; ^ — р < 0,05 по сравнению с группой автоклавирования; + — р < 0,05 по сравнению с желатином А1; ! — р < 0,05 по сравнению с желатином В1; × — р < 0,05 по сравнению с желатином А2.
желатине А1. На желатине А2 в сравнении с контролем количество клеток EA.hy926 увеличивалось только через 168 ч культивирования.
При культивировании на желатинах А и В, стерилизованных УФ-облучением, установили увеличение относительного количества клеток EA.hy926, экспрессирующих молекулы адгезии CD31 (желатин В1), CD54 (желатин А1), CD62e (желатин В1) и CD184 (желатины В1, А2, В2), по сравнению с контролем (табл. 2). Для эндотелиальных клеток, культивированных на желатинах, стерилизованных автоклавированием, отметили как увеличение уровня экспрессии адгезионных молекул CD31 (желатины В1 и В2), CD309 и CD54 (желатины В1 и А2), CD62e (желатины А1 и В1) и CD184 (желатины А1 и В1), так и снижение экспрессии CD184 (желатины А2 и В2) по сравнению с контролем. Культивирование эндотелиальных клеток на желатинах, стерилизованных этиленоксидом, сопровождалось снижением относительного количества клеток, экспрессирующих CD31 (желатин В2) и CD184 (желатин А1), по сравнению с контролем. При сравнении методов стерилизации между собой выявили, что культивирование клеток линии EA.hy926 на желатинах, стерилизованных этиленоксидом, приводит к снижению уров- ня экспрессии адгезивных молекул на поверхности клеток (CD54, CD62е, CD184) по сравнению с УФ-облучением и автоклавированием. На уровень экспрессии CD29 на эндотелиальных клетках не влиял ни один метод стерилизации. Наибольшая экспрессия молекул адгезии была показана для желатина В1 независимо от вида стерилизации.
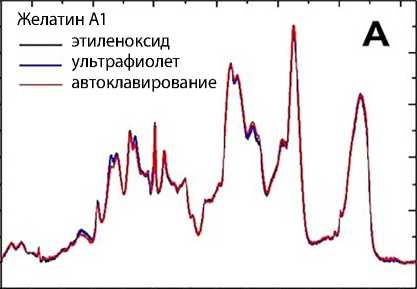
Спектры КРС, полученные от желатинов А и В, стерилизованных разными способами, были очень похожи друг на друга. На примере желатина А1 продемонстрировано полное совпадение спектров КРС для образцов, стерилизованных УФ-облучением и этиленоксидом (рис. 3, А). Для образца желатина А1, стерилизованного автоклавированием, есть небольшие изменения, которые, однако, находятся внутри возможных погрешностей эксперимента.
Спектры ИК-поглощения для желатина А1 показаны на рис. 3, В. Спектры для желатина после стерилизации разными способами не демонстрируют значимых различий, которые могли бы быть отнесены к изменению химического состава образцов. Аналогичные результаты получили и для других желатинов. Есть небольшое уменьшение вклада в области моды Amid III (1 240 см-1). Уменьшение вклада в этой области после стерилизации автоклавирова-
Табл. 2. Экспрессия адгезионных молекул эндотелиальными клетками линии EA.hy926, культивируемыми на желатинах А и В, стерилизованных ультрафиолетовым облучением, автоклавированием и этиленоксидом
|
Группа |
Уровень экспрессии адгезионных молекул, % |
|||||
|
CD29 |
CD31 |
CD309 |
CD54 |
CD62e |
CD184 |
|
|
Контроль |
97,20 (88,31; 98,82) |
16,41 (15,12; 17,82) |
0 (0; 0,05) |
21,53 (15,42; 27,72) |
0,14 (0,05; 0,14) |
0,15 (0,11; 0,15) |
|
Желатин А1 |
||||||
|
Ультрафиолет |
93,71 (85,33; 96,72) |
18,61 (17,4; 19,7) |
0,11 (0,05; 0,15) |
29,61 (24,2; 32,4)* |
0 (0; 0,15) |
0,31 (0,15; 0,81) |
|
Автоклавирование |
98,21 (88,32; 99,22) |
26,51 (21,21; 31,72) |
0,15 (0,05; 0,15) |
26,42 (21,12; 30,14) |
0,15 (0,11; 0,71)*# |
0,45 (0,31; 0,51)* |
|
Этиленоксид |
96,42 (87,71; 98,23) |
20,11 (17,92; 22,23) |
0 (0; 0,05) |
27,72 (18,51; 30,12) |
0 (0; 0,11)^ |
0 (0; 0)*#^! |
|
Желатин В1 |
||||||
|
Ультрафиолет |
97,03 (89,91; 98,32) |
21,54 (20,61; 22,33)*^ |
0,11 (0,05; 0,11) |
30,15 (21,71; 30,21)*^ |
0,25 (0,15; 0,25)* |
0,41 (0,31; 0,52)* |
|
Автоклавирование |
97,01 (88,52; 98,43) |
27,52 (26,71; 28,43)* |
0,11 (0,09; 0,11)* |
34,42 (25,54; 34,63)* |
0,15 (0,11; 0,15)* |
0,31 (0,22; 0,44)* |
|
Этиленоксид |
98,52 (90,81; 99,23) |
20,32 (16,12; 24,41) |
0 (0; 0)#^ |
26,91 (20,44; 29,73)^ |
0,11 (0,09; 0,11)# |
0,15 (0,05; 0,15)*#^ |
|
Желатин А2 |
||||||
|
Ультрафиолет |
98,42 (88,93; 98,41) |
16,42 (16,13; 16,81)! |
0 (0; 0)+! |
29,33 (21,41; 31,71)* |
0,15 (0,05; 0,15)! |
0,51 (0,32; 0,71)* |
|
Автоклавирование |
98,33 (88,21; 99,12) |
19,22 (16,43; 22,11)! |
0 (0; 0,05)! |
30,72 (22,42; 33,24)* |
0,11 (0,05; 0,11) |
0 (0; 0,05)*#+! |
|
Этиленоксид |
98,42 (91,71; 99,23) |
20,72 (15,74; 25,73) |
0 (0,05; 0,11)# |
25,62 (17,51; 27,32)#^& |
0 (0; 0,05)! |
0,11 (0,11; 0,15)#^+ |
|
Желатин В2 |
||||||
|
Ультрафиолет |
98,51 (89,22; 99,24) |
16,71 (14,92; 18,53) |
0 (0; 0,1) |
28,22 (20,81; 30,54)* |
0,11 (0,05; 0,15)! |
0,31 (0,21; 0,41)* |
|
Автоклавирование |
94,12 (86,52; 96,93) |
26,31 (24,52; 27,94)*# |
0 (0; 0,05) |
25,51 (16,52; 28,33) |
0 (0; 0,05)+! |
0 (0; 0)*#+! |
|
Этиленоксид |
98,12 (91,71; 98,92) |
11,12 (10,53; 11,71)*#^+ |
0 (0; 0,05) |
23,12 (16,23; 26,34) |
0,11 (0,05; 0,11) |
0,11 (0,11; 0,15)#^+ |
Примечание. Данные представлены в виде медианы и интерквартильного диапазона (LQ; UQ). Контролем выступали клетки, культивируемые на культуральном пластике, не обработанном желатином. * — p < 0,05 по сравнению с группой контроля; # — p < 0,05 по сравнению с группой ультрафиолетового облучения; ^ — p < 0,05 по сравнению с группой автоклавирования; + — р < 0,05 по сравнению с желатином А1; ! — р < 0,05 по сравнению с желатином В1; & — р < 0,05 по сравнению с желатином B2.
нием наблюдалось для всех желатинов с некоторой вариацией по степени эффекта.
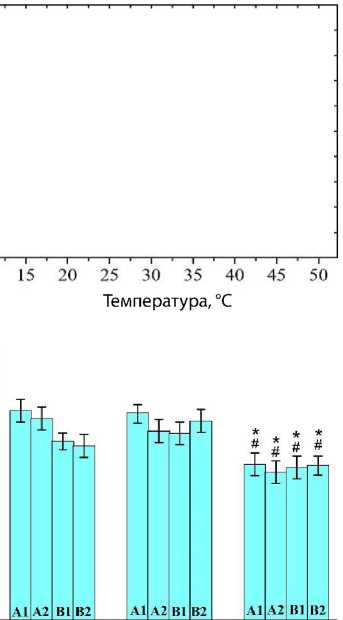
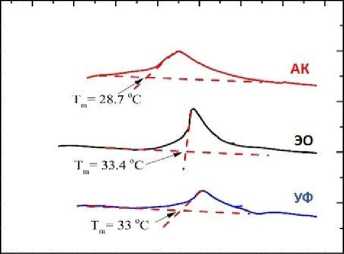
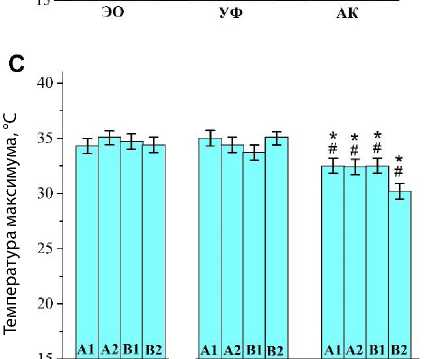
Измерение кривых ДСК показало, что при первом нагревании образца до 50 °С можно наблюдать пик денатурации желатина, который не прослеживается при последующем охлаждении и повторном нагреве. То есть в рамках проведенного эксперимента он может рассматриваться необратимым. Примеры кривых ДСК для желатина А1, стерилизованного разными способами, показаны на рис. 4, А. Температура перехода ( T m) , определенная классическим способом, отражена на рис. 4, В. Так как переход денатурации оказался размытым, то интересно было определить температуру максимума пика ДСК ( T max ) для денатурации исследуемых желатинов
(рис. 4, С). Из рис. 4 видно, что стерилизация автоклавированием снижает температуру перехода денатурации в желатинах всех видов, рассматриваемых в настоящей работе. Этот вывод справедлив как для значения Tm , так и для Tmax , и может считаться твердо установленным.
Обсуждение
Понимание последствий стерилизации гидрогелей и связанных с этим изменений их свойств, как положительных, так и отрицательных, — важный аспект применения гидрогелей в трансляционной тканевой инженерии. Целью стерилизации является удаление или инактивация микробных загрязнений путем денатурации белков, разрушения атевс яиняессар огонноицанибмок ьтсонвиснетнИ
600 800 1000 1200 1400 1600 1800
Рамановский сдвиг, см-1
Желатин А1
ьтсонтолп яаксечитпО
этиленоксид ультрафиолет автоклавирование

900 1200
в
1500 1800
Частота, см-1
Рис. 3. Спектры комбинационного рассеяния света (А) и поглощения инфракрасного света (B) желатина А1 после стерилизации ультрафиолетовым облучением, автоклавированием и этиленоксидом. На рис. B серым цветом показана область погрешности спектров клеточных мембран или ферментных систем. Однако предыдущие исследования показали, что методы стерилизации могут изменять свойства гидрогелей. Стерилизация может приводить к деградации и/или разложению материалов, обесцвечиванию, хрупкости, образованию запаха, способствовать дальнейшему сшиванию или вызывать токсическое воздействие [18].
Например, стерилизация автоклавированием имеет хорошую проницаемость, что позволяет проводить полную стерилизацию [19]. Однако этот подход может вызывать структурные изменения и деградацию гидрогелей, обычно используемых в тканевой инженерии [20]. Обработка этиленоксидом приводит к необратимому алкилированию клеточных компонентов; это эффективно подавляет метаболизм и деление микроорганизмов или биологических агентов [19; 21]. С другой стороны, эти-леноксид может ускорять деградацию полимеров с образованием токсичных остатков и изменением механических свойств [22]. УФ-облучение часто используется для стерилизации биоразлагаемых каркасов и биочернил. Оно сопровождается возбуждением электронов и накоплением фотопродуктов, которые повреждают молекулы ДНК, предотвращают репликацию ДНК, что в конечном итоге приводит к инактивации микроорганизмов. Ультрафиолет применяют как недорогой метод стерилизации, который способен уничтожать патогенные организмы при сохранении структуры биологически активных молекул и может быть использован в лабораториях перед исследованиями in vivo. Показано, что УФ-облучение при 400 мкВт/см2 вплоть до 15 ч не пре- дотвращало рост Escherichia coli внутри гидрогелей, однако вызывало прогрессирующую деградацию пептидов, содержащих домен Arg-Gly-Arg (RGD) [23].
Во время длительной инкубации очень важно, чтобы деградация стерилизованного желатина не сопровождалась выделением цитотоксических побочных продуктов и неблагоприятными химическими реакциями, которые могут влиять на жизнеспособность и функциональную активность клеток [24]. Поэтому первый этап нашей работы был связан с оценкой цитотоксичности и пролиферации эндотелиальных клеток, культивируемых на желатинах, стерилизованных разными методами. Мы не выявили влияния методов стерилизации на цитотоксичность желатинов А и В; жизнеспособность эндотелиальных клеток через 3 сут. культивирования на всех желатинах была на высоком уровне (83–105 %) (рис. 1). Эти результаты согласуются с данными R. Barbucci и соавт., которые не обнаружили влияния гидрогеля (гиалуроновой кислоты), стерилизованного этиленоксидом, на жизнеспособность клеток фибробластов мыши (3T3) и CVEC [25]. Аналогично хитозановые мембраны, стерилизованные этиленоксидом, не оказывали цитотоксического действия на клетки Vero [26]. В исследовании R. Rodríguez-Rodríguez экстрактивная среда, полученная из стерилизованных автоклавированием гидрогелей, не содержала токсичных веществ для клеток HT29-MTX-E12. Жизнеспособность клеток в гидрогелях была выше 80 %, что указывает на их хорошую цитосовместимость [27].
Наряду с отсутствием цитотоксичности исследуемых методов стерилизации мы наблюдали зна-
5 о 5 о L 3 3 2 2. С° ,адохереп арутарепмеТ
КСД алангис ьтсонвиснетнИ
эо
Рис. 4. Результаты дифференциальной сканирующей калориметрии образцов желатина после стерилизации ультрафиолетовым облучением, автоклавированием и этиленоксидом: вид кривых для желатина А1 (A); температура перехода (B); температура максимума (C) Примечание. ДСК — дифференциальная сканирующая калориметрия; УФ — ультрафиолетовое облучение; АК — автоклавирование; ЭО — этиленоксид; * — р < 0,05 по сравнению с группой этиленоксида; # — р < 0,05 по сравнению с группой ультрафиолетового облучения.
чительное снижение уровня пролиферации клеток линии EA.hy926 на желатине В1, стерилизованном УФ-облучением, через 168 ч и этиленоксидом через 72 и 168 ч культивирования по сравнению с контролем (р < 0,05). К сожалению, в доступных источниках литературы мы не нашли данных о влиянии стерилизации этиленоксидом на биосовместимость желатина В, имеются данные только для желатин-метакрилоила, приготовленного на основе желатина А. Так, C.D. O'Connell и соавт. показали, что культивирование человеческих мезенхимальных стволовых клеток на желатин-метакрилоиле, стерилизованном этиленоксидом, не сопровождалось снижением их жизнеспособности и не влияло на скорость пролиферации [12]. С другой стороны, M. Rizwan и соавт. выявили, что жизнеспособность фибробластов значительно снижалась в 3D-культу-ре клеток, инкапсулированных в гидрогель на основе желатин-метакрилоила, стерилизованного этиленоксидом [13]. В нашем исследовании стерилизация желатина А1 УФ-облучением (через 72 ч), автоклавом (через 168 ч) и этиленоксидом (через 72 ч) приводила к увеличению уровня пролиферации эндотелиальных клеток на них по сравнению с другими желатинами (р < 0,05) (рис. 2).
Критические характеристики биочернил включают в себя не только биосовместимость, но и наличие мест клеточной адгезии (RGD-лигандов), которые должны сохраняться после стерилизации. RGD-лиганд представляет собой трипептид, состоящий из L-аргинина, глицина и L-аспарагиновой кислоты. RGD-лиганды опосредуют прикрепление клеток к белку после распознавания интегринами клеток [28]. Полученные нами данные свидетельствуют, что методы стерилизации по-разному влияют на адгезию клеток в ранний и поздний периоды культивирования на разных видах желатина. Так, кроме стерилизации этиленоксидом желатина А1 и ультрафиолетом желатинов А1 и В1, все методы стерилизации снижали адгезию эндотелиальных клеток в ранний период (2 ч) по сравнению с контролем (р < 0,05) (табл. 1). С другой стороны, начиная с 24 ч культивирования ни один метод стерилизации не влиял на адгезию эндотелиальных клеток на желатине А1. Для желатина В2 наибольшее количество адгезированных клеток выявили на автоклавированном желатине начиная с 24 ч. При этом через 168 ч культивирования на всех желатинах, кроме В1, стерилизованного ультрафиолетом, отметили увеличение адгезированных эндотелиальных клеток по сравнению с контролем (р < 0,05). Наиболее чувствительным ко всем методам стерилизации оказался желатин А2, увеличение количества адгезированных клеток при его применении наблюдалось только через 168 ч культивирования. Мы предполагаем, что низкий уровень адгезии и пролиферации эндотелиальных клеток на желатине А2 после всех видов стерилизации может быть связан с исходным более низким содержанием в нем RGD-лигандов по сравнению с желатином А1. В пользу предположения служит работа M. Rizwan и соавт., в которой показано, что стерилизация желатин-метакрилоила, приготовленного на основе желатина А, автоклавированием и этиленоксидом не влияла на адгезию фибробластов и эндотелиальных клеток в 2D-моде-ли через 24 ч культивирования [13]. Таким образом, полученные нами результаты позволяют предположить, что исследуемые виды стерилизации существенно не влияли на наличие клеточных адгезивных RGD-лигандов.
Адгезия клеток напрямую связана с уровнем экспрессии молекул адгезии, поэтому следующим этапом нашей работы было определение уровня экспрессии молекул адгезии на эндотелиальных клетках. Для эндотелиальных клеток, культивированных на желатине А1, стерилизованном разными методами, выявили более высокий уровень экспрессии всех исследуемых молекул адгезии (табл. 2), что, вероятно, и обусловило их высокую адгезию. Ранее E.R. Ruskowitz и C.A. DeForest в исследовании на нескольких типах клеток продемонстрировали, что воздействие низкой дозы УФ-облучения с длиной волны 365 нм не вызывало изменений протеома клеток, пролиферации или индукции апоптоза [29].
Полученные спектры КРС (рис. 3, А) показали, что молекулы желатина А и В не претерпевают существенных химических изменений при исследуемых видах стерилизации. Такое заключение сделано на основании одинаковости спектров КРС для всех исследованных образцов. В случае образования новых химических веществ или уменьшения вкладов от каких-то аминокислотных остатков следовало бы ожидать появления новых пиков или уменьшения интенсивности исходных пиков, особенно в диапазоне 500–1800 см-1, чувствительном к внутримолекулярным колебаниям. Однако мы этого не обнаружили, как проиллюстрировано на рис. 3, А для случая желатина А1. Поэтому с точностью эксперимента можем сделать вывод о неизменности спектра после различных видов стерилизации. Данные ИК-спектроскопии также указывают на отсутствие заметных изменений в химическом составе желатинов, которые могли бы быть вызваны способом стерилизации (рис. 3, В). C.-K. Wu и соавт. ме- тодами ИК-спектроскопии и КРС установили, что обработка УФ-облучением существенно не изменяла молекулярную структуру порошка рыбьего желатина [30]. R. Rodríguez-Rodríguez и соавт. с помощью ИК-спектроскопии показали, что стерилизация желатина В УФ-облучением и автоклавированием вызывала лишь незначительные эффекты на амидную моду [27]. Наблюдаемое нами систематическое уменьшение фона в районе 1150–1450 см-1 для образцов желатина, стерилизованных автоклавированием, в настоящее время не имеет описания на языке колебательных мод.
Уменьшение температуры перехода (рис. 4) естественно связать с увеличением неупорядоченности белковой цепи в неупорядоченном состоянии (увеличение числа доступных конформационных состояний, иными словами — степени вырождения неупорядоченных состояний). Возможно, слабые эффекты для образцов желатина, стерилизованного автоклавированием, наблюдаемые в методах колебательной спектроскопии КРС и ИК-поглощения (рис. 3, 4), также могут быть связаны с некоторыми изменениями в третичной структуре, например, с изменением связей типа S–S, стабилизирующих структуру. По-видимому, высокотемпературная обработка в автоклаве приводит к разрыву некоторых связей. Так, C. Ji и J. Shi связали изменения физикохимических и механических свойств (пористость, набухание, модуль сжатия), а также биосовместимости стерилизованных автоклавированием хитозана и желатина со сшивкой аминогрупп, индуцированной паровой стерилизацией [31].
Анализируя полученные данные, мы можем заключить, что наибольшая биосовместимость выявлена для желатинов А1. При выборе метода стерилизации желатинов А и В необходимо учитывать ряд особенностей. УФ-облучение — самый простой метод стерилизации желатинов в условиях лаборатории перед исследованиями in vitro . Однако его лучше не использовать для стерилизации желатина В1. Применение in vivo каркасов и 3D-конструкций из стерилизованных УФ-облучением чернил требует дальнейшего изучения, включая исследование реологических свойств стерилизованных желатинов, тестирование на стерильность.
Стерилизация автоклавом желатинов А и В, используемых в данной работе, приводила к снижению температуры перехода денатурации в желатинах (низкой термической стабильности), что может существенно ограничить их использование в биопечати и в качестве герметика для сосудов после изучения их биомеханических свойств.
Широко применяемым методом стерилизации в медицинских учреждениях является стерилизация этиленоксидом. Основное ограничение этого способа — необходимость наличия газового сте-рилизатора/аэратора. Согласно полученным нами данным, метод не подходит для стерилизации желатина В1.
Заключение
Биопроизводство вошло в фазу развития с доклиническими и клиническими испытаниями. Эта фаза отмечена новыми трансляционными проблемами, среди которых требование продемонстрировать надежную и эффективную стерилизацию материалов. Мы исследовали влияние трех методов стерилизации на два вида желатина (А и В) разных фирм-производителей, которые применяются в биопроизводстве. Результаты показывают, что стерилизация УФ-облучением и этиленоксидом существенно не влияет на химическую структуру и биосовместимость желатина А1, однако сопровождается снижением биосовместимости других стерилизованных видов желатина. Стерилизация желатинов А и В автоклавированием сопровождается изменением конформационного состояния желатинов.


