Исследование целлюлозолитической активности цекальных бактерий у кроликов методом in vivo
Автор: Лактионов К.С.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Научное обеспечение развития животноводства
Статья в выпуске: 1 (34), 2012 года.
Бесплатный доступ
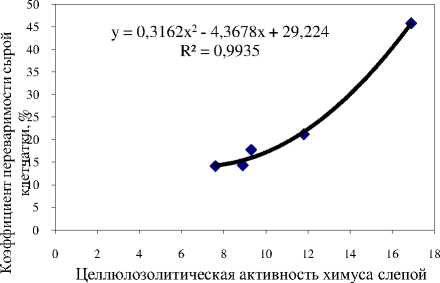
В ходе сравнительного анализа существующих методов исследования целлюлозолитической активности микроорганизмов установлено, что все они не лишены отдельных недостатков и не вполне объективны. Это связано с тем, что большинство существующих методов разработано для определения активности целлюлаз у жвачных животных в рубце, содержимое которого существенно отличается по своим физическим свойствам (влажности, вязкости, дисперсности) от химуса слепой кишки. Предложена конструкция капсулы, увеличивающая контакт химуса с источником целлюлозы. Регрессионный анализ позволил установить, что показатель целлюлозолитической активности в слепой кишке, полученный предлагаемым методом, связан с коэффициентом переваримости клетчатки различных рационов высоко достоверной функцией следующего вида: y = 0,3162x2 - 4,3678x + 29,224. Предложенная методика может быть использована в физиологических исследованиях и для прогнозирования переваримости клетчатки различных кормов и рационов, что является необходимым для совершенствования систем питания кроликов и повышения их мясной продуктивности.
Кролики, слепая кишка, химус, симбионтные бактерии, целлюлозолитические микроорганизмы, активность целлюлаз, методы определения ферментативной активности, методы определения целлюлаз у жвачных животных, вискозиметрический метод, метод определения активности целлюлаз у кроликов in vivo, кролики с хронической фистулой слепой кишки, переваримость клетчатки, система питания, мясная продуктивность
Короткий адрес: https://sciup.org/147123817
IDR: 147123817 | УДК: 636.92:612
Текст научной статьи Исследование целлюлозолитической активности цекальных бактерий у кроликов методом in vivo
позволяет оценить лишь титр целлюлозолитических бактерий в слепой кишке , а не фактическую динамику целлюлозолитической активности . В наших опытах при увеличении уровня клетчатки в рационе кроликов целлюлозолитическая активность , изучаемая данным методом , повышалась , что не соответствовало изменениям показателя переваримости клетчатки .
Другой метод – вискозиметрический был предложен исследователями в области биокатализа и заключается в оценке изменения вязкости раствора карбоксиметилцеллюлозы при добавке ферментного препарата [3]. По этой методике определяется только один из ферментов целлюлазного комплекса – эндоглюконаза ( К . Ф . 3.2.1.4), начинающая гидролиз целлюлозы . Как показали наши исследования на кроликах , это типичный адаптивный фермент , активность которого прямо пропорциональна поступлению субстрата и не позволяет выявить динамику сочетанного действия целлюлаз .
Большинство известных методов определения целлюлозолитической активности in vivo разработано для изучения ее в преджелудках жвачных животных [4]. Содержимое преджелудков имеет существенные физико-химические отличия от химуса слепой кишки кроликов. Так, если у жвачных содержимое рубца включает крупные частицы корма и свободную жидкую фракцию, то у кроликов пищевые массы, дошедшие до слепой кишки, находятся в гомогенном мелкодисперсном состоянии, а жидкая фаза не отделяется, что затрудняет изучение целлюлозолитической активности у кроликов подобными методами.
Для более адекватной оценки особенностей целлюлозолитической активности микрофлоры у кроликов в зависимости от биохимического состава рациона , уровня клетчатки , ее источников и способов скармливания , нами была разработана оригинальная методика вживления хронических фистул слепой кишки у кроликов и изучения целлюлозолитической активности цекальных микробов методом in vivo [5].
По нашей методике канюли изготовляются из задней части пластикового одноразового шприца ( объемом 5 см 3) длиной 3,5 см , снабженной фаской , стачиваемой до размера 3 мм . Кролик надежно фиксируется в станке , в нижней трети живота подготавливается операционное поле , местный наркоз осуществляется раствором новокаина по Вишневскому . Канюля внедряется в разрез слепой кишки со стороны фаски и закрепляется кисетным швом . Мышцы и брюшина зашиваются кетгутом , кожа – капроновой нитью . Для фиксации канюли на ее наружную выступающую часть приклеивается пластмассовая трубка большего диаметра . После операции на животных надеваются специальные фартуки во избежание травмирования операционного поля .
Методика определения целлюлозолитической активности состоит в следующем : источник целлюлозы ( предварительно высушенная гофрированная полоска обеззоленного фильтра « синяя лента ») помещается в капсулу , выполненную из отрезка поливинилхлоридной трубки , запаянную с одного конца , длиной 30 и диаметром 7 мм , снабженную 4 продольными отверстиями . Такая продольная перфорация обеспечивает наилучший контакт источника целлюлозы с химусом и высокую воспроизводимость значений показателя . Капсула на капроновой нити вводится в слепую кишку через канюлю , всегда на постоянную глубину . Конец нити крепится к наружному диску канюли . Целлюлозолитическая активность выражается в процентах убыли массы источника целлюлозы за время инкубации .
Нами определено также оптимальное время инкубации . Как показали наблюдения , после 24 часового пребывания источников целлюлозы в слепой кишке они сильно деструктурируются , и в процессе отмывания отмечались существенные потери их массы . Более стабильные показатели были получены при 12 часовой экспозиции , которая и использовалась в дальнейших анализах .
Опыты по изучению влияния уровней клетчатки на целлюлозолитическую активность цекальной микрофлоры и переваримости этого нутриента проводились на 10 взрослых кроликах с хронической фистулой слепой кишки методом периодов продолжительностью по 16-18 суток каждый . Ж ивотные находились на зимних рационах , состоящих из концентратов , сена и корнеплодов и содержащих в 1, 2, 3, 4, 5 периодах опыта 12,8; 14,4;
16,0 ( контроль ); 17,6 и 19,2 % клетчатки соответственно . Указанные уровни клетчатки достигались изменением соотношения в рационе концентратов и сена . Данные по целлюлозолитической активности представлены в таблице .
Таблица – Целлюлозолитическая активность микрофлоры слепой кишки у кроликов в зависимости от уровня клетчатки в рационе
|
Показатели |
Содержание клетчатки, % |
||||
|
12,8 |
14,4 |
16,0 |
17,6 |
19,2 |
|
|
Целлюлозолитическая активность (in vivo), % |
16,6±1,2 |
14,8±1,3 |
11,8±1,5 |
9,3±0,5 |
8,9±0,8 |
Выявленная эмпирическая зависимость между активностью и концентрацией клетчатки в рационах с высокой степенью точностью (R2 = 0,97) аппрокси мируется степенной функцией y = 1272,3 x -1,69 Данные , полученные этим методом достоверно коррелируют с коэффициентами переваримости клетчатки различных рационов (r = 0,938, р < 0,01). Взаимосвязь между этими двумя показателями изображена на рисунке .
кишки in vivo, %
Рисунок – Зависимость переваримости клетчатки от целлюлозолитической активности в слепой кишке
Таким образом , несмотря на относительную трудоемкость , предложенный нами метод определения целлюлозолитической активности микрофлоры у кроликов более приемлем для физиологических исследований , чем традиционные методики и позволяет определить суммарную активность ферментов целлюлазного комплекса in vivo, а также прогнозировать переваримость клетчатки и других питательных компонентов кормов .
Список литературы Исследование целлюлозолитической активности цекальных бактерий у кроликов методом in vivo
- Калугин, Ю.А. Физиология питания кроликов/Ю.А. Калугин -М.: Колос., 1980. -173 с
- Чурлис, Т.К. О методике определения активности расщепляющей целлюлозу микрофлоры преджелудков у крупного рогатого скота/Т.К. Чурлис//Кормление сельскохозяйственных животных. -М. -1958. -С. 470-475
- Клесов, А.А. Ферменты, гидролизующие целлюлозу: Активность и компонентный состав целлюлазных комплексов из различных источников/А.А. Клесов//Биоорг. Химия. -М. -1980. -Т. 6 -С. 1225-1242
- Курилов, Н.В. Использование физиологических и биохимических методов в изучении пищеварения жвачных/Н.В. Курилов//Новые методы и модификации биохимических и физиологических исследований в животноводстве: сб. науч. трудов. -Боровск., 1972. -С. 96-105
- Лактионов, К.С. Влияние целлюлолиза у кроликов на переваримость кормов/К.С. Лактионов//Информационный листок -Орел: ЦНТИ. -1999. -№ 195-99. -3 с.


