Исследование динамики деструкции глюкозы при направленном ферментировании огурцов с использованием штаммов молочнокислых микроорганизмов
Автор: Кондратенко В.В., Посокина Н.Е., Лялина О.Ю.
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 4 (42), 2018 года.
Бесплатный доступ
В статье представлены результаты работы по исследованию направленного ферментирования огурцов с использованием штаммов молочнокислых микроорганизмов (молочнокислых бактерий) с целью интенсификации процесса ферментирования и для получения готового продукта хорошего качества (с хорошим вкусом, ароматом и структурой), так как в промышленном масштабе заквасочные культуры практически не используются. Задачей наших исследований являлось изучение динамики деструкции глюкозы в процессе направленного ферментирования огурцов сорта Водолей с использованием молочнокислых бактерий и их подбор для проведения данной работы. В качестве штаммов молочнокислых микроорганизмов нами были выбраны следующие: Lactobacillus casei ВКМ 536, Lactobacillus plantarum ВКМ В-578, Lactobacillus brevis ВКМ В-1309. С целью создания оптимальных условий для развития целевой микрофлоры, определения степени деструкции глюкозы различными штаммами микроорганизмов и для получения сравнительных результатов все эксперименты проводили на модельных средах. В процессе исследований были разработаны математические модели, адекватно описывающие степень деструкции глюкозы в процессе ферментации огурцов. Математическую обработку данных по деструкции глюкозы в процессе направленной ферментации проводили с помощью Microsoft Excel и SYSTAT TableCurve 2D. Установлено, что по критерию интенсивности деструкции глюкозы при ферментировании огурцов сорта Водолей наиболее адекватным является использо-вание исследованных штаммов молочнокислых микроорганизмов L. brevis и L. plantarum. Применение данных молочнокислых бактерий обеспечивает максимальную эффективность процесса (максимально приемлемая продолжительность 4,47 и 5,36 суток при достижении степени деструкции глюкозы более 99% от асимптотического значения). Использование L. brevis и L. plantarum позволяет достичь максимальной степени деструкции глюкозы, что указывает на потенциальную целесообразность применения данных видов молочнокислых бактерий.
Огурцы, направленное ферментирование, модельная среда, штаммы молочнокислых микроорганизмов, молочнокислые бактерии, заквасочные культуры, динамика деструкции глюкозы, математическая обработка данных
Короткий адрес: https://sciup.org/140223825
IDR: 140223825 | УДК: 635.63:577.15:579.67 | DOI: 10.18619/2072-9146-2018-4-86-88
Текст научной статьи Исследование динамики деструкции глюкозы при направленном ферментировании огурцов с использованием штаммов молочнокислых микроорганизмов
Спомощью молочнокислого брожения консервируют самые разные овощи и фрукты. В зависимости от вида сырья технология производства, например, квашеной капусты и соленых огурцов отличаются. В большинстве случаев при промышленном производстве используют заквасочные культуры или процесс ферментации протекает естественным путем и является результатом жизнедеятельности природных микроорганизмов и условий среды (концентрации соли, значение рН и температуры рассола) [1]. Для ферментации огурцов готовят рассолы, концентрация соли зависит от размера плода (огурца), сорта, способности к размягчению при выдержке в рассоле и может варьировать от 1% до 10% [2], разновидности готового продукта (сильно соленые огурцы – содержание соли 8-10% и до 15% и малосоленые огурцы в укропном рассоле 3-5% соли с укропом и специями [3].
Основным продуктом ферментации является молочная кислота, соль впиты- вает из огурцов влагу и сдерживает рост нежелательных микроорганизмов, причем огурцы служат субстратом для роста и размножения молочнокислых бактерий. В ходе ферментации необходимо поддерживать анаэробные условия, позволяющие нативным микроорганизмам размножаться и продуцировать достаточное количество молочной кислоты, предотвращая при этом рост нежелательных микроорганизмов [4].
Процесс производства соленых огурцов протекает при температуре 18…20°С с образованием молочной кислоты, СО2, ряда летучих кислот, этанола и небольших количеств различных вкусоароматических соединений. После погружения огурцов в рассол и закрытия емкости в рассоле быстро размножаются микроорганизмы. Скорость ферментации зависит от концентрации соли в рассоле и его температуры. Как правило, чем меньше концентрация соли, тем больше видов бактерий размножаются в начале, тем быстрее продуцируется кислота и выше кислотность. Образовавшаяся молочная кислота затем частично метаболизируется пленочными или окислительными дрожжами, растущими на поверхности рассола, благодаря чему незначительно повышается значение рН бродильной среды [5].
Контролируемая ферментация огурцов способствует устранению многочисленных причин порчи. При производстве соленых огурцов используют заквасочные культуры на основе L. plantarum, (отдельно или вместе с Pediococcus cerevisae) [6]. Эта процедура направлена на исключение стадий начальной и вторичной ферментации (брожения). Контролируемая ферментация экономически более выгодна и позволяет быстрее получать однородный по качеству продукт за более короткий период времени [7]. Кроме того, при контролируемой ферментации снижается необходимость добавления соли в ходе хранения. В производстве соленых огурцов крепкого посола большую роль играют молочнокислые бактерии сначала – Pediococcus cerevisiae, которые сменяются более кислотостойкими L. plantarum и L. brevis, а L. mesenteroides в производстве огурцов крепкого посола не так важны, но зато они активны в огурцах слабого посола [8].
Поскольку процесс ферментации (брожения) невозможен без участия в нем сахаров, которые под действием молочнокислых бактерий преобразуются в молочную кислоту, количество сахаров в исходном сырье играет важную роль. По степени деструкции сахаров, на примере глюкозы, мы можем сделать вывод о пригодности использования того или иного штамма молочнокислых микроорганизмов для использования в процессе направленного ферментирования огурцов и его эффективности.
Цели и задачи
Целью нашей научно-исследовательской работы являлся подбор штаммов молочнокислых микроорганизмов (молочнокислых бактерий) перспективных для производства качественной ферментированной овощной продукции в промышленных условиях на примере огурцов сорта Водолей.
Задача наших исследований состояла в изучении динамики деструкции сахаров, на примере глюкозы, в процессе направленного ферментирования огурцов с использованием штаммов молочнокислых микроорганизмов.
Материалы и методы
В качестве исходного сырья использовали плоды огурцов сорта Водолей. Активность процесса ферментации определяли по интенсивности деструкции глюкозы. Для получения сравнительных результатов все эксперименты проводили на модельных средах.
Модельные среды для исследований готовили следующим образом: свежие плоды огурцов тщательно мыли в проточной воде до удаления с их поверхности всех загрязнений. Влагу с поверхности
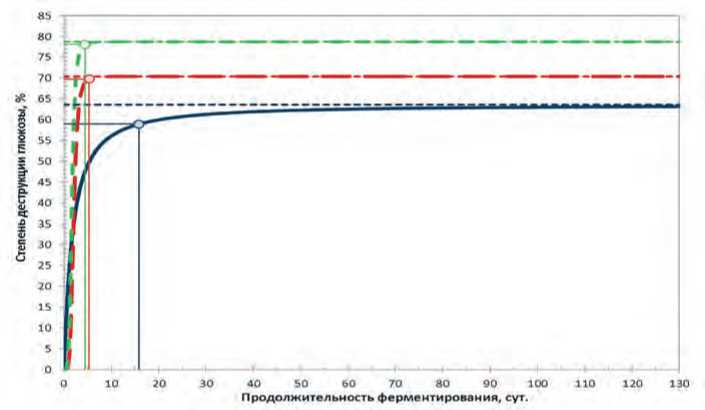
^^^■L. easel ■■^— L, plantarum * — L brevis
Рис. Зависимость степени деструкции глюкозы используемыми штаммами молочнокислых микроорганизмов от продолжительности ферментирования Fig. Dependence of the degree of glucose destruction by the strains used lactic acid microorganisms from the duration of fermentation
удаляли фильтровальной бумагой. Сырьё подвергали гомогенизации. Далее в полученную массу вносили 40% водного раствора NaCl концентрацией 7%. Полученные образцы дозировали в предварительно подготовленные стеклянные банки, с последующим герметичным укупориванием и стерилизацией в течение 20 мин при 100°С для устранения посторонней микрофлоры. После охлаждения подготовленные образцы инокулировали штаммами Lactobacillus casei ВКМ 536, Lactobacillus plantarum ВКМ В-578 и Lactobacillus brevis ВКМ В-1309, по одному штамму в каждый образец. Титр штаммов микрофлоры в каждом из образцов на момент инокуляции составлял 1 · 104 на 1 г.
Активную фазу ферментирования проводили в течение 3 сут. при температуре 23…25°С. Дальнейшее ферментирование проводили при температуре от -1°С до +4°С. Отбор проб проводили в течение 1, 2, 3, 10, 20, 30, 60, 90 суток ферментации.
Исследование динамики изменения содержания глюкозы проводили методом ВЭЖХ на жидкостном хроматографе с рефрактометрическим детектором Perkin Elmer Series 200, колонка – Agilent Zorbax Carbohydrate 4,6x250 мм, подвижная фаза – «ацетонитрил: вода» 75:25, скорость потока 1 см3/мин в изократическом режиме. Идентификацию глюкозы проводили по абсолютному времени удерживания в образцах, сравнением со временем удерживания в градуировочных растворах. Расчёт концентрации – методом внешнего стандарта.
Результаты
Анализ результатов нашей научноисследовательской работы после проведенной математической обработки экспериментальных данных показал, что процесс деструкции глюкозы при ферментировании образцов модельных сред используемыми молочнокислыми бактериями во всех трёх случаях протекает по аналогичному сценарию, отличаясь лишь интенсивностью (рисунок).
Вместе с тем каждая зависимость обладает чётким зонированием на период активной и малоактивной деструкции.
Математически все три зависимости могут быть представлены в следующей форме:
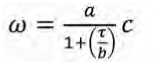
где ω – степень деструкции глюкозы, %;
τ – продолжительность ферментирования, сут.;
-
a, b и c – коэффициенты.
Показатели и характеристики разработанных математических моделей для всех используемых штаммов молочнокислых микроорганизмов представлены в таблице. Анализируя данные таблицы можно сделать вывод, что все найденные (разработанные) модели адекватны по критерию Фишера при α < 0,00005 и имеют высокую сходимость с экспериментальными данными (R2 > 0,98).
При оценке результатов моделирования можно сделать вывод, что все зависимости с увеличением продолжительности ферментирования стремятся к некоторому максимальному – асимптотическому – значению, которое может быть определено по формуле:
^т-»» = Нт^-^гтс => a ° u i+k)
где шт_,оо = > a, a c<0
Безусловно, при масштабировании изучаемых процессов до промышленного использования достижение асимптотических значений степени деструкции глюкозы лишено смысла. В большей степени эффективнее и правильнее будет определить максимально приемлемую продолжительность ферментации, при которой дальнейшее увеличение продолжительности на заданную величину ∆ τ приводит к приросту ω на некоторую величину d , определяемую по формуле [9]:
d = Ш<т+Дт)-Ш(т1 • 100% ш(т)
В ходе исследований максимально приемлемую продолжительность процесса определяли при d = 0,5%.
Значение показателя q показывает нам степень деструкции глюкозы при ω d≤0,5 и ω τ →∞ .
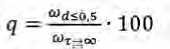
Оценка полученных экспериментальных данных показывает, что по критерию интенсивности деструкции глюкозы в процессе ферментации огурцов сорта Водолей в наибольшей степени продуктивным является применение исследованных штаммов L. brevis и L. plantarum, которые обеспечивают максимальную эффективность процесса. Таким образом, при достижении степени деструкции глюкозы более 99% от асимптотического значения максимально подходящая продолжительность составляет 4,47 и 5,36 суток.
Выводы
Результаты работы по исследованию динамики деструкции глюкозы при направленном ферментировании огурцов сорта Водолей с использованием различных штаммов молочнокислых микроорганизмов ( L. casei, L. plantarum и L. brevis ) показывает различные временные интервалы до достижения максимально приемлемых значений. Таким образом, для штамма L. casei этот период составил 15,86 суток, для L. plantarum – 5,36 суток, для L. brevis – 4,47 суток. Из этого следует, что применение штаммов L. brevis и L. plantarum позволяет добиться максимально оптимальной степени деструкции глюкозы в огурцах сорта Водолей за наименьший временной интервал. Это подтверждает эффективность применения данных видов молочнокислых микроорганизмов при направленном ферментировании огурцов используемого в ходе исследований сорта.
Таблица. Показатели и характеристики разработанных математических моделей Table. Indicators and characteristics of the developed mathematical models
|
Показатели и характеристики математических моделей |
Вид микроорганизмов |
||
|
L. casei |
L. plantarum |
L. brevis |
|
|
Коэффициенты: a b c |
63,60212095 1,738976927 -1,1466036 |
70,3849443 2,043507688 -4,90368051 |
78,73599552 1,673576131 -4,91822472 |
|
Адекватность модели: α , ≤ R2 |
0,00001 0,9967300166 |
0,00005 0,9986340212 |
0,00001 0,9908151267 |
|
Характеристики модели: ω τ →∞, % τ d≤0,5 , сут. ω d≤0,5, % q, % |
63,6 15,86 58,93 92,66 |
70,38 5,36 69,77 99,13 |
78,74 4,47 78,11 99,2 |
-
• Литература
-
1. Breidt J.F., McFeeters R.F., Diaz-Muniz I. Fermented vegetables // Food microbiology: Fundamentals and Frontiers / Doyle M. P., Beuchat L.R. (eds). – 3rd ed. – Washington, D.C.: ASM Press, 2007. P.783.
-
2. Daeschel M. A., Fleming H. P. Selection of lactic acid bacteria for use in vegetable fermentations // Food Microbiol., 1984, 1, p. 303-313.
-
3. GuizaniN., Mothershaw A. Fermentation as a method of food preservation // Handbook of Food Preservation / Rahman M. S. (ed.) - 2nd ed. - Boca Raton: CRC Press, 2007. P.215.
-
4. Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. – СПб.: Профессия, 2014. – С.467-485.
-
5. Kim M., Chun J. Bacterial community structure in kimchi, a Korean fermented vegetable food, as revealed by 16S rRNAgene analysis// Int. J. Food Microbiol., 2005, 103, p. 91-96.
-
6. Jay J. M. Modern Food Microbiology. - 5th ed. - Maryland; NY: Chapman & Hall, 1998.
-
7. Prescott S. C. Dunn C. G. Industrial Microbiology. — NY: McGraw Hill, 1959.
-
8. Dennis С. Microbiology of fruits and vegetables // Essays in Agriculture and Food Microbiology / Norris R., Pettipher G.L. (eds). - NY: John Wiley and Sons Ltd, 1987. P.227.
-
9. Разработать систему научно-обоснованных параметров биотехнологической трансформации биополимеров углеводной природы вторичных продуктов свеклосахарного производства в функциональные биологически активные компоненты (0605-2014-0003). Раздел 9, подраздел 25 Программы ФАНО на 2013-2020гг. / Отчёт о НИР. – Видное: ФГБНУ «ВНИИТеК», 2014. – C.65.
-
-
• References
-
1. Breidt J.F., McFeeters R.F., Diaz-Muniz I. Fermented vegetables // Food microbiology: Fundamentals and Frontiers / Doyle M. P., Beuchat L.R. (eds). – 3rd ed. – Washington, D.C.: ASM Press, 2007. – P.783.
-
2. Daeschel M. A., Fleming H. P. Selection of lactic acid bacteria for use in vegetable fermentations // Food Microbiol., 1984, 1, p. 303-313.
-
3. Guizani N., Mothershaw A. Fermentation as a method of food preservation // Handbook of Food Preservation / Rahman M. S. (ed.) - 2nd ed. - Boca Raton: CRC Press, 2007. P215.
-
4. Handbook of the producer and processor of fruit and vegetable products. Edited by N.K. Sinha, I.G. Hugh. Translation from English. yaz. - SPb .: Profession, 2014. P.467-485.
-
5. Kim M., Chun J. Bacterial community structure in kimchi, a Korean fermented vegetable food, as revealed by 16S rRNAgene analysis// Int. J. Food Microbiol., 2005, 103, p. 91-96.
-
6. Jay J. M. Modern Food Microbiology. - 5th ed. - Maryland; NY: Chapman & Hall, 1998.
-
7. Prescott S. C. Dunn C. G. Industrial Microbiology. — NY: McGraw Hill, 1959.
-
8. Dennis С. Microbiology of fruits and vegetables // Essays in Agriculture and Food Microbiology / Norris R., Pettipher G. L. (eds). - NY: John Wiley and Sons Ltd, 1987. P.227.
-
9. To develop a system of scientifically grounded parameters of biotechnological transformation of biopolymers of the carbohydrate nature of secondary products of sugar beet production into functional biologically active components (0605-2014-0003). Section 9, subsection 25 of the FAO Program for 2013-2020. / Report on research. - Prominent: FGBNU "VNIITEK", 2014. P.65.
-
Список литературы Исследование динамики деструкции глюкозы при направленном ферментировании огурцов с использованием штаммов молочнокислых микроорганизмов
- Breidt J.F., McFeeters R.F., Diaz-Muniz I. Fermented vegetables//Food microbiology: Fundamentals and Frontiers/Doyle M. P., Beuchat L.R. (eds). -3rd ed. -Washington, D.C.: ASM Press, 2007. P.783.
- Daeschel M. A., Fleming H. P. Selection of lactic acid bacteria for use in vegetable fermentations//Food Microbiol., 1984, 1, p. 303-313.
- GuizaniN., Mothershaw A. Fermentation as a method of food preservation//Handbook of Food Preservation/Rahman M. S. (ed.) -2nd ed. -Boca Raton: CRC Press, 2007. P.215.
- Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. -СПб.: Профессия, 2014. -С. 467-485.
- Kim M., Chun J. Bacterial community structure in kimchi, a Korean fermented vegetable food, as revealed by 16S rRNAgene analysis//Int. J. Food Microbiol., 2005, 103, p. 91-96.
- Jay J. M. Modern Food Microbiology. -5th ed. -Maryland; NY: Chapman & Hall, 1998.
- Prescott S. C. Dunn C. G. Industrial Microbiology. -NY: McGraw Hill, 1959.
- Dennis С. Microbiology of fruits and vegetables//Essays in Agriculture and Food Microbiology/Norris R., Pettipher G.L. (eds). -NY: John Wiley and Sons Ltd, 1987. P.227.
- Разработать систему научно-обоснованных параметров биотехнологической трансформации биополимеров углеводной природы вторичных продуктов свеклосахарного производства в функциональные биологически активные компоненты (0605-2014-0003). Раздел 9, подраздел 25 Программы ФАНО на 2013-2020гг./Отчёт о НИР. -Видное: ФГБНУ «ВНИИТеК», 2014. -C.65.


