Исследование глютоматергического механизма действия NMDA рецепторного комплекса на безмагниевой модели возникновения эпилептиформной активности в Са1 области гиппокампа крыс
Автор: Мотин В.Г.
Журнал: Академический журнал Западной Сибири @ajws
Рубрика: Эксперимент
Статья в выпуске: 3 (64) т.12, 2016 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/140220014
IDR: 140220014
Текст статьи Исследование глютоматергического механизма действия NMDA рецепторного комплекса на безмагниевой модели возникновения эпилептиформной активности в Са1 области гиппокампа крыс
В настоящее время активно разрабатываются препараты для лечения когнитивных расстройств и нейро-дегенеративных процессов с глутаматергическим и гамкэргическим механизмом действия. Одной из главных структур принимающих участие в когнитивных процессах является гиппокамп (центральная структура лимбической системы) которая играет важную роль в процессах памяти и обучения у человека и животных, участвуя, например, в регистрации новой информации, формировании декларативной памяти, эмоций, пространственном обучении и др., а также имеет большое значение в механизмах скорости передачи информации и развития эпилепсии [2, 5, 6, 10]. Из-за сложной дендритной структуры, пирамидные нейроны гиппокампа имеют большие поверхности мембраны по отношению к другим клеткам, а так же большую электрическую емкость с большой постоянной времени мембраны (τm). Это приводит к медленной деполяризации в ответ на возбуждение синаптических входов, и, следовательно, к росту потенциала действия и переменной задержки, которые могут быть вычислены. Тоническая активация NMDA-рецепторов ионами
Mg2+ изменяет проводимость мембраны и таким образом регулирует возбудимость нейронов. Кроме того, тоническая активация NMDA-рецепторов, повышает проводимость в мембране уменьшая постоянную времени мембраны (τm) [3]. Следствием изменения (τm) может быть уменьшение или увеличения латентного периода популяционных ответов (ПО) в СА1 области гппокампа при стимуляции коллатералей Шаффера. В регуляции нейропередачи между коллатералями Шаффера и пирамидными нейронами СА1 области гиппокампа NMDA-рецепторный комплекс играет важную роль. Как известно, NMDA-рецепторный комплекс – сложное надмолекулярное образование, включающее в себя сайты специфического связывания с NMDA (и L-глутаминовой кислотой) и глицином (коагонист), а также аллостерические модуляторные сайты, расположенные как на мембране, так и в ионном канале, сопряженном с рецептором [4, 11, 12]. Канал NМDА-рецепторного комплекса блокируется как МК-801 (его специфический неконкурентный антагонист), так и потенциалзависимым образом ионами Mg2+, а также он высокопроницаем для ионов Са2+ (примерно 10% тока, протекающего через данный канал, осуществляется этими ионами). При этом возможен запуск ряда Са2+-зависимых внутриклеточных процессов, одним из которых является эпилептиформная активность. Однако особенности действия блокатора синтеза белка циклогексимида на NMDA-рецепторный комплекс в различных концентрациях на переживающих срезах гиппокампа крыс in vitro изучены недостаточно. Поэтому целью настоящей работы явилось исследование влияния циклогексимида в различных концентрациях на синаптическую передачу в системе коллатерали Шаффера – пирамидные нейроны поля СА1 гиппокампа, а также способность эпилептиформной активности изменять латентный период популяционных ответов.
Задачи исследования:
-
1. Исследование действия циклогексимида в концентрации, не изменяющей синаптическую передачу.
-
2. Исследование влияния специфического неконкурентного антагониста NМDА-рецепторного комплекса МК-801 на эффекты возникновение эпилептиформной активности и изменение латентного периода популяционных ответов при удалении ионов Mg2+.
Методика исследования.
Эксперименты проведены на переживающих срезах гиппокампа 22 крыс-самцов линии Вистар массой 180– 200 г. Приготовление и инкубирование срезов проводили так, как описано нами ранее [1]. Состав перфузионной среды (мМ): NaCl - 126, KCl - 3, NaH2PO4 - 1,25, MgSO4 - 1,2, CaCl2 - 2, NaHCO3 - 26, глюкоза - 10. Раствор насыщали газовой смесью 95% О2 и 5% CO2 (pH 7,4 при температуре 35±0,5°C). Скорость протока составляла 2 мл/мин. Период адаптации среза к солевой среде продолжался не менее 1 часа, после чего приступали к регистрации исходных показателей. Стимуляцию коллатералей Шаффера производили с частотой 1 Гц (30 импульсов в течение 30 с), регистрируя все популяционные ответы (ПО). Более подробно методика описана нами ранее [1]. Для создания модели эпилептиформной активности удаляли из перфузионной среды ионы Mg2+ [9]. В работе были использованы анализаторные веще- ства – специфический неконкурентный антагонист NМDА-рецепторного комплекса МК-801 (Sigma-Aldrich, США). Статистическую обработку результатов исследований проводили с использованием программ BioStat 2009 Professional и OriginPro 8 SRO. Для оценки значимости различий двух выборок применяли t-критерий Стьюдента.
Результаты исследования:
В I серии экспериментов выявлено, что перфузия переживающих срезов раствором, содержащим циклогексимид в концентрации 200 мкМ (n=5) уменьшал амплитуду (ПО) (1-й стимул – на 78,5 ±1%, p<0,05 30-й стимул – на 91,6±4%, p<0,05), а латентный период (ПО) достоверно не изменял. В концентрации 30мкМ (n=5) достоверно не изменял амплитуду и латентный период (ПО).
Удаление Mg2+ из раствора ACSF содержавшего циклогексимид 30мкМ (n=5) приводило к увеличению амплитуды (ПО) ( 1-й стимул – на 27,5±3,6%, 30-й стимул – на 20,6±7,6%; p<0,05), и латентного периода (ПО) (1-й стимул – на 1,6±0,3 мсек , 30-й стимул – на 1,8±0,15 мсек; p<0,05) и увеличению на 63±3% количества дополнительных (ПО) ( p<0,05) (рис. 1А).
Необходимо отметить, что циклогексимид, оставшийся в растворе ACSF после удаления Mg2+, не предупреждал появление эпилептиформной активности.
циклогексимид 30мкм + 0магния 30 поп.спайк
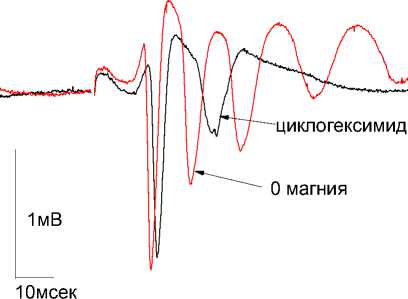
Рис. 1 А.
Во II серии экспериментов выявлено, что перфузия переживающих срезов раствором не содержащим Mg2+ (n=7) увеличивал амплитуду (ПО) (1-й стимул – на 16,9±6%, p<0,05 30-й стимул – на 20±2,1% (p ≤ 0,05), а латентный период (ПО) уменьшался (1-й стимул на 2,0±0,1 мсек, 30-й стимул – на 1,2±0,3 мсек; p<0,05) и увеличению на 63±3% количества дополнительных (ПО) ( p<0,05), (рис. 1Б)
Добавление в перфузионный раствор МК-801 в концентрации 50 мкМ приводило к возвращению латентного периода и величины (ПО) к контрольному. Причем наблюдалось постепенное уменьшение количества дополнительных (ПО) в зависимости от порядкового номера (от 1-го до 30-го) стимула, а через 40 минут после добавления оно значимо (p < 0,05) уменьшалось на 60±2% (рис. 1В)
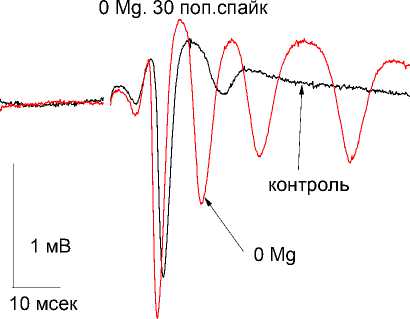
Рис. 1 Б. Влияние удаления из перфузионной среды Mg2+.
0 Mg + МК-801 50мкм 30 поп.спайк
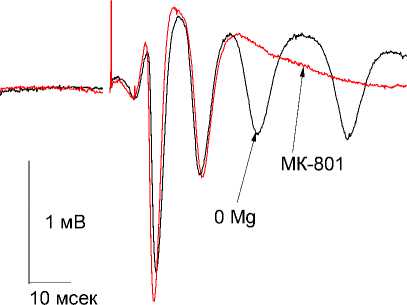
Рис. 1 В. Эффект добавления в перфузионную среду МК-801 в концентрации 50 мкМ.
Выводы:
Таким образом можно сказать, что блокада синтеза белка циклогексимидом в концентрации 30мкМ не нарушает нейропередачу в системе коллатерали Шаффера – пирамидные нейроны поля СА1 гиппокампа крыс, а в концентрации 200 мкМ почти полностью на 90% ингибирует ее, не вызывая эпилептиформной активности.
Необходимо отметить, что циклогексимид, остававшийся в растворе ACSF после удаления Mg2+, не предупреждал появление эпилептиформной активности. Этот факт говорит о том, что в данной концентрации блокада синтеза белка не влияет на NMDA рецепторный комплекс. Эпилептиформная активность, вызванная удалением Mg2+, уменьшает латентный период (ПО) и увеличивает число дополнительных популяционных ответов, а МК-801 возвращает эти показатели к контрольному уровню. Следовательно нейроны СА1 области гиппокампа опосредуют свое действие через NMDA – рецепторный комплекс.
Список литературы Исследование глютоматергического механизма действия NMDA рецепторного комплекса на безмагниевой модели возникновения эпилептиформной активности в Са1 области гиппокампа крыс
- Мотин В.Г.//Бюлл. экспер. биол. и мед. -2011. -Том 152, № 7. -С. 32-36.
- Arrigo A., Mormina E., Anastasi G.P. et al.//Front Hum Neurosci. -2014. -Vol. 8. -Р. 987.
- Wlodarczyk A.I., Xu C., Song I. et al.//Front. Neural. Circuits. -2013. -Dec. -Vol. 25, № 7. -Р. 205.
- Black S.A., Stys P.K., Zamponi G.W., Tsutsui S.//Front Cell. Dev. Biol. -2014. -№ 2. -Р. 45, DOI: 10.3389/fcell.2014.00045
- Bonaccorso C., Micale N., Ettari R. et al.//Curr Med Chem. -2011. -Vol. 18, No 36. -P. 5483-5506.
- Coras R., Pauli E., Li J. et al.//Brain. -2014. -Vol. 137, №7. -P. 1945-1957.
- Jalili C., Salahshoor M.R., Pourmotabbed A. et al.//Res Pharm Sci. -2014. -Vol. 9, № 5. -P. 351-358.
- Khodorov B.//Prog Biophys Mol Biol. -2004. -Vol. 86, № 2. -P. 279-351.
- Lai T.W., Zhang S., Wang Y.T.//Prog Neurobiol. -2014. -Vol. 115. -P. 157-88.
- Nyitrai G., Lasztóczi B., Kardos J.//Brain Res. -2010. -Vol. 1309. -P. 172-178.
- Tanaka K.Z., Pevzner A., Hamidi A.B. et al.//Neuron. -2014. -Vol. 84, № 2. -P. 347-354.
- Vyklicky V., Korinek M., Smejkalova T. et al.//Physiol. Res. -2014. -Vol. 63, Suppl. 1. -S. 191-203.


