Исследование и получение соединений карбоновых кислот из смол узгенских углей
Автор: Осекова Гулбара Арыновна, Ташполотов Ысламидин Ташполотович
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Технические науки
Статья в выпуске: 1 т.7, 2021 года.
Бесплатный доступ
Получен ацетат натрия из карбоновых кислот угольной смолы бурого угля методом нейтрализации. Получен уксусноэтиловый эфир из карбоновых кислот смолы узгенского бурого угля, этерификационным способом и низкотемпературным перегонным методом. Исследованы избытки карбоновых кислот и азиотропных веществ, сделана повторная очистка и получен чистый уксусноэтиловый эфир при температуре 77-78 °С.
Карбоксил, карбонил, эфиры, вытяжка, кристаллизация, смола, бурый уголь
Короткий адрес: https://sciup.org/14117938
IDR: 14117938 | УДК: 662.668 | DOI: 10.33619/2414-2948/62/32
Текст научной статьи Исследование и получение соединений карбоновых кислот из смол узгенских углей
Бюллетень науки и практики / Bulletin of Science and Practice
Известно, что из угля Сергеевского месторождения выделены две представительные группы органических кислот [1]. Первая — это карбоновые кислоты, содержащиеся в растворимой фракции угля (битумах). Вторая группа включает гуминовые кислоты, извлекаемые из остатка угольного вещества, нерастворимого в органических экстрагентах. Анализ группового состава свободных кислот свидетельствует о преимущественном значении насыщенных соединений нормального строения, более 50% которые приходится на карбоновые структуры С 8 –С 18 . Среди них преобладают кислоты, содержащие четное число углеродных атомов, однако доминирующую роль играет нечетный гомолог С 9 . В малых количествах присутствуют дикарбоновые кислоты изо-строения, ароматические соединения данной фракции представлены кислотами.
Выделение карбоновых кислот и других совместно полученных соединений проводим по методикам, описанным в работе [2]. Выделенную смесь карбоновых кислот растворяли в диэтиловом эфире (0,5–1,0 мл эфира на 1–2 мг смеси кислот) добавляем несколько капель метилового спирта и затем по каплям раствор диазометана, пока смесь не окрашивалось в желтый цвет. Смесь выдерживаем в течение 30 мин при комнатной температуре, после чего растворитель удаляем, пропуская через раствор окисления [3].
Смола узгенского угля отличается высоким содержанием воды. В смоле также содержится механические примеси. Определение содержание карбоновых кислот из смолы проводили по методике Стадникова.
Для определения карбоновых кислот эфирный раствор смолы переливали в делительную воронку емкостью 500 мл и туда же приливали 40–50 см3 NaHCO 3 . После чего смесь 3–4 раза не слишком энергично встряхивали и давали отстоять в течение 5 мин. Оставшихся нижний водный раствор натриевых солей органических кислот, сливали в колбу Эрленмейера емкостью 500 мл. Операцию извлечение карбоновых кислот повторяли 2 раза подобным же образом. Собранный от всех трех промывок содовой раствор экстрагировали серной кислотой. Эфирный слой возвращали в делительную воронку, а сам раствор осторожно обрабатывали 10% раствором серной кислоты. Промывали серным эфиром, отгоняли эфир на водяной бане.
Органические соединение, содержание в качестве функциональной группы карбоксил ♦ О с +
) носит название карбоновых кислот. В зависимости от характера радикала, с которым связана карбоксильная группа, различают кислоты предельные, непредельные, ароматические и др. По числу имеющихся в молекуле карбоновых групп их подразделяют на односновные, двухосновные и т. д.
Как в случае других функции, природа радикала, число и взаимное положение карбоксильных групп оказывают определенное влияние на свойства кислот, но все же они в первую очередь определяются функциональной группой [4].
о
—с
Рассматривая строение карбоксильной группы он можно увидеть, что формально оно является комбинацией двух уже рассмотренных функциональных групп-карбонильной и карбоксильной. Однако карбоксил не простая сумма двух упомянутых групп, это новая функция, со своими характерными свойствами, в которых ими отдаленно отражаются особенности «составных частей». Находясь в близком соседстве, группировки С=О и ОН друг на друга сильное взаимное влияние, общий характер которого можно предвидеть на основании того, что нам уже известно о группах С=О и О-Н.
Так становится понятной важнейшая химическая особенность соединений, содержащих карбоксильную функцию — проявление ими свойств кислот [5].
Экспериментальная часть
Для получения соединений карбоновых кислот, полученных из смол Узгенского угольного месторождения [2], предварительно сделали качественный и количественный анализ карбоновых кислот (уксусная кислота).
-
1. Качественный анализ
-
а) Взаимодействие растворимых карбоновых кислот с гидрокарбонатом натрия
приводит к выделению углекислого газа. Для этого берем 5 мл карбоновой кислоты, туда добавляем 0,5 г Na 2 CO 3 , бурно выделяется узгенский газ, на газовую трубку опускаем водный раствор гашенной извести, образуется мутный белый раствор.
-
1) Na 2 Co 3 +2HCOOH=2HCOONa+CO 2 ↑+H 2 O
-
2) Ca(OH) 2 +CO 2 =CaCO 3 + H 2 O
-
б) На карбоновые кислоты опускаем универсальный индикатор, который дает розовый цвет, лакмусовая бумага красный цвет, карбоновые кислоты обладают кислотными свойствами.
-
в) Карбоновые кислоты также можно определить путем идентификации по
-
2. Количественный анализ.
температуре. Для этого берем термостойкий стакан туда наливаем 50 мл карбоновой кислоты, ставим на плитку, который соединен терморегулятором ТКП-160-СЧ-М1, тогда увлажненный термометр показывает t пл — 16,75 °С, а температура кипения — t кип = 118 °С.
Для определения содержания карбоновых кислот титрование в неводных средах проводили с потенциометрическим методом с использованием в качестве индикаторного стеклянного электрода. В качестве электрода (для сравнения) применяли хлор серебряный электрод, и как электролитический мост, заполненный насыщенный раствор калия хлорида (это предотвращает попадание воды в титруемый раствор и возрастание электрического сопротивления моста в процессе титрования). Для эксперимента использовали универсальный pН метр ЭВ-74. Для проведения эксперимента сначала универсальный pН метр калибровали стандартными буферными раствором pН 1,65 и pН 9,18 при 20 °С температуре [6–7].
Для анализа берем 25 мл исследуемой пробы и титрируем раствором NaOH до значения pН 8,1, и записываем объем раствора, прошедший на титрование.
Обработка результатов
Сделаем расчет по следующей формуле:
V1 • C • M x=^
где V 1 — объем раствора гидроксида натрия прошедший на титрование, см3; С — точная концентрация раствора гидроксид натрия (NaOH) моль/дм3; V 0 — объем пробы образца взятый на титрование (как правило 25 см3) см3; М — Молярная масса г/моль равная для уксусной кислоты (М1/2 СН 3 СООН) = 60,50;
^ 1
V1 • C • M
V o
96^1,0^60,50
232,32 г\л
^ 2
98 • 1,0 • 60,50
= 237,16 г\л
^ 3
95^1,0^60,50
= 229,9 г\л
Хср = 233,11 г\л
1-й эксперимент. Получение ацетата натрия из карбоновых кислот.
В пробирку наливаем 0,5 мл из полученных карбоновых кислот [2] и добавляем 0,5 мл 10% раствора гидроксида натрия (NaOH), тогда происходит реакция нейтрализации с легким образованием солей, т. е. замена кислотного водорода на металл.
СНз-С^ +NaOH= СНз-С^ + Н2О ОН ONa
Полученный раствор сушили в водяной бане после этого сушили в сушильном шкафе при температуре 110 °С [8–9].
Карбоновая кислота и их соли применяются в медицине для консервирования продукт, и краски для текстильных изделий.
2-й эксперимент. Получение уксусно-этиловый эфир из карбоновых кислот из бурого угля Узгенского месторождения.
На колбу Вюрса с емкостью 100 мл наливаем 2,5 мл этиловый спирт. Добавляем 2,5 мл концентрированной серной кислоты (Н 2 SO 4 ) Хорошо перемешивают, колбу отпускают на водяную баню, закрепляют капельную воронку и соединяют водяной холодильник для перегонки низко кипящих жидкостей, и аллонжи и коническая колба для получения жидкостей. Водяная баня нагревают до 140 °С, через капельную воронку медленно капает 20 мл раствор этилового спирта и полученная карбоновая кислота [2] (1:1). Полученный жидкость (этиловый эфир) поступают на коническую колбу. Проверяем излишки карбоновой кислоты лакмусовой бумагой, добавляем раствор соды, чтобы получить чистый этиловый эфир, в водяной бане нагреваются при температуре 77–78 °С. Сделанный химический процесс называют реакцией этерификация.
СН3—сГ +СгН5ОН--2—^ СНзСГ +НгО он О—с2Н5
Уксусно-этиловый эфир применяются для получения мыла — синтетические моющие средства [9].
Для получения уксусно-этиловый эфир сделана следующая установка, представленная на Рисунке 1 и схема эксперимента — на Рисунке 2.
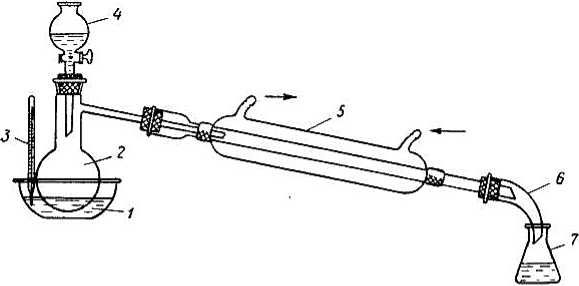
Рисунок 1. Лабораторная установка для получения уксусноэтилового эфира из карбоновых кислот: 1 — водяная баня, (электроплитка), 2 — колба Вюрца, водяная баня, 3 — термометр, 4 — капельная воронка, 5 — холодильник, 6 — аллонж, 7 — коническая колба.
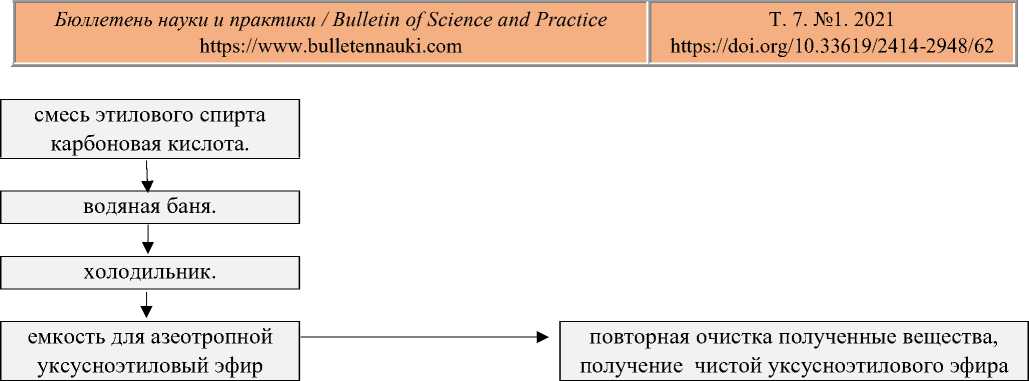
Рисунок 2. Технологическая схема получения уксусноэтилового эфира из карбоновых кислот.
Выводы:
-
1. Исследован и получен ацетат натрия из карбоновых кислот из угольной смолы Узгенского бурого угля, методом нейтрализации, сушили и получили кристаллы.
-
2. Выполнен качественный и количественный анализ по определению уксусной кислоты.
-
3. Получен уксусно-этиловый эфир из карбоновых кислот из смолы Узгенского бурого угля низкокипящим перегонным методом и экспериментально проверен избыток карбоновых кислот и азеотропных веществ. Выполнена повторная очистка полученных веществ и получен уксусноэтиловый эфир при температурном режиме 77–78 °С.
Список литературы Исследование и получение соединений карбоновых кислот из смол узгенских углей
- Носкова Л. П. Групповой состав кислот низкокалорийного угля // Фундаментальные исследования. 2015. №9-3. С. 497-501.
- Осекова Г. А., Ташполотов Ы. Т., Ысманов Э. М. Исследование содержания карбоновых кислот в смоле узгенского угля // Бюллетень науки и практики. 2019. Т. 5. №12. С. 242-245. DOI: 10.33619/2414-2948/49/28
- Рокосов Н. Н., Рокосов Ю. В. Карбонове кислоты в битумоидах сапропелитов // Химия твердого топлива. 2012. №4. С. 15-22.
- Ерыгев М. А. Кожевникова И. В. Особенности физико-химического исследования карбоновых кислот // Современные тенденции в науке и образовании. 2017. №4. С. 47-51.
- Смит М. Органическая химия. М., 2020. 458 с.
- Васильев В. П. Аналитическая химия. М.: Дрофа, 2002. 384 с.
- Цитович И. К. Аналитическая химия. М.: Высшая школа, 1985. 319 с.
- Понамарев С. В., Золотарев А. С., Сачинова Л. Г., Теренин В. И. Практикум по органической химии. М., 1999.
- Исраилов И., Хакимов Ю. Р. Практикум по органической химии для товароведов, Ташкент, 1983. 208 с.


