Исследование и разработка программы термодинамического расчета восстановления хрома в руднотермических печах
Автор: Каскин Куат Камарович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 15 (274), 2012 года.
Бесплатный доступ
Разработана программа для термодинамического расчета восстановления хрома в руднотермических печах.
Термодинамический расчет, хромовая руда
Короткий адрес: https://sciup.org/147156726
IDR: 147156726 | УДК: 669.243
Текст научной статьи Исследование и разработка программы термодинамического расчета восстановления хрома в руднотермических печах
В работах [1, 2] приведены результаты выплавки хромоникелевого полупродукта, содержащего до 20 % Cr и около 10 % Ni, в полупромышленной рудовосстановительной печи мощностью 1,2 МВ∙А с использованием в шихте металлизо-ванных железорудных окатышей, хромовой руды, кокса и закиси никеля. По ходу опытных кампаний концентрация углерода в полупродукте, постепенно увеличиваясь, достигла 3,5–3,91 %, то есть превышала оптимальные его содержания в металле, в дальнейшем подвергаемом аргоно-кислородному рафинированию. В связи с этим возникла необходимость теоретически проанализировать полученные результаты и установить возможность выплавки в рудовосстановительных печах полупродукта с более низким содержанием углерода.
Рассматриваемая технология выплавки хромистого полупродукта в принципе отличается от технологии производства углеродистого феррохрома только содержанием хрома в шихте и готовом расплаве. Однако в теории ферросплавного производства восстановление хрома твердым углеродом, в частности на заключительной стадии, описывается только общей схемой ее уточнения термодинамическим анализом и количественными расчетами, поэтому целью настоящей работы является разработка компьютерной программы по восстановлению хрома.
В монографии [3] рассмотрены первые стадии твердофазного восстановления хромита FeO·Cr2O3, как основного минерала хромистых руд. Первоначально до металла восстанавливается только железо, а оксид хрома преобразуется в стойкие при высоких температурах карбиды Cr 23 C 6 , Cr 7 C 3 и Cr 3 C 3 .
Стандартная свободная энергия образования этих карбидов примерно одинаковая и в интервале
1403–1430 К парциальное давление равно 100 кПа (1 атм). Это позволяет принять для термодинамических расчетов любой карбид хрома. Авторы работы [3] отдают предпочтение карбиду Cr 7 C 3 , образующемуся в широком интервале концентраций хрома в сплаве. По их мнению, карбид Cr 7 C 3 взаимодействует с невосстановленным оксидом хрома Cr2O3 как при непосредственном контакте в нижней части колошника, так и в рудном слое, образующемся на границе шлака с металлом при наличии в шихте кусковой хромистой руды по реакции
1/30^ + 1/3C 7 C 3тв = 3[Cr] + CO. (1)
Естественно, что образующийся здесь металлический хром растворяется в жидком металле.
Присутствие тугоплавких металлов в рудном слое легко объяснимо. На первой стадии твердофазного восстановления хромита образуется металлическое железо. Однако сам процесс его образования в связи с необходимостью перестройки кристаллических решеток растягивается во времени [4] и по высоте колошника. Науглероженное и плавящееся железо стекает с кусков руды в горн печи, по пути только частично растворяя образовавшиеся карбиды хрома. При отсутствии рудного слоя процесс растворения карбидов в жидком металле, по-видимому, завершается в горне печи.
На границе рудного слоя с металлом в том же температурном интервале наряду с реакцией (1) не исключено и развитие реакции взаимодействия оксида хрома с растворенным в металлической фазе углеродом, контролируемой, как и в первом случае, парциальным давлением оксида углерода:
13 СГ 2 О 3ТВ + [C] i% = 2/3 [Cr] i% + CO, (2) т. е. протекание этих реакций взаимно увязано. Стандартная свободная энергия реакции (1) A G T
Таблица 1
Использованные экспериментальные данные
A G T (1) = 87136 - 70,83 Т ,
1g K p 0) = 3lg a Cr + 1g P CO =-- — +15,482.
Для реакции (2) по тем же данным A G T (2) = 58 770 - 35,57 Т , lg K p (2) = 2/3 lg a Cr + lg a C - lg P CO =
12 846
T
+ 8,212,
где a Cr и a C – активность хрома и углерода в расплаве.
Приравнивая выражение lg PCO по уравнениям (3) и (4), получим lg aC = [lg Kp(1) - lg Kp(2)] - 2,33lg aCr. (5)
Параметр взаимодействия eCCrr , судя по данным последних исследований [6], равен 3∙10–4, т. е. находится в пределах точности определения. Поэтому активность хрома aCr можно приравнять к его концентрации в сплаве. В области концентрации хрома до 20 %, наоборот, коэффициент активности углерода fC установлен достаточно точно и для сплавов Fe–Cr–Ni–C может быть представлен выражением lg fc = ec [% C] + eCr [% Cr] + eNi [% Ni] =
= 0,14[% C] - 0,024[% Cr] + 0,012[% Ni]. (6)
Приравнивая правые части уравнения (5) и выражения lg aC = lg [%C] + lg fC после подстановки в него значения fC из уравнения (6), получим уравнение для расчета равновесной концентрации углерода в металле lg[% C] + eC [% C] + eCr [% Cr] + eNi [% Ni] =
= [lg Kp (1) - lg K p ( 2) ] - 2,33lg a Cr . (7)
Всего на шихте с повышенным содержанием хрома (18 % по расчету) было проведено две полупромышленные кампании, отличавшиеся только использованием пылеватой (1-я кампания) или кусковой хромитовой руды (2-я кампания). Через каждые 3–4 часа выпускали из печи шлак и ме- талл, на желобе измеряли его температуру и загружали следующую порцию шихты. Высота слоя шихты на колошнике постепенно возрастала. Состав металла, его температура и расчетное содержание углерода в сплаве, подсчитанное на ЭВМ по уравнению (7) (табл. 1).
Приведенные результаты свидетельствуют о том, что по мере приближения к непрерывному процессу увеличивалась степень восстановления хрома и расчетные значения концентраций углерода в металле приближалась к фактическим. Относительное отклонение фактических и расчетных концентраций углерода в расплаве в этом случае 11,5 и 18,2 %, что подтверждает наш термодинамический расчет. При работе на пылевидных рудах в неустановившемся режиме работе печи нет и такого совпадения.
Таким образом, предложенный нами метод расчета применим только для тех условий, когда на границе металла и шлака, т. е. в рудном слое (рис. 1), присутствует непрореагировавший оксид хрома.

Рис. 1. Структура металла при выплавке хромистых сплавов: 1 – слой шихтовых материалов; 2 – полу-расплавленная масса; 3 – слой легкоплавкого шлака; 4 – слой плотного шлака; 5 – рудный слой; 6 – металл; 7 – «королек» металла; 8 – газовая полость
При использовании пылевидных руд типичный рудный слой отсутствует. Однако баланс хрома в шихте, в металле и в шлаке перед первым и вторым выпусками первой кампании обнаружил постепенное накопление в печи значительных количеств оксида хрома, не успевшего в наших условиях перейти на колошнике в карбид. Накопившийся к третьему выпуску в печи твердый оксид вступил в активное взаимодействие с углеродом металла, чем и объясняется совпадение в этом случае расчетных и экспериментальных данных.
Таким образом, высказанное предположение об одновременном развитии в рудном слое непрерывно действующих руднотермических печей процессов восстановления оксида Cr 2 O 3 до металла как за счет растворенного в нем углерода, так и в результате твердофазного взаимодействия оксида и карбидов хрома, достаточно обоснованно и позволяет количественно оценить активность и концентрацию углерода в металле.
Составляем таблицу для нахождения для реакции (1) изменения энтальпии, энтропии и температурных коэффициентов (табл. 2), затем производим термодинамический анализ.
В связи с этим предлагается программа, разработанная в среде Delphi 7 «Термодинамический расчет металлургических процессов» (рис. 2), которая позволяет: провести аналитический расчет в интервалах температур 400–3000 К с шагом в 50° с графическим изображением системы по данным расчета, что позволяет автоматизировать процесс расчета уравнений любых химических реакций, рассчитывая выход реакции.
На рис. 2, 3 представлена компьютерная программа термодинамического расчета.
Из анализа аналитических данных следует, что в температурном интервале 400–2400 К энергия Гиббса до 2100 К больше нуля, а константа равновесия меньше единицы. Следовательно, в температурном интервале 400–2100 К реакция твердофазного восстановления хрома находится в устойчивом равновесии.
На основе аналитического расчета определяем среднее Δ Н графическим методом.
В верхней части окна (рис. 4) расположен график зависимости ln K p = f (1/ T ), в нижней части среднее Δ Н аналитического и графического методов расчета для сравнения. Для того чтобы на графике увидеть температурную точку твердофазного восстановления хрома, выбираем режим «Анализ графика» .
В нижней части окна (табл. 3) показываются средние значения Δ Н и Δ S .
Таким образом, на основании аналитического и графического расчетов получаем уравнение свободной энергии
Δ G = 1 025 301,5 – 493,1429 T , Дж.
Из анализа (рис. 4, 5) следует, что реакция твердофазного восстановления хрома начинается при 1560 К, при расчете реакции (1) производим полный термодинамический анализ реакции (2).
Таблица 2
|
Реагент |
A H 298 , кДж/моль |
A S 298 , Дж/моль·К |
Δ С р = f ( T ), кДж/моль∙К |
||
|
Δ a 0 |
Δ a 1 ·103 |
Δ a –2 ·10–5 |
|||
|
9Cr |
0 |
212,76 |
219,87 |
88,83 |
–33,12 |
|
3CO |
–331,59 |
592,65 |
85,23 |
12,3 |
–1,38 |
|
∑ прод. реак |
–331,59 |
805,41 |
305,1 |
101,13 |
–34,5 |
|
Cr 2 О 3 |
–1140,56 |
81,177 |
119,37 |
9,2 |
–15,65 |
|
Cr 7 C 3 |
–228,35 |
201,12 |
238,66 |
60,92 |
–42,4 |
|
∑ исх. реаг |
–1368,91 |
282,29 |
358,03 |
70,12 |
–58,05 |
|
∑ прод – ∑ исх |
1037,32 |
523,12 |
–52,93 |
31,01 |
23,55 |
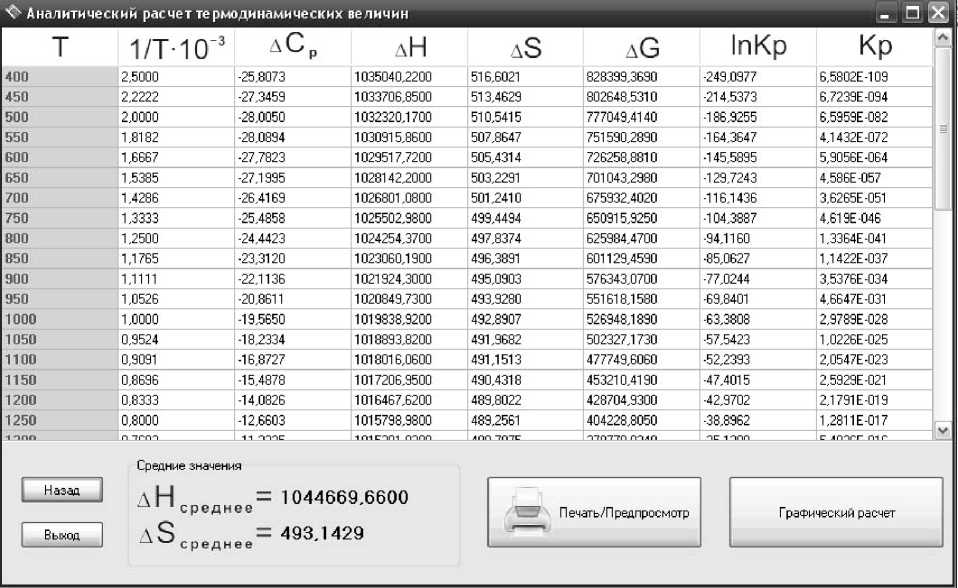
Рис. 4. Аналитический расчет термодинамических величин
Таблица 3
|
T |
1/ T ∙10–3 |
Δ C p |
Δ H |
Δ S |
Δ G |
ln K p |
K p |
|
400 |
2,5 |
–25,8073 |
1035040 |
516,6021 |
828397,8024 |
–249,217 |
6,8394E–109 |
|
450 |
2,222222 |
–27,3459 |
1033707 |
513,4629 |
802679,2423 |
–214,649 |
6,01457E–94 |
|
500 |
2 |
–28,005 |
1032320 |
510,5415 |
777048,841 |
–187,015 |
6,02919E–82 |
|
550 |
1,818182 |
–28,0894 |
1030916 |
507,8647 |
751599,8741 |
–164,446 |
3,82E–72 |
|
600 |
1,666667 |
–27,7823 |
1029518 |
505,4314 |
726256,0252 |
–145,659 |
5,50907E–64 |
|
650 |
1,538462 |
–27,1995 |
1028142 |
503,2291 |
701039,0602 |
–129,786 |
4,31179E–57 |
|
700 |
1,428571 |
–26,4169 |
1026801 |
501,241 |
675930,5618 |
–116,199 |
3,43038E–51 |
|
750 |
1,333333 |
–25,4858 |
1025503 |
499,4494 |
650903,3898 |
–104,437 |
4,40151E–46 |
|
800 |
1,25 |
–24,4423 |
1024254 |
497,8374 |
625981,0656 |
–94,1608 |
1,27785E–41 |
|
850 |
1,176471 |
–23,312 |
1023060 |
496,3891 |
601105,4987 |
–85,1002 |
1,10012E–37 |
|
900 |
1,111111 |
–22,1136 |
1021924 |
495,0903 |
576327,9454 |
–77,0595 |
3,41576E–34 |
|
950 |
1,052632 |
–20,8611 |
1020850 |
493,93 |
551587,6895 |
–69,8699 |
4,52794E–31 |
|
1000 |
1 |
–19,565 |
1019839 |
492,8907 |
526939,056 |
–63,4102 |
2,89258E–28 |
|
1050 |
0,952381 |
–18,2334 |
1018894 |
491,9682 |
502300,553 |
–57,567 |
9,97665E–26 |
|
1100 |
0,909091 |
–16,8727 |
1018016 |
491,1513 |
477745,9113 |
–52,2641 |
2,00447E–23 |
|
1150 |
0,869565 |
–15,4878 |
1017207 |
490,4318 |
453186,4953 |
–47,4218 |
2,5408E–21 |
|
1200 |
0,833333 |
–14,0826 |
1016468 |
489,8022 |
428703,2332 |
–42,9907 |
2,1349E–19 |
|
1250 |
0,8 |
–12,6603 |
1015799 |
489,2561 |
404204,605 |
–38,9126 |
1,2603E–17 |
|
1300 |
0,769231 |
–11,2235 |
1015202 |
488,7875 |
379774,8091 |
–35,1546 |
5,40213E–16 |
|
1350 |
0,740741 |
–9,77432 |
1014677 |
488,3911 |
355317,2706 |
–31,6724 |
1,75725E–14 |
|
1400 |
0,714286 |
–8,31447 |
1014225 |
488,062 |
330921,4106 |
–28,4443 |
4,43386E–13 |
|
1450 |
0,689655 |
–6,8454 |
1013846 |
487,7958 |
306498,3428 |
–25,4366 |
8,97478E–12 |
|
1500 |
0,666667 |
–5,36833 |
1013540 |
487,5886 |
282130,8235 |
–22,6338 |
1,47995E–10 |
|
1550 |
0,645161 |
–3,88427 |
1013309 |
487,4368 |
257742,7206 |
–20,0103 |
2,04002E–09 |
|
1600 |
0,625 |
–2,39408 |
1013152 |
487,337 |
233405,2544 |
–17,5545 |
2,3777E–08 |
|
1650 |
0,606061 |
–0,89849 |
1013070 |
487,2862 |
209018,7213 |
–15,244 |
2,3966E–07 |
Окончание табл. 3
|
T |
1/ T ∙10–3 |
Δ C p |
Δ H |
Δ S |
Δ G |
ln K p |
Kp |
|
1700 |
0,588235 |
0,601879 |
1013062 |
487,2816 |
184676,7822 |
–13,0726 |
2,10202E–06 |
|
1750 |
0,571429 |
2,10648 |
1013130 |
487,3208 |
160286,1771 |
–11,0219 |
1,63397E–05 |
|
1800 |
0,555556 |
3,614852 |
1013273 |
487,4013 |
135934,837 |
–9,08777 |
0,00011304 |
|
1850 |
0,540541 |
5,126593 |
1013491 |
487,5209 |
111546,3235 |
–7,88312 |
0,000377056 |
|
1900 |
0,526316 |
6,641355 |
1013785 |
487,6777 |
87192,9432 |
–5,52239 |
0,003996304 |
|
1950 |
0,512821 |
8,158829 |
1014155 |
487,8699 |
62789,12418 |
–3,8748 |
0,020758582 |
|
2000 |
0,5 |
9,67875 |
1014601 |
488,0956 |
38416,05 |
–2,31144 |
0,099118912 |
|
2050 |
0,487805 |
11,20088 |
1015123 |
488,3533 |
13973,34038 |
–0,82025 |
0,440322297 |
|
2100 |
0,47619 |
12,72501 |
1015722 |
488,6415 |
–10443,521 |
–2,28612 |
0,101660536 |
|
2150 |
0,465116 |
14,25096 |
1016396 |
488,9588 |
–34907,22563 |
1,953781 |
7,055312321 |
|
2200 |
0,454545 |
15,77857 |
1017147 |
489,3039 |
–59348,463 |
3,246278 |
25,69453878 |
|
2250 |
0,444444 |
17,30769 |
1017974 |
489,6756 |
–83814,37175 |
4,482651 |
88,46891525 |
|
2300 |
0,434783 |
18,83818 |
1018877 |
490,0728 |
–108259,9083 |
5,664203 |
288,3580132 |
|
2350 |
0,425532 |
20,36994 |
1019858 |
490,4943 |
–132804,8005 |
6,800563 |
898,3531936 |
|
2400 |
0,416667 |
21,90285 |
1020914 |
490,9392 |
–157334,4152 |
7,888809 |
2667,266453 |
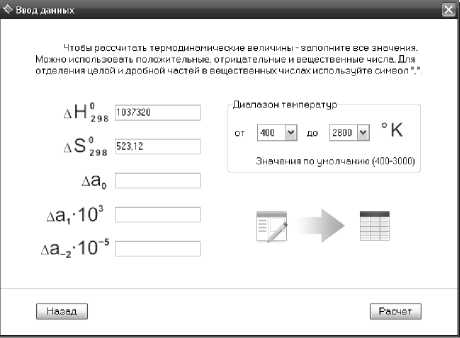
Рис. 3. Окно ввода данных
Рис. 2. Главное окно программы
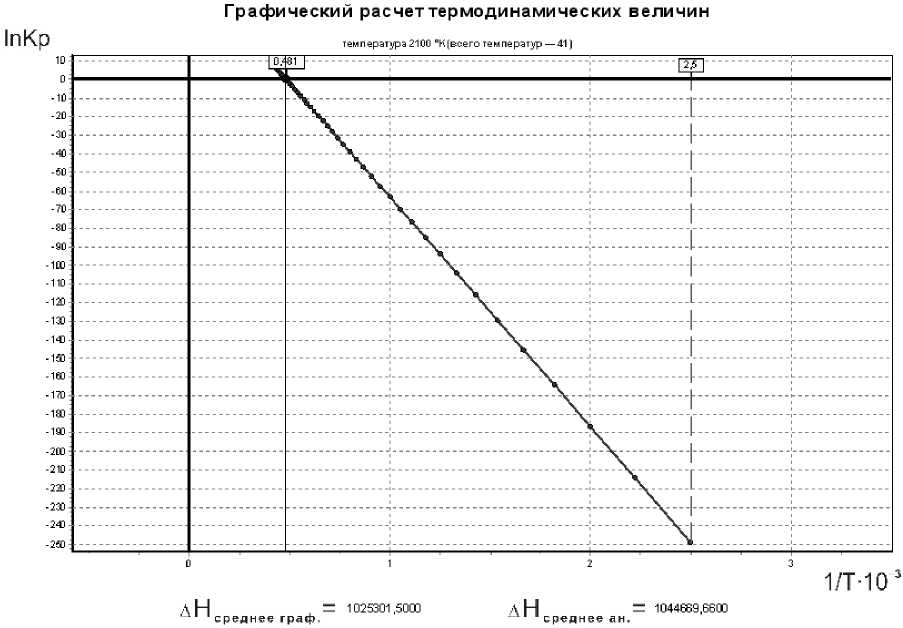
Рис. 5. Графический расчет
Из анализа аналитических данных следует, что в температурном интервале 400–2400 К энергия Гиббса до 1550 К больше нуля, а константа равновесия меньше единицы. Следовательно, в температурном интервале 400–1550 К реакция восстановления хрома находится в устойчивом равновесии.
Процесс восстановления хрома идет самопроизвольно только после 1550 К. Таким образом на основании аналитического и графического расчетов, получаем уравнение свободной энергии:
Δ G = 800 340,266 – 513,0249 T , Дж.
Из анализа (рис. 6) следует, что реакция твердофазного восстановления хрома начинается при 1560 К.
Таким образом, в настоящей работе в результате анализа технологических параметров выплавки хромоникелевого полупродукта с помощью разработанной компьютерной программы термо-
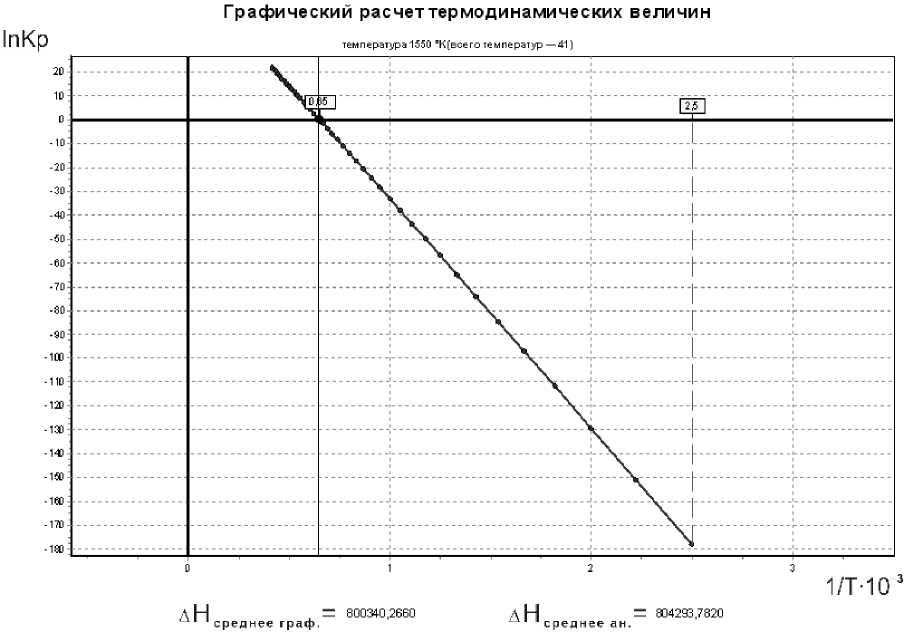
Рис. 6. Графический расчет
динамического расчета восстановления хрома установлено следующее.
-
1. Твердофазное восстановление хрома начинается при 1560°К согласно графического (рис. 5, 6) и термодинамического расчетов (см. рис. 2–4) компьютерной программы.
-
2. Высказанное предположение об одновременном развитии в рудном слое непрерывнодействующих процессов восстановления оксида до металла как за счет растворенного в нем углерода, так и в результате взаимодействия оксида и карбидов хрома достаточно обосновано.
-
3. Предложенные расчетные уравнения позволяют количественно оценить активность и концентрацию углерода в металле.
-
4. Установлено, что по мере приближения к непрерывному процессу увеличилась степень восстановления хрома, а расчетные значения концентрации углерода в металле на разработанной компьютерной программе приближались к фактическим.
-
5. Результаты, полученные с использованием данной программы, позволяют провести аналитический расчет в интервале температур 400–2000 К с шагом 50°, с графическим изображением системы по данным расчета, что позволяет автоматизировать процесс расчета уравнений любых химических реакций и произвести расчет выхода реакций.
Список литературы Исследование и разработка программы термодинамического расчета восстановления хрома в руднотермических печах
- Кадарметов, А.Х. Выплавка хромоникелевого продукта непрерывным процессом/А.Х. Кадарметов, К.К. Каскин, А.Н. Учаев//Повышение качества и эффективности производства электростали: науч. тр. НИИМ. -Челябинск: Металлургия. Челябинское отделение, 1989.
- Каскин, К.К. Разработка программы термодинамического расчета восстановления хрома в руднотермических печах/К.К. Каскин, Ч.А. Ахметов//Научно-технический прогресс в металлургии: тр. V Междунар. науч.-практ. конф. МОН РК. -Темиртау, 2009.
- Гасик, М.И. Теория и технология производства ферросплавов/М.И. Гасик, Н.П. Лякишев, Б.И. Емлин. -М.: Металлургия, 1988. -784 с.
- Гельд, П.В. Процессы высокотемпературного восстановления/П.В. Гельд, О.А. Есин. -Свердловск: Металлургиздат, 1957. -646 с.
- Туркдоган, Е.Т. Физическая химия высокотемпературных процессов/Е.Т. Туркдоган. -М.: Металлургия, 1985. -344 с,
- Григорян, В.А. Теоретические основы электросталеплавильных процессов/В.А. Григорян, Л.Н. Белянчиков, А.Я. Стомахин. -М.: Металлургия, 1979. -256 с.


