Исследование и сравнительный анализ коррозионной стойкости медно-цинковых сплавов в хлорсодержащих средах
Автор: Левин Д.О., Усов Д.А., Шевченко К.А., Стругов С.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.23, 2023 года.
Бесплатный доступ
В настоящей работе приведены результаты исследований электродного потенциала α-, β- и (α+β)-латуней, определены токи коррозии в хлорсодержащих средах, проведены испытания по их обесцинкованию в растворе хлорида меди. С целью более глубокого изучения свойств латуни были определены токи коррозии и электродный потенциал в хлорсодержащих средах для чистых металлов - меди и цинка. В ходе работы были построены графики зависимости потенциала меди, цинка, α-, β- и (α+β)-латуней от времени травления в растворах хлорида натрия и растворе хлорида натрия с добавлением хлорида аммония. Определены токи коррозии в растворе хлорида натрия: для меди (38 мкА), α-латуни (70 мкА), (α+β)-латуни (113 мкА), β-латуни (88 мкА) и в растворе хлорида натрия с добавлением хлорида аммония: для меди (14 мкА), цинка (71 мкА), α-латуни (37 мкА), (α+β)-латуни (44 мкА), β-латуни (42 мкА). По результатам исследования стойкости сплавов к обесцинкованию были получены следующие данные: глубина обесцинкования α-латуни - 450-500 мкм, α+β - 950-1000 мкм, β - 600-700 мкм. Результаты исследований токов коррозии в хлорсодержащих средах соотносятся с результатами экспериментов по обесцинкованию. Проведенные исследования подтверждают предположение о том, что в двойных латунях α- и β-фазы образуют коррозионный элемент за счет разницы химического состава и, следовательно, разных электродных потенциалов, что приводит к потере цинка в несколько большей степени, чем в β-латуни.
Электродный потенциал, ток коррозии, обесцинкование, шаровой кран
Короткий адрес: https://sciup.org/147243225
IDR: 147243225 | УДК: 673.15, | DOI: 10.14529/met230401
Текст научной статьи Исследование и сравнительный анализ коррозионной стойкости медно-цинковых сплавов в хлорсодержащих средах
В рамках продолжения исследования коррозионной стойкости медно-цинковых сплавов следует отметить, что чаще всего для производства трубозапорной арматуры используется двухфазная (α+β)-латунь [1–3]. Использование двухфазных латуней наиболее целесообразно в массовом производстве, так как это наиболее выгодно с экономической точки зрения (процентное содержание Cu меньше, чем в α-латуни) обладает более высокими прочностными характеристиками в холодном состоянии. В сравнении с β-латунью сплав (α+β)-латуни более благоприятно обрабатывается давлением [4–7]. Для полноты эксперимента и с целью более глубокого анализа процесса обесцинкования большое значение имеет исследование коррозионной стойкости α-, β- и (α+β)-латуней в различных средах.
В данной работе приводятся результаты изучения обесцинкования α-, β- и (α+β)-лату-ней, исследование их электродного потенциала, а также электродного потенциала Cu и Zn в хлорсодержащих средах [8–9]. Также в рамках работы определены токи коррозии Cu, Zn и α-, β- и (α+β)-латуней.
Методы
Для реализации поставленных задач были выплавлены латунные слитки определенного химического состава. В качестве шихты для получения лабораторных образцов применялись медь М1 ГОСТ 859–2014 [10], цинк гранулированный Ч по ТУ6-09-5294-86. Химический состав слитков приведен в табл. 1.
С целью определения коррозионной стойкости было проведено обесцинкование латун- ных образцов по ГОСТ 28057–89. Методика проведения обесцинкования представлена в работе [11].
Исследование микроструктуры проводили на металлографическом инвертированном микроскопе Альтами МЕТ 1T.
Для определения электродного потенциала использовались образцы латуней, указанных в табл. 1, и дополнительно были отлиты слитки из меди М1 ГОСТ 859–2014 и цинка гранулированного чистого по ТУ 6-09-5294-86. Слитки протачивались в ∅ 20 мм, длиной 120 мм. После промывки, обезжиривания образцы залили эпоксидной смолой. Торец полученных электродов шлифовали и полировали с дальнейшим обезжириванием, после чего проводили электрохимическое исследование.
Электрохимические исследования по изучению электродных потенциалов проводили в растворах 0,5 М NaCl и 0,493 М NaCl + + 0,007 M NH 4 Cl при помощи потенциостата-гальваностата. Химический стакан с 250 мл рабочего раствора помещали в термостат и выдерживали при 25 °С в течение 30 мин. После проведения термостатирования в рабочий раствор помещали хлорсеребряный электрод и экспериментальный подготовленный электрод. Потенциал измеряли при постоянном перемешивании 300 об/мин.
Определение поляризационных диаграмм проводили в растворах 0,5 М NaCl и 0,493 M NaCl + 0,007 M NH 4 Cl при помощи потенциостата-гальваностата. 250 мл раствора наливали в химический стакан и помещали в термостат, далее выдерживали его при 25 °С в течение 30 мин. Исследования проводили при постоянном перемешивании 300 об/мин в
Таблица 1
Химический состав исследованных лабораторных сплавов
Table 1
Chemical composition of the studied laboratory alloys
Результаты
По результатам обесцинкования были подготовлены шлифы поперечной плоскости образцов. Фотографии поверхности шлифов лабораторных образцов после обесцинкования представлены на рис. 1, где а – α-латунь, b – (α+β)-латунь, c – β-латунь (химический состав указан в табл. 1).
Величина обесцинкования образцов на рис. 1: а – 450–500 мкм, b – 950–1000 мкм, c – 600–700 мкм.
Ниже приведены результаты исследований электродного потенциала меди, цинка и латуней, указанных в табл. 1.
На рис. 2 представлена зависимость по- тенциала меди от времени выдержки в коррозионной среде 0,5 М NaCl и 0,493 M NaCl + + 0,007 M NH4Cl.
Начальное значение потенциала меди в растворе 0,5 М NaCl наблюдается при 50 мВ, далее происходит смещение потенциала в анодную область в течение 50 мин с выходом на стационарные значения потенциала при –10 мВ. На зависимости наблюдается локальный минимум в течение первых 5 мин коррозии, данное явление, по-видимому, связано локальной неоднородностью поверхности.
Потенциал меди в растворе 0,493 М NaCl + + 0,007 М NH 4 Cl принимает начальное значение при –20 мВ. При 5 мин выдержки в коррозионной среде наблюдается точка перегиба значений потенциала (–33 мВ). Далее в течение 1,5 ч потенциал смещается в катодную область и принимает стационарное значение при –20 мВ.



a) b) c)
Рис. 1. Изображения шлифов после проведения обесцинкования с разными фазами: a – α-латунь; b – (α+β)-латунь; c – β-латунь
Fig. 1. Images of sections after dezincification with different phases: a – α-brass, b – α+β-brass, c – β-brass
Стационарное значение потенциала меди в растворе 0,493 М NaCl + 0,007 М NH 4 Cl смещено в анодную область на 10 мВ
На рис. 3 представлены зависимости потенциала цинка от времени травления в коррозионной среде 0,5 М NaCl и 0,493 М NaCl + + 0,007 М NH 4 Cl.
Начальное значение потенциала цинка в растворе 0,5 М NaCl наблюдается при –764 мВ. При протекании коррозии цинка значения по- тенциала равномерно смещаются в анодную область до значений потенциалов –790 мВ. Далее значения потенциала цинка выходят на плато и не изменяются со временем.
Начальное значение потенциала цинка в растворе 0,493 М NaCl + 0,007 М наблюдаются при –772 мВ. В течение первого часа травления значения потенциала проходят локальный минимум. Далее значения потенциала цинка монотонно смещаются в анодную об-
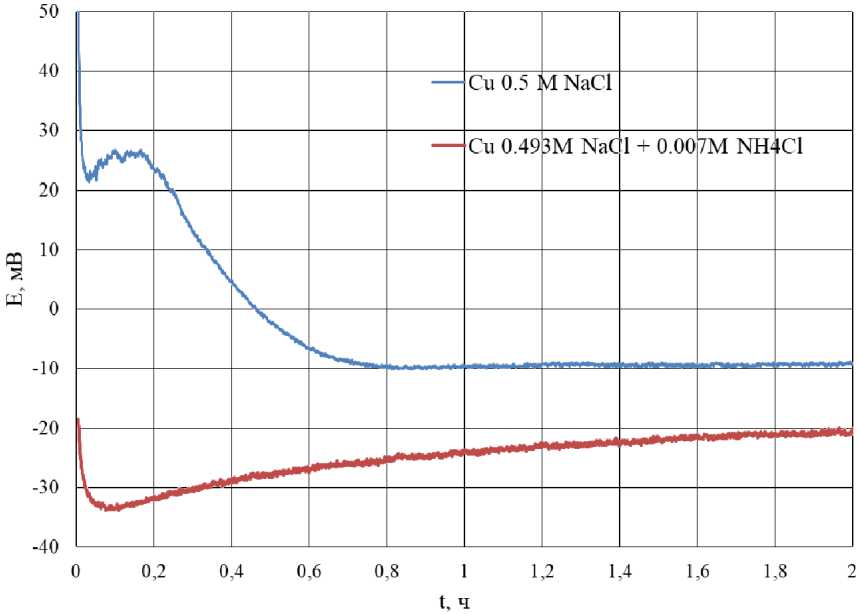
Рис. 2. Зависимость потенциала меди от времени травления в коррозионной среде 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl Fig. 2. Dependence of copper potential on etching time in a corrosive environment of 0.5 M NaCl and 0.493 M NaCl + 0.007 M NH 4 Cl
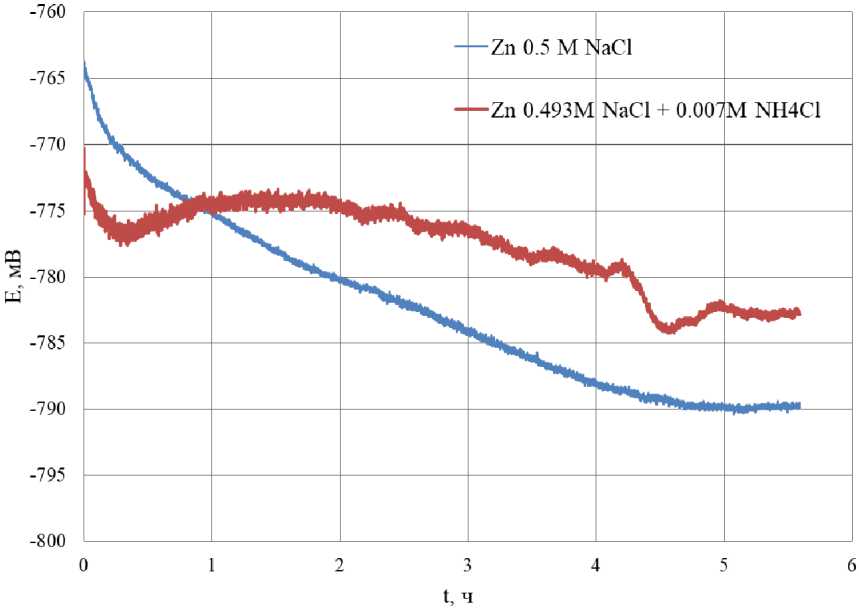
Рис. 3. Зависимость потенциала цинка от времени травления в коррозионной среде 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl Fig. 3. Dependence of zinc potential on etching time in a corrosive environment of 0.5 M NaCl and 0.493 M NaCl + 0.007 M NH 4 Cl
ласть в течение 4 ч. При 4,5 ч травления наблюдается второй локальный минимум с последующим выходом значений потенциала на плато при –782 мВ.
Значение потенциала цинка в растворе 0,5 М NaCl по истечении 5,5 ч травления смещаются в анодную область на 18 мВ относительно значений потенциала цинка в растворе 0,493 М NaCl + 0,007 М.
На рис. 4 представлена зависимость потенциала α-, β-, (α+β)-латуни от времени травления в коррозионной среде 0,5 М NaCl.
У всех трёх видов латуни наблюдаются схожие виды зависимости потенциала от времени травления. На первом этапе происходит смещение потенциала в анодную область, по-видимому, происходит активация латуни. Время, за которое происходит активация латуни, не одинаково для всех 3 видов, быстрее всех в активное состояние переходит (α+β)-латунь (10 мин), далее β-латунь (40 мин), медленнее всех переходит α-латунь (100 мин), при этим потенциалы принимают следующие значения: α – –15 мВ, β – –79 мВ, α+β – –54 мВ.
Далее наблюдается момент изменения направления потенциала в катодную область. Вид облагораживания потенциала для α- и β-латуни имеет равномерный характер, а облагораживание потенциала (α+β)-латуни происходит скачкообразно. Для (α+β)-латуни наблюдается выход потенциала на стационарные значения, при этом по истечении времени эксперимента всё ещё происходит смещение потенциала α-латуни и β-латуни в катодную область. Потенциалы α-, β- и (α+β)-латуни по истечении 7 ч выдержки в коррозионной среде равны соответственно –21, –66, –27 мВ.
В табл. 2 представлены значения времени активации латуни, потенциал активации, потенциал латуни через 7 ч выдержки в коррозионной среде.
На рис. 5 представлена зависимость потенциала латуни различного состава от вре-
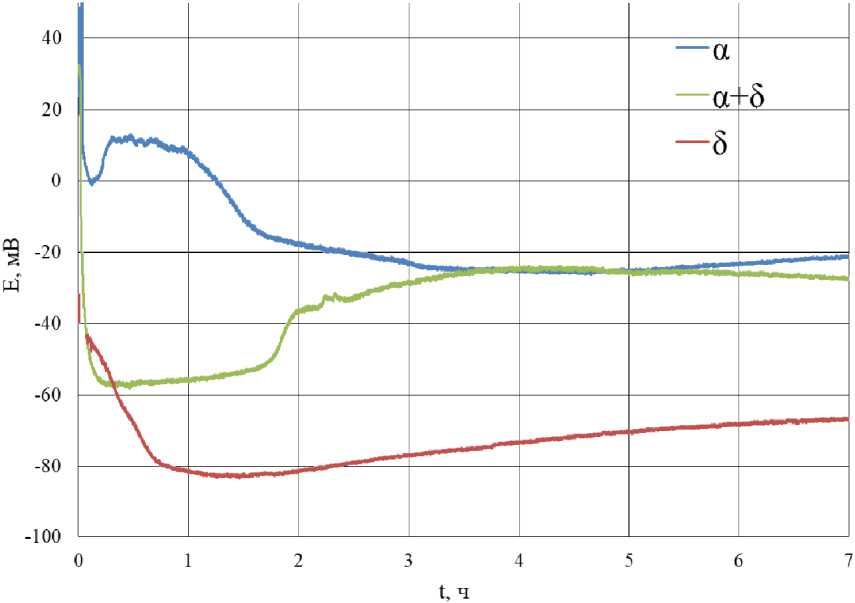
Рис. 4. Зависимость потенциала латуни различного состава от времени выдержки в коррозионной среде 0,5 М NaCl Fig. 4. Dependence of the potential of brass of various compositions on the exposure time in a corrosive environment of 0.5 M NaCl
Таблица 2
Электрохимические характеристики латуни в коррозионной среде 0,5 М NaCl
Electrochemical characteristics of brass in a corrosive environment of 0.5 M NaCl
Table 2
У всех трёх видов латуни наблюдаются схожие виды зависимости потенциала от времени травления. Изменение потенциала можно разделить на два участка. На первом участке потенциал покрытия смещается в положительную область, далее, после точки перегиба, значение потенциалов начинает смещаться в отрицательную область. При этом для α-латуни наблюдается только первый этап смещения в катодную область значений потенциала. По-видимому, это связанно с меньшей скоростью коррозии α-латуни по сравнению с латунями другого состава. Ожидается, что при большем времени коррозии будет наблюдаться точка перегиба изменения значений потенциала.
Время, за которое значения потенциалов достигают точки перегиба, для (α+β)-латуни составляет 200 мин, для β-латуни составляет
120 мин. Потенциалы в точке перегиба для (α+β)-латуни равны –73 мВ, для β-латуни равны –92 мВ
Для β-латуни наблюдается выход значений потенциала на плато, что не наблюдается для латуней другого состава. Однако на зависимости (α+β)-латуни наблюдается постепенный выход значений потенциала на постоянные значения.
Значения потенциалов латуни различного состава после 7 ч травления в коррозионной среде состава 0,493 М NaCl + 0,007 М NH 4 Cl представлены в табл. 3, также там представлены значения потенциалов перегиба; время, за которое значения потенциала достигают точки перегиба.
На рис. 6–8 представлены зависимости значений потенциалов от времени травления для латуней различного состава в растворах 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl.
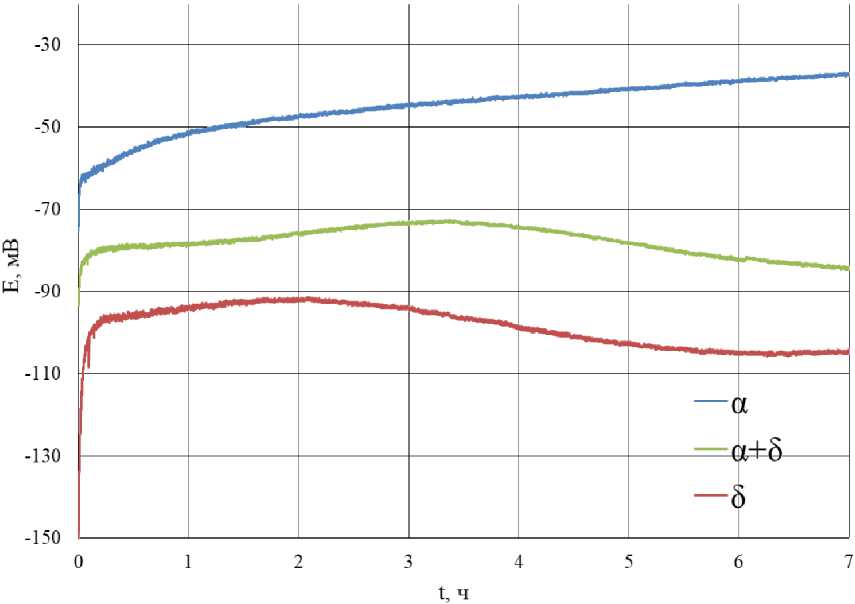
Рис. 5. Зависимость потенциала латуни различного состава от времени травления в коррозионной среде 0,493 М NaCl + 0,007 М NH4Cl
Fig. 5. Dependence of the potential of brass of various compositions on the etching time in a corrosive environment of 0.493 M NaCl + 0.007 M NH4Cl
Таблица 3
Электрохимические характеристики латуни в коррозионной среде
0,493 М NaCl + 0,007 М NH 4 Cl
Table 3
Electrochemical characteristics of brass in a corrosive environment of 0.493 M NaCl + 0.007 M NH4Cl
|
Латунь |
Время достижения точки перегиба, мин |
Потенциал точки перегиба, мВ |
Потенциал после 7 ч травления, мВ |
|
α |
– |
– |
–37 |
|
α+β |
200 |
–73 |
–84 |
|
β |
120 |
–92 |
–104 |
Для всех видов латуни наблюдается одинаковая тенденция смещения потенциала в анодную область при добавлении в коррозионную среду ионов аммония. Смещение значений потенциалов в анодную область по истечении 7 ч травления в коррозионной середе 0,493 М NaCl + 0,007 М NH 4 Cl относительно 0,5 М NaCl для α-латуни составило 16 мВ, (α+β)-латуни составило 57 мВ, β-латуни составило 38 мВ (табл. 4).
Смещение значений потенциалов в анод- ную область при добавлении ионов аммония происходит, по-видимому, из-за ускоренного растворения продуктов коррозии латуни.
Далее приведены результаты исследований по определению тока коррозии для меди, цинка и латуней в среде хлорида натрия и хлориде натрия с добавлением хлорида аммония.
На рис. 9 представлены поляризационные кривые меди в коррозионных средах 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl.
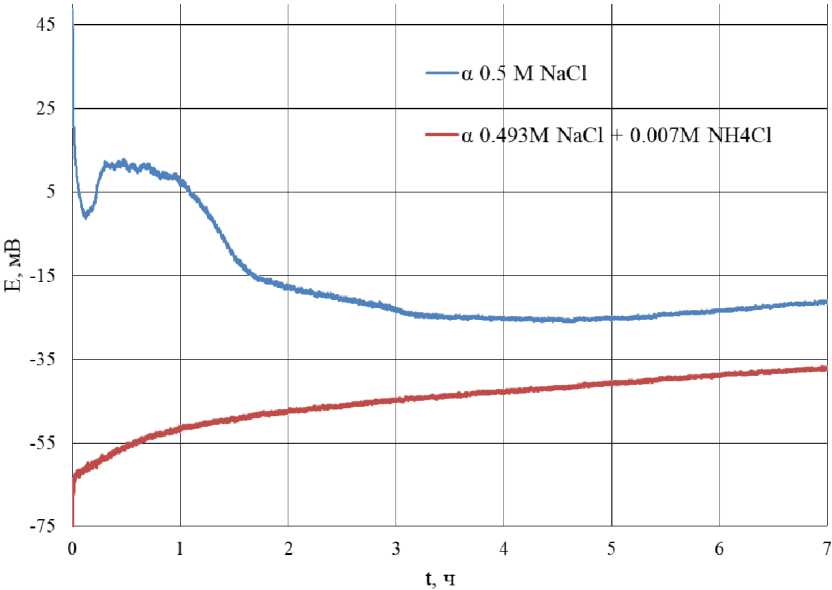
Рис. 6. Зависимость потенциала α-латуни от времени травления в коррозионной среде 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl Fig. 6. Dependence of the potential α of brass on the etching time in a corrosive environment of 0.5 M NaCl and 0.493 M NaCl + 0.007 M NH 4 Cl
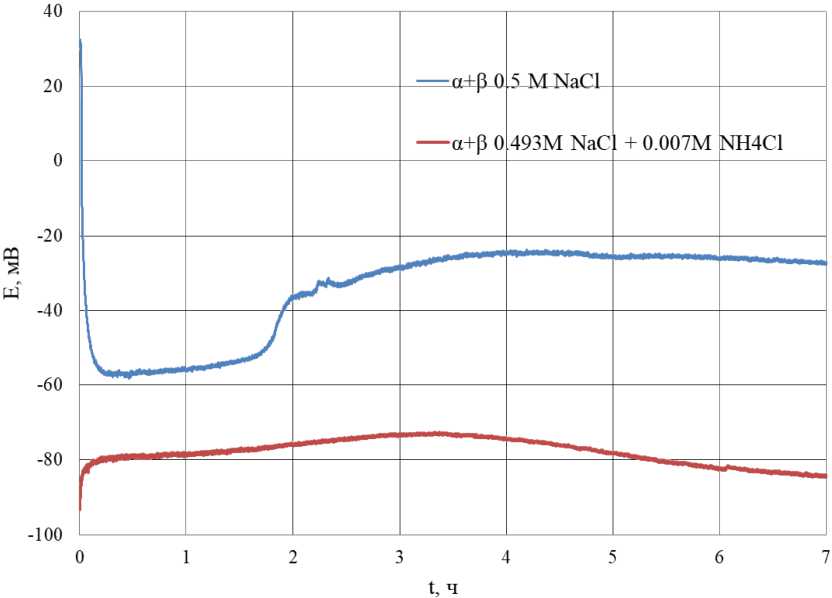
Рис. 7. Зависимость потенциала (α+β)-латуни от времени травления в коррозионной среде 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl Fig. 7. Dependence of the potential α+β of brass on the etching time in a corrosive environment of 0.5 M NaCl and 0.493 M NaCl + 0.007 M NH 4 Cl
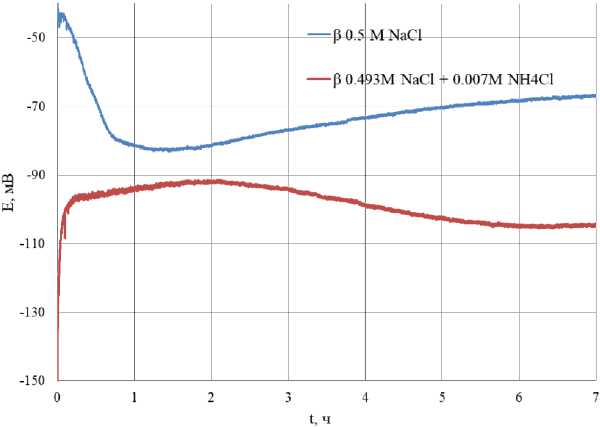
Рис. 8. Зависимость потенциала β-латуни от времени травления в коррозионной среде 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl Fig. 8. Dependence of the potential β of brass on the etching time in a corrosive environment of 0.5 M NaCl and 0.493 M NaCl + 0.007 M NH 4 Cl
Таблица 4
Электрохимические характеристики латуни
Electrochemical characteristics of brass
Table 4
|
Латунь |
Потенциал в среде 0,5 М NaCl через 7 ч коррозии, мВ |
Потенциал в среде 0,493 M NaCl + 0,007 М NH 4 Cl через 7 ч коррозии, мВ |
Смещение значений потенциалов при добавлении NH 4+ в анодную область, мВ |
|
α |
–21 |
–37 |
16 |
|
α+β |
–27 |
–84 |
57 |
|
β |
–66 |
–104 |
38 |
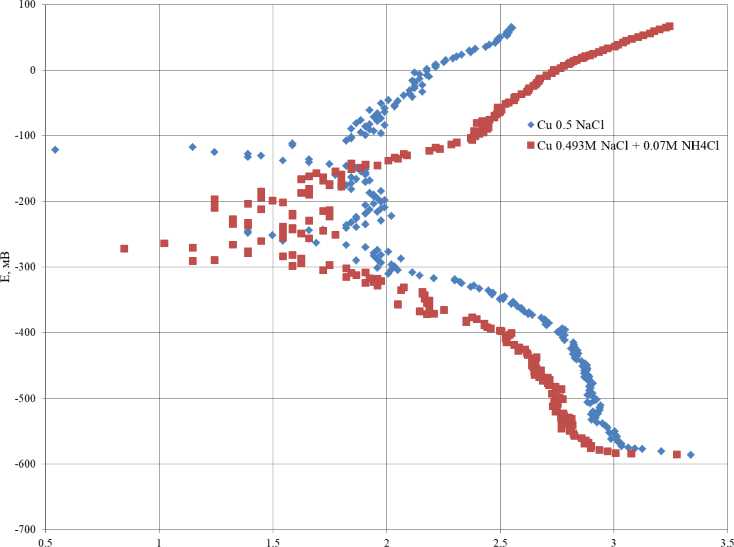
log(I) , мкА
Рис. 9. Поляризационные кривые меди в коррозионной среде 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl Fig. 9. Polarization curves of copper in a corrosive environment of 0.5 M NaCl and 0.493 M NaCl + 0.007 M NH 4 Cl
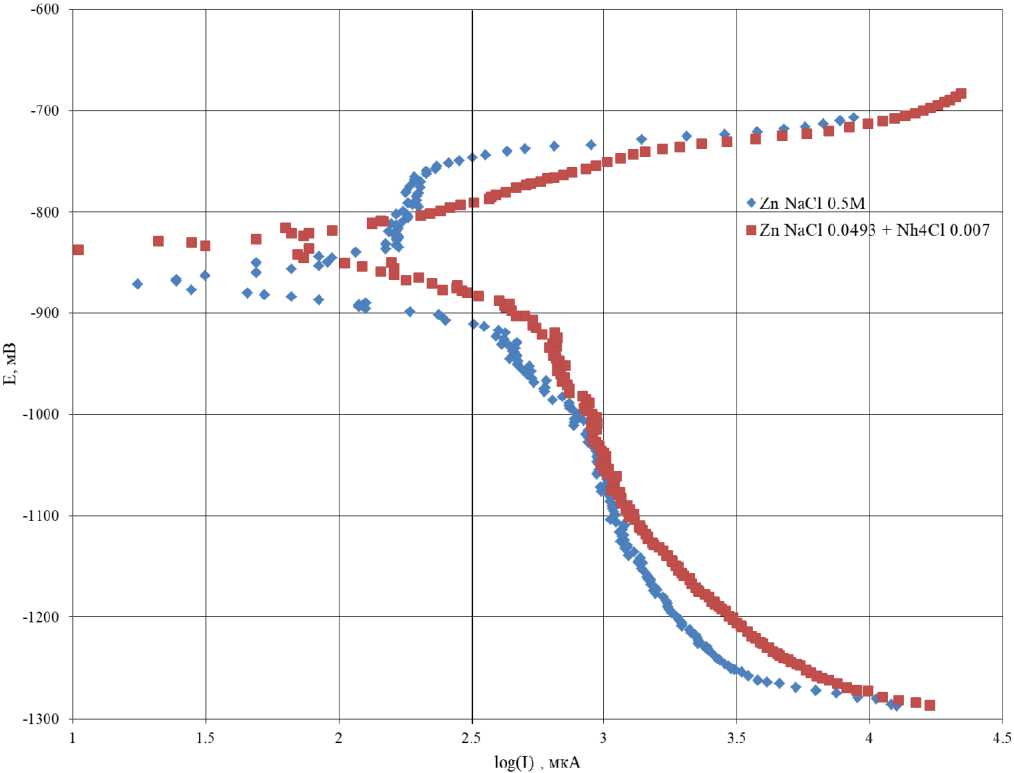
Рис. 10. Поляризационные кривые цинка в коррозионной среде 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl
Fig. 10. Polarization curves of zinc in a corrosive environment 0,5 М NaCl and 0.493 M NaCl + 0.007 M NH 4 Cl
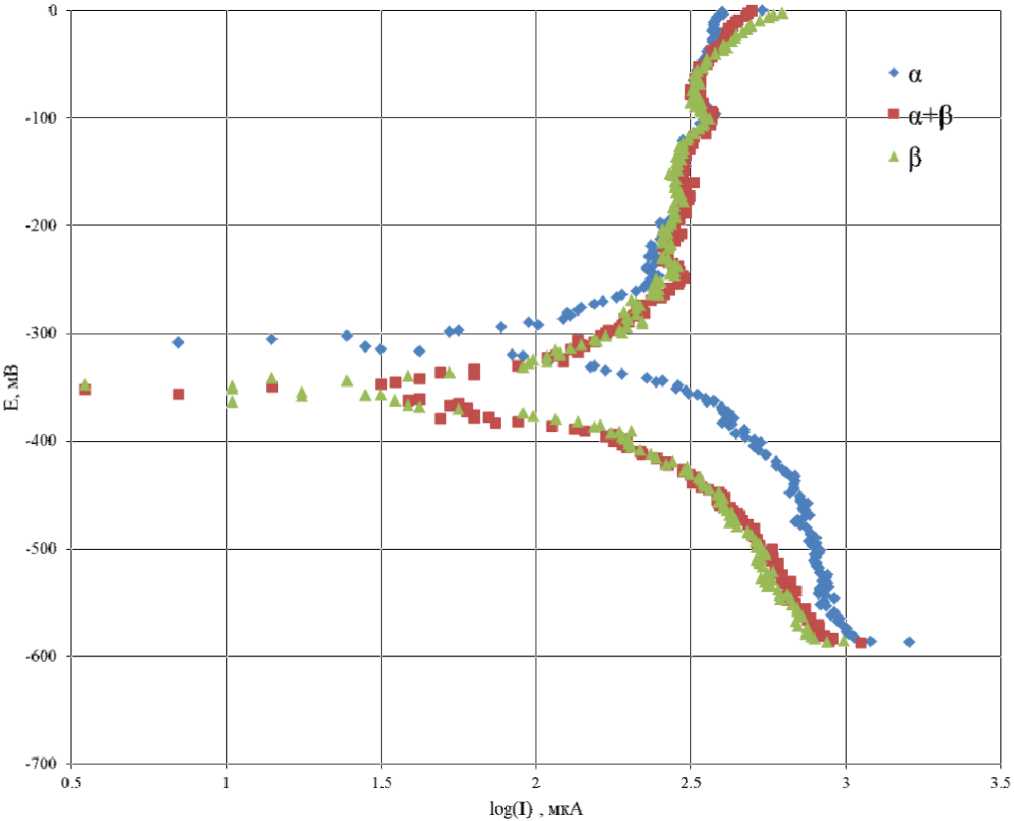
Рис. 11. Поляризационные кривые латуни различного состава в коррозионной среде 0,5 М NaCl Fig. 11. Polarization curves of brass of various compositions in a corrosive environment 0.5 M NaCl
Таблица 5
Ток коррозии латуни различного состава в коррозионной среде 0,5 М NaCl
Анализируя полученные зависимости методом экстраполяции, рассчитали ток коррозии для меди в первые 2 мин коррозии. Ток коррозии меди в растворе 0,5 М NaCl составил 38 мкА, в растворе 0,493 М NaCl + + 0,007 М NH 4 Cl – 14 мкА.
На рис. 10 представлены поляризационные кривые цинка в коррозионных средах 0,5 М NaCl и 0,493 М NaCl + 0,007 М NH 4 Cl.
Анализируя полученную зависимость методом экстраполяции, рассчитали ток коррозии для цинка в растворе 0,493 М NaCl + + 0,007 М NH 4 Cl в первые 2 мин коррозии. Ток коррозии составил 71 мкА. Ток коррозии
для цинка в растворе 0,5 М NaCl рассчитать не удалось.
На рис. 11 представлены поляризационные кривые латуни различного состава в коррозионной среде 0,5 М NaCl.
Анализируя полученные зависимости методом экстраполяции, рассчитали токи коррозии для латуней различного состава в первые 2 мин коррозии (результаты приведены в табл. 5).
Исходя из полученных данных следует: α-латунь в первые 2 мин травления имеет наименьший ток коррозии; латунь состава α+β имеет максимальный ток коррозии, что мо-
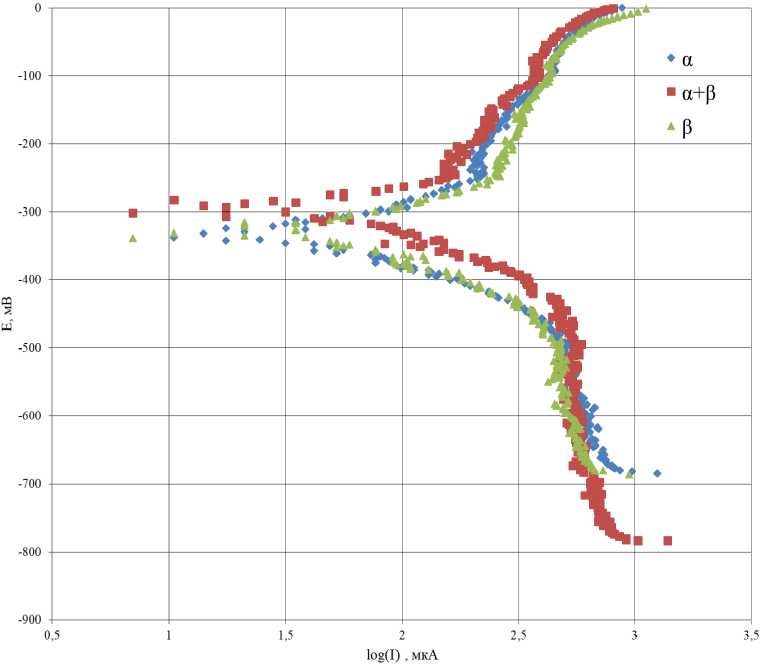
Рис. 12. Поляризационные кривые латуни различного состава в коррозионной среде 0,493 М NaCl + 0,007 М NH 4 Cl
Fig. 12. Polarization curves of brass of various compositions in a corrosive environment of 0.493 M NaCl + 0.007 M NH 4 Cl
Table 5
Corrosion current of brass of various compositions in a corrosive environment of 0.5 M NaCl
|
Латунь |
Ток коррозии, мкА |
|
α |
70 |
|
α+β |
113 |
|
β |
88 |
Таблица 6
Ток коррозии латуни различного состава в коррозионной среде 0,493 М NaCl + 0,007 М NH 4 Cl
Table 6
Corrosion current of brass of various compositions in a corrosive environment of 0.493 M NaCl + 0.007 M NH 4 Cl
|
Латунь |
Ток коррозии, мкА |
|
α |
37 |
|
α+β |
44 |
|
β |
42 |
Таблица 7
жет говорить о наиболее быстром процессе растворения.
На рис. 12 представлены поляризационные кривые латуни различного состава в коррозионной среде 0,493 М NaCl + 0,007 М NH 4 Cl.
Анализируя полученные зависимости методом экстраполяции, рассчитали токи коррозии для латуней различного состава в первые 2 мин коррозии (табл. 6).
Исходя из полученных данных следует: α-латунь в первые 2 мин травления имеет наименьший ток коррозии; латунь состава α+β и β имеет сопоставимые значения тока коррозии между собой, что может говорить о близкой скорости растворения.
Для удобства в табл. 7 сведены все значения потенциалов и токов коррозии образцов в растворах NaCl 0,5 М и 0,493 М NaCl + + 0,007 М NH 4 Cl.
Выводы по результатам исследований
В процессе исследований были определены коррозионно-электрохимические параметры образцов меди, цинка, α-, β- и (α+β)-лату-ней в зависимости от времени травления в растворах хлорида натрия и растворе хлорида
натрия с добавлением хлорида аммония (данные сведены в табл. 7). Было проведено обесцинкование образцов α-, β- и (α+β)-латуней в растворе хлорида меди и определены токи коррозии данных латуней в растворах хлорида натрия и растворе хлорида натрия с добавлением хлорида аммония (см. табл. 7). Величина обесцинкования образцов для α-ла-туни – 450–500 мкм, α+β – 950–1000 мкм, β – 600–700 мкм. Согласно результатам эксперимента было определено, что максимальный ток коррозии имеет (α+β)-латунь в среде хлорида натрия и в среде хлорида натрия с добавлением хлорида аммония. Наличие максимального тока коррозии подтверждается результатами обесцинкования (максимальная величина глубины обесцинкования среди представленных образцов – 950–1000 мкм). Данное явление предположительно связано с образованием коррозионного элемента α- и β-фазы, имеющих разный химический состав.
В рамках продолжения исследования коррозионных свойств планируется провести измерения токов коррозии для двухфазных латуней с различным составом фаз, определить величину их обесцинкования.
Коррозионно-электрохимические параметры исследуемых образцов
Table 7
Corrosion-electrochemical parameters of the studied samples
|
Образец |
Потенциал в растворе 0,5 М NaCl через 7 ч травления, мВ |
Потенциал в растворе 0,493 М NaCl + + 0,007 М NH 4 Cl через 7 ч травления, мВ |
Ток коррозии в растворе 0,5М NaCl в первые 2 мин травления, мкА |
Ток коррозии в растворе 0,493 М NaCl + + 0,007 М NH 4 Cl в первые 2 мин травления, мкА |
|
α-латунь |
–21 |
–37 |
70 |
37 |
|
(α+β)-латунь |
–27 |
–84 |
113 |
44 |
|
β-латунь |
–66 |
–104 |
88 |
42 |
|
Цинк |
–790 |
–782 |
– |
71 |
|
Медь |
–10 |
–20 |
38 |
14 |
Список литературы Исследование и сравнительный анализ коррозионной стойкости медно-цинковых сплавов в хлорсодержащих средах
- Анализ и исследование геометрических параметров инструмента с целью повышения качества поковок при штамповке корпусов латунных кранов / Д.О. Левин, В.А. Иванов, Д.А. Усов, С.С. Стругов // Вестник ЮУрГУ. Серия «Металлургия». 2023. Т. 23, № 2. С. 55–63. DOI: 10.14529/met230205
- Изучение влияния технологических условий изготовления латунных водозапорных устройств на качество готовых изделий / Д.О. Левин, А.В. Сулицин, Н.Т. Карева, Д.М. Галимов // Вестник ЮУрГУ. Серия «Металлургия». 2022. Т. 22, № 3. С. 28–47. DOI: 10.14529/met220303
- Влияние химического состава латуни типа ЛС59-1 на качество водозапорных изделий / Д.О. Левин, А.В. Сулицин, Н.Т. Карева, Д.М. Галимов // Вестник ЮУрГУ. Серия «Металлургия». 2022. Т. 22, № 4. С. 38–55. DOI: 10.14529/met220405
- ГОСТ 15527–2004. Сплавы медно-цинковые (латуни), обрабатываемые давлением. Введ. 2005-07-01. М.: ИПК Изд-во стандартов, 2004. 11 с.
- Диаграммы состояния двойных металлических систем: справ.: в 3 т. / под общ. ред. Н.П. Лякишева. М.: Машиностроение, 1997. Т. 2. 1024 с.
- Двойные и многокомпонентные системы на основе меди: справ. / М.Е. Дриц, Н.Р. Бочвар, Л.С. Гузей и др. М.: Наука, 1979. 218 с.
- Промышленные цветные металлы и сплавы: справ. / под общ. ред. А.П. Смирягина. М.: Металлургия, 1974. 488 с.
- Мальцев М.В., Барсукова Т.А., Борин Ф.А. Металлография цветных металлов и сплавов. М.: Гос. науч.-техн. изд-во лит. по чер. и цвет. металлургии, 1960. 372 с.
- Конструкционные материалы: справ. / Б.Н. Арзамасов, И.А. Бронстрем, Н.А. Буше и др.; под общ. ред. Б.Н. Арзамасова. М.: Машиностроение, 1990. 688 с.
- ГОСТ 859–2014. Медь. Марки. Введ. 2015-07-01. М.: Стандартинформ, 2020. 8 с.
- ГОСТ 28057–89. Сплавы медно-цинковые. Метод определения стойкости к обесцинкованию. Введ. 1990-06-30. М.: Государственный комитет СССР по стандартам, 1989. 11 с.
- Семенова И.В. Коррозия и защита от коррозии. М.: Физматлит, 2002. 335 с.
- Жук Н.П. Курс теории коррозии и защиты металлов. М.: Металлургия, 1976. 472 c.
- Розенфельд ИЛ. Коррозия и защита металлов. М.: Металлургия, 1969. 448 с.
- Исаев Н.И. Теория коррозионных процессов: учеб. для вузов. М.: Металлургия, 1997. 368 с.
- Улиг Г.Г., Реви Р.У. Коррозия и борьба с ней. Введение в коррозионную науку и технику: пер. с англ. Л.: Химия, 1989. 456 с.


