Исследование изотопного состава углерода 13С/12С засоленных почв Селенгинского среднегорья
Автор: Дамбаев В.Б., Давыдова Т.В.
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 2 (28), 2024 года.
Бесплатный доступ
С использованием методов изотопной масс-спектрометрии изучено влияние глюкозы на микробную деструкцию органического вещества засоленных почв Селенгинского среднегорья. Различия в изотопном составе глюкозы (513С -10,57 %о) и органического вещества (513С -26,55 %о) позволили рассчитать потоки диоксида углерода (СО2), образовавшиеся при их микробной деструкции в почве. Наибольшее количество выделившегося СО2 при внесении глюкозы в почву наблюдалось в первые 4 часа опыта, что в 12 раз больше, чем скорость деструкции органического вещества до внесения глюкозы. Наибольшее количество выделившейся углекислоты было отмечено в первые 4 часа опыта после внесения глюкозы в почву, а скорость минерализации органического вещества увеличилась 12 раз. Изотопный состав СО2 со значением -11,08 %о был отмечен при 8-часовой инкубации. 513С СО2 в проведенном опыте наследует 513С органических продуктов, используемых микроорганизмами в качестве субстратов. Различие в изотопном составе вносимой 513С экзогенной глюкозы и органического вещества может быть использовано как изотопная метка для определения происхождения СО2, образующейся при минерализации растительных остатков.
Органическое вещество, карбонаты, микробная деструкция, стабильные изотопы углерода (513с), со2
Короткий адрес: https://sciup.org/148330207
IDR: 148330207 | УДК: 579.26 | DOI: 10.18101/2542-0623-2024-2-6-12
Текст научной статьи Исследование изотопного состава углерода 13С/12С засоленных почв Селенгинского среднегорья
Почвенное плодородие является неотъемлемой частью цикла углерода, обеспечивающееся трансформацией органического вещества, так как органические соединения являются хранилищем энергии в наземных биомах [Song et al., 2017].
Важное значение для характеристики циклов углерода в биосфере имеет оценка потоков СО2 из почв. По активности СО2 в почвах можно судить о трансформации органического вещества [Шилова, 2014]. Оценка потоков углерода в почвенных системах проводится с использованием глюкозы как легко минерализуемого органического соединения, которое в природных условиях поступает в почву в составе корневых выделений [Yanardağ et al., 2017]. Внесение органических и минеральных веществ в почву оказывает определенное воздействие на микробиологические процессы [Зякун, Дилли, 2011]. Главное значение имеет почвенное органическое вещество, которое определяет состав и структуру микробных сообществ [Subedi et al., 2016; Wang et al., 2016].
В результате минерализации растительных остатков гетеротрофными микроорганизмами образуются углекислота, органические метаболиты и микробная биомасса с изотопным составом углерода δ13С использованных продуктов. Количество δ13С СО2, выделившейся из почвы в результате деструкции растительных остатков, было использовано для того, чтобы проследить минерализацию и других веществ, попадающих в почву.
Цель работы — влияние глюкозы на микробную деструкцию органических веществ и оценка продуцирования δ13С СО2 в засоленных почвах Селенгинского среднегорья.
Объекты и методы
Объектами исследования являлись прибрежные засоленные почвы озера Белое (51°32'86" с. ш. 107°02'53" в. д., высота 538 м над ур. м.).
Почвенные образцы были отобраны с верхнего слоя (0–20 см) почвы на участках Р1, Р2, Р3 на расстоянии 10 м друг от друга вверх по террасе на северовосточной оконечности озера Белое.
Содержание органического вещества в почве определяли методом мокрого сжигания [Воробьева, 1998]. Содержание карбонатов определяли по методу Хитрова [Хитров, 1984]. Продуцирование СО2 почвой определяли абсорбционным методом [Шарков, 1984].
Соотношение 13С/12С определяли на масс-спектрометре FINNIGAN Breath MAT Plus (ИБФМ РАН, г. Пущино).
Характеристики изотопного состава углерода анализируемых образцов представляли в виде величин δ13С (‰), которые рассчитывали согласно общепринятому выражению:
δ13С обр =((R обр /R ст )-1) × 1000 (‰)
где Rобр и Rст — отношения распространенности изотопов углерода [13С]/[12С] в образце и стандарте PDB [Slater, Preston, Weaver, 2001]. Знак «+» означает, что образец более обогащен тяжелым изотопом, чем стандарт, знак «-» — обеднен. Стандартная ошибка измерений изотопных характеристик ±0,2 ‰.
Материально-изотопный баланс для органического вещества (ОВ) и внесенной глюкозы (глю) в почву проводили, используя уравнение:
δ 13 СовQов+δ 13 СглюQглю
δ 13 С
(ов+глю)
(Q глю + Q ов ), (1)
где δ13Сов и δ13С(ов+глю) — содержание изотопа 13С в органическом веществе почвы до и после внесения глюкозы в почву;
δ13Сглю — изотопный состав углерода глюкозы; Qглю и Qов — количество органического вещества и глюкозы в почвенных образцах соответственно.
Используя (1), долю СО2 (F), которая образовалась при минерализации органического вещества после внесения глюкозы в почву, рассчитывали с помощью формулы (2):
F=(δ13С (ов+глю) -δ13С глю )/(δ13С глю -δ13С ов ), (2)
где δ13Сов и δ13С(ов+глю) отражают количество изотопа 13С в СО2, продуцируемое в почве до и после внесения глюкозы; δ13Сглю — изотопный состав углерода глюкозы.
Таким образом, разницу между количеством углерода СО2, продуцируемым при минерализации органического вещества в образцах почвы с глюкозой и в контроле, отнесенную к количеству СО2 в контроле (в процентах), использовали для оценки ПЭ глюкозы (3):
ПЭ=[ FС (ов+глю) -С ов )/С ов ]100 %, (3)
где С(глю+ов) — суммарное количество углерода СО2, образующееся при минерализации глюкозы и органического вещества в почве с глюкозой; FС(глю+ов) — количество углерода СО2, образующееся при минерализации органического вещества в почве с добавкой глюкозы и рассчитанное с учетом (2).
Результаты и их обсуждение
Содержание органического вещества в прибрежных засоленных почвах озера Белое невелико. В верхних 0–20 см изученных почв она варьировала в пределах 1,05–1,54 % воздушно-сухой навески. Значение рН водной вытяжки колебалось от 7,9 до 8,4 (табл. 1).
Таблица 1
Физико-химическая характеристика засоленных почв Селенгинского среднегорья
|
Ключевой участок |
Влажность, % |
рН |
Содержание карбонатов, % |
Содержание C орг , % |
|
Р1 |
6,5 |
8,4 |
0,17 |
1,13 |
|
Р2 |
6,3 |
7,9 |
1,2 |
1,05 |
|
Р3 |
12,5 |
8,2 |
12,4 |
1,54 |
Среднее значение δ13С органического вещества на участках Р1, Р2, Р3 составляло -26,55 ‰, что характерно для С3-растительности. Наименьшее количество карбонатов отмечено на участке Р1. Вверх по минитрансекту содержание карбонатов увеличивается. Наиболее обогащена карбонатами почва участка Р3, расположенная на вершине прибрежной террасы. С увеличением содержания карбонатов в почвах происходит утяжеление изотопного состава δ13Скарб — от -16,70 до -11,74 ‰ (табл. 2). р
Таблица 2
Изотопный состав углерода (δ13С) органического вещества и карбонатов
|
Ключевой участок |
Глубина, см |
δ 13С карб , ‰ |
δ 13С ОВ, ‰ |
Увлажнение почвы 60 %, δ 13С, ‰ |
|
Р1 |
0–20 |
-16,70 |
-26,19 |
-24,66 |
|
Р2 |
0–20 |
-13,76 |
-26,8 |
-22,97 |
|
Р3 |
0–20 |
-11,74 |
-26,66 |
-22,80 |
Изотопный состав δ13С почвенного СО2 составлял -23,47‰ и наследовал изотопный состав органического вещества почв -26,55‰. Фракционирование изотопов углерода при микробной деструкции органического вещества составляло 3,1 ‰. Вносимая в почву глюкоза 1,5 мг/г с изотопным составом δ13С -10,58 ‰ отличалась на 16 ‰ от углерода почвенного органического вещества. δ13С СО2 со значением -11,08 ‰ было отмечено при 8-часовой инкубации. Таким образом, δ13С СО2 в проведенном эксперименте наследует изотопный состав углерода δ13С органических продуктов, используемых почвенными микроорганизмами в качестве субстратов (рис. 1).
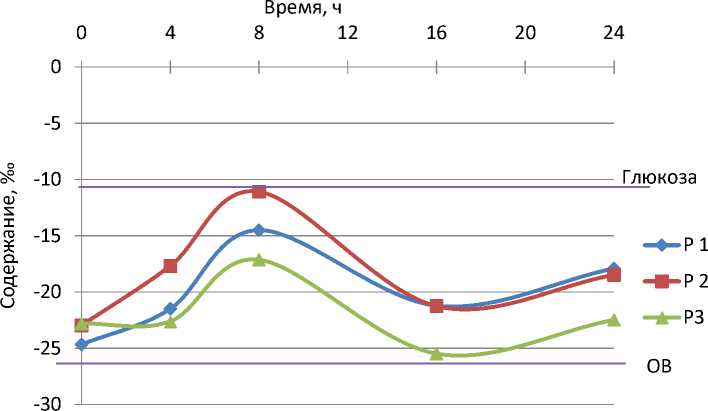
Рис. 1. Изотопный состав d13С выделившейся СО2 при внесении глюкозы в почву
Положительный прайминг-эффект составлял 264 % от исходной продукции СО2 почвы. Поэтому микробная деструкция органического вещества может быть активирована поступлением органических продуктов в почву и достигать значимых размеров.
Процесс потребления глюкозы микроорганизмами характеризовался двумя периодами и разной степенью минерализации. Высокие концентрации солей в почвах влияют на создание специфических микробных сообществ засоленных местообитаний [Сыренжапова, 2022].
Первичный период потребления глюкозы фиксировался в течение 4 часов с максимальным значением 1,68 мг СО2/100 г почвы. Во второй период после 8 часов инкубации происходило замедление скорости минерализации. Количество выделившегося СО2 из верхних слоев почвенных участков было в 12 раз больше и превышало скорость минерализации органического вещества до внесения глюкозы (табл. 3).
Таблица 3
Продуцирование СО2 на ключевых участках, мг/ч на 100 г почвы
|
Ключевой участок |
Глубина, см |
Увлажнение почвы, 60 % |
Добавление глюкозы 1,5 мг на 1 г почвы |
||||
|
сут |
1 ч |
4 ч |
8 ч |
16 ч |
24 ч |
||
|
Р1 |
0–20 |
3,36 |
0,14 |
1,68 |
0,78 |
0,33 |
0,20 |
|
Р2 |
0–20 |
2,13 |
0,08 |
1,62 |
0,70 |
0,24 |
0,15 |
|
Р3 |
0–20 |
3,06 |
0,12 |
1,68 |
0,83 |
0,42 |
0,28 |
Большое количество выделившегося СО2 из ключевого участка Р3 было связано с большим содержанием Сорг почвы. Судя по схожему характеру динамики продуцирования СО2, микроорганизмы поверхностных горизонтов одинаково откликались на внесение глюкозы.
Показано, что при внесении глюкозы в низких (до 47 мкг С/г) и высоких (4,87 мг С/г) концентрациях происходит увеличение выделения СО2. Эффект связан или с разложением внесенных соединений, или с окислением органического вещества почв [Blagodatskaya et al., 2011].
δ13С СО2, образующийся в процессе деструкции органического вещества и вносимого субстрата (глюкоза) в почву, является чувствительным параметром воздействия и продолжительности влияния этого субстрата на биогеохимические процессы, происходящие в почве.
Заключение
Изотопный состав углерода δ13С почвенных углеродсодержащих продуктов является важным показателем влияния условий среды, связанных с климатическими изменениями. Полученные данные показывают, что внесение глюкозы в почву приводит к увеличению потока СО2 в атмосферу и способствует деструкции органического вещества. Различие в изотопном составе δ13С органического вещества и глюкозы можно использовать для определения образующейся СО2
при минерализации растительных остатков в почве. Величины δ13С СО2, выделившейся из почвы в процессе разложения растительных остатков, могут быть также использованы для определения разложения растительных остатков и других веществ, попадающих в почву.
Список литературы Исследование изотопного состава углерода 13С/12С засоленных почв Селенгинского среднегорья
- Воробьева Л. А. Химический анализ почв. Москва: Изд-во МГУ, 1998. 272 с. Текст: непосредственный.
- Зякун А. М., Дилли О. Использование изотопной масс-спектрометрии для оценки метаболического потенциала почвенной микробиоты // Проблемы аналитической химии: изотопная масс-спектрометрия легких газообразующих элементов / под редакцией В. С. Севастьянова. Москва, 2011. Т. 15. С. 141–167. Текст: непосредственный.
- Сыренжапова А. С., Норовсурен Ж., Абидуева Е. Ю. Актиномицеты в прибрежных засоленных почвах озера Борзинское (Забайкальский край, Россия) // Экологические проблемы бассейна озера Байкал: материалы всероссийской научной конференции с международным участием (Улан-Удэ. 28 августа — 1 сентября 2022 г.). Улан-Удэ, 2022. С. 107–110. Текст: непосредственный.
- Хитров Б. Н. Ионно-солевой состав почв в одной навеске // Почвоведение. 1984. № 5. С. 119–127. Текст: непосредственный.
- Шарков И. Н. Определение интенсивности продуцирования СО почвой абсорбционным методом // Почвоведение. 1984. № 7. С. 136–143. Текст: непосредственный.
- Шилова Н. А. Динамика выделения CO2 в посевах полевых культур на дерново- подзолистых и торфяных почвах // Почвоведение и агрохимия. 2014. № 1(52). С. 104–113. Текст: непосредственный.
- Blagodatskaya E., Yuyukina T., Blagodatsky S., Kuzyakov Y. Three-Source-Partitioning of Microbial Biomass and of CO Efflux From Soil to Evaluate Mechanisms of Priming Effects.
- Soil Biol. Biochem. 2011; 43(4): 778–786. DOI: 10.1016/j.soilbio.2010.12.011.
- Slater C., Preston T., Weaver T. Stable Isotopes and the International System of Units. Rapid Communications in Mass Spectrometry. 2001; 15: 501–519.
- Song Y., Zou Y., Wang G., Yu X. Altered Soil Carbon and Nitrogen Cycles Due to the Freezethaw Effect: A Meta-Analysis. Soil Biol. Biochem. 2017; 109: 35–49. DOI: 10.1016/j. soilbio.2017.01.020.
- Subedi R., Taupe N., Ikovi I. et al. Chemically and Biologically-Mediated Fertilizing Value of Manure-Derived Biochar. Sci. Total Environ. 2016; 550: 924–933.
- Wang J., Xiong Z., Yan X., Kuzyakov Y. Carbon Budget by Priming in a Biochar- Amended Soil. Eur. J. Soil Biol. 2016; 76: 26–34. DOI: 10.1016/j.ejsobi.2016.07.003.
- Yanardağ I. H., Zornoza R., Bastida F. et al. Native Soil Organic Matter Conditions the Response of Microbial Communities to Organic Inputs with Different Stability. Geoderma. 2017; 295: 1–9. DOI: 10.1016/j.geoderma. 2017.02.008.


