Исследование изозимного полиморфизма у сортов ярового ячменя (Hordeum vulgare L.), контрастных по устойчивости к свинцу
Автор: Дикарев А.В., Дикарев В.Г., Гераськин С.А., Дикарева Н.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биохимия и физиология устойчивых генотипов
Статья в выпуске: 1 т.51, 2016 года.
Бесплатный доступ
Свинец - один из наиболее опасных тяжелых металлов (ТМ). Процессы, обеспечивающие устойчивость растений к его действию, выяснены не полностью. Один из механизмов токсического эффекта свинца - генерация активных форм кислорода (АФК), в норме выполняющих важные регуляторные функции, но в повышенных концентрациях вызывающих многообразные нарушения жизнедеятельности клеток. Регуляция количества АФК осуществляется при помощи антоксидантных ферментов, таких как супероксиддисмутазы (SOD) и пероксидазы (PER). Эффективность большинства ферментов зависит от наличия множественных изоформ, обеспечивающих наиболее оптимальную их работоспособность в изменяющихся условиях среды. В качестве рабочей гипотезы было выдвинуто предположение, что устойчивость растений к ТМ определяется различиями в изоферментном составе антиоксидантных ферментов, что обеспечивает неодинаковую эффективность их работы по нейтрализации избытка АФК. Для проверки этой гипотезы были выполнены исследования изоферментных спектров ферментных систем супероксиддисмутазы и пероксидазы и ключевого фермента белкового метаболизма глутаматдегидрогеназы (GDH) в зародышах прорастающих семян у сортов ярового ячменя Hordeum vulgare L. Объектом исследования служили 12 сортов ярового двурядного ячменя, контрастных по устойчивости к действию Pb2+ (6 устойчивых и 6 чувствительных). Для анализа изоферментного состава использовали зародыши наклюнувшихся жизнеспособных семян, у которых корешок через 1 сут после закладки на проращивание достигал длины 1 мм. Проращивание выполняли рулонным методом в соответствии с требованиями ГОСТ. Гомогенаты зародышей семян подвергали электрофорезу в блоках 7,5 % полиакриламидного геля (ПААГ) в щелочной буферной системе с рН 8,9. Изоферментный анализ показал наличие в ферментных системах супероксиддисмутазы, пероксидазы и глутаматдегидрогеназы следующих изозимов: облигатных SODII, PERI и GDHI, а также редких SODI, SODIII+SODIV (всегда встречающихся вместе), SODV, PERII и GDHII. Были рассчитаны частоты встречаемости редких аллелей, оказавшиеся наиболее высокими у аллелей SODI и SODIII+SODIV как у чувствительных, так и у устойчивых сортов. Достоверность различий частот встречаемости редких аллельных форм ферментов у чувствительных и устойчивых сортов была оценена с помощью φ-критерия углового преобразования Фишера. В подавляющем числе вариантов рассчитанная величина φ-критерия Фишера оказалась больше критической φкр.0,01 = 2,31. Таким образом, выделенные редко встречающиеся изоформы исследуемых ферментов можно рассматривать в качестве биохимических маркеров чувствительности или устойчивости ячменя к действию свинца. Показано, что SODV и PERII чаще встречаются у чувствительных к воздействию свинца сортов, GDHII - у устойчивых. Частота SODIII и SODIV также достоверно различалась у устойчивых и чувствительных сортов. В работе обсуждаются молекулярно-генетические механизмы устойчивости растений к ТМ. Впервые экспериментально показано, что полиморфизм ярового ячменя по устойчивости к действию свинца на организменном уровне связан с биохимическим полиморфизмом определенного комплекса изоферментов супероксиддисмутазы, пероксидазы и глутаматдегидрогеназы. Полученные данные могут быть использованы в селекционной работе по созданию устойчивых к воздействию свинца сортов ячменя.
Свинец, ячмень, внутривидовой полиморфизм, контрастные по устойчивости сорта, изоферменты
Короткий адрес: https://sciup.org/142133662
IDR: 142133662 | УДК: 633.16:581.19:57.042:546.815 | DOI: 10.15389/agrobiology.2016.1.89rus
Текст научной статьи Исследование изозимного полиморфизма у сортов ярового ячменя (Hordeum vulgare L.), контрастных по устойчивости к свинцу
Проблема, с которой сталкивается современное сельское хозяйство в условиях сокращения пригодных для использования территорий и необходимости повышать эффективность производства, — загрязнение окружающей среды техногенными поллютантами, в частности тяжелыми металлами (ТМ). Известно, что ТМ могут негативно влиять на рост и развитие растений и животных (1-3). Поэтому важно создавать сорта с высокой устойчивостью к токсическому воздействию ТМ, которые позволяют получать достаточное количество качественной продукции.
Ранее (4) мы определили концентрации свинца, оказывающие достоверный токсический эффект на проростки ячменя, и исследовали внутривидовой полиморфизм по устойчивости к действию свинца у ярового ячменя, выделив 12 сортов с контрастной реакцией (по шесть устойчивых и чувствительных). Возникает вопрос о связи между описанным в нашем предыдущем исследовании полиморфизмом по морфологическим показателям и внутривидовой изменчивостью на более тонких уровнях биологической организации. Например, достаточно давно продемонстрирована генетическая природа внутривидового полиморфизма по радиорезистентности у гексаплоидной пшеницы (5). Логично предположить, что контрастные реакции на действие свинца у сортов ячменя связаны с их генетическими особенностями.
Разработка методов маркирования биологических свойств и хозяйственных признаков растений остается основным практическим приложением биохимической и молекулярной генетики как теоретической основы современной селекции. Первоначально для генетического маркирования использовали преимущественно морфологические признаки (форма, окраска, опушенность и т.д.), которые легче регистрируются и более доступны исследователю (6, 7). Однако нестабильность этих признаков, их зависимость от условий выращивания, полигенная природа и высокая вероятность субъективной интерпретации результатов привели к тому, что главную роль в генетическом маркировании сначала стали играть белковые, а затем молекулярно-генетические маркеры (8).
Основная трудность при маркировании биологических признаков и свойств растений обусловлена тем, что в подавляющем большинстве эти признаки связаны со многими жизненными функциями, метаболическими и морфологическими процессами, имеют сложный генетический контроль, подвержены широкой фенотипической изменчивости и поэтому недоступны для классического генетического анализа. Сложные признаки и свойства часто могут быть разделены на более простые, при этом обнаруживается их иерархическая структура: одни из составляющих сложного признака мономорфны (то есть оказываются общими для всех представителей вида), другие полиморфны и специфичны для сортов и биотипов (9). Такое разделение позволяет раскрыть структуру генетического контроля сложного признака, выявить наличие и локализацию в геноме соответствующих элементам признака локусов и простых генетических систем (5).
Известно, что многие энзимы имеют несколько изоформ, различающихся особенностями структуры и конформаций. Эти особенности часто определяют разную активность ферментов (10, 11). У разных биотипов и сортов могут быть представлены только некоторые из изоформ, изменяется их соотношение и распространенность. Это вносит вклад в формирование внутривидовой изменчивости на биохимическом уровне. Изо-ферментный полиморфизм обычно не нейтрален (12) и связан с ролью ферментов в функционировании клетки. В ряде работ имеются сведения о том, что различные изоформы ферментов, ассоциированных с устойчивостью к средовому стрессу, демонстрируют различия в активности, что можно использовать для дифференциации групп организмов по сопротивлению негативным факторам среды. Так, при изучении влияние алюминия на активность супероксиддисмутазы (SOD) у двух сортов райграса многолетнего английского ( Lolium perenne L.) (13) обнаружено, что при воздействии металла у обоих сортов повышается уровень экспрессии генов, контролирующих синтез изоформ LpFe-SOD и LpCu/Zn-SOD, а также увеличивается активность этих изомеров фермента в корнях растения. При этом у сортов экспрессия существенно различалась, что, как полага-90
ют авторы, сказывается на устойчивости к вызываемому воздействием металлов стрессу. В работе (14), посвященной исследованию оксидативного стресса в клетках корней кормовых бобов ( Vicia faba L.), выращиваемых на загрязненной свинцом почве, также сообщалось, что различные изоформы SOD демонстрируют неодинаковую способность к обезвреживанию активных форм кислорода, повышенная продукция которых отмечается в таких условиях. Впрочем, изоформы SOD могут по-разному реагировать на наличие поллютанта в среде. Так, сообщалось (15), что в листьях Arabidopsis thaliana при внесении меди увеличивалась активность всех изоформ этого фермента, в то время как кадмий индуцировал рост активности только у Fe-SOD и Mn-SOD, а активность Cu-SOD снижалась по сравнению с контролем.
Нами был выполнен изозимный анализ образцов, контрастных по реакции на загрязнение свинцом, с использованием нескольких ферментных систем, связанных с устойчивостью растительного организма к неблагоприятным факторам среды, — глутаматдегидрогеназы, супероксиддисму-тазы и пероксидазы и впервые показано, что устойчивость различных сортов ячменя, выявляемая на морфологическом уровне, предопределяется их биохимическими особенностями. При этом были выявлены биохимические признаки, сопряженные с устойчивостью либо чувствительностью ячменя к действию свинца.
Целью нашего исследования было выявление изоформ ферментов, которые встречаются с повышенной частотой у устойчивых или чувствительных к действию свинца сортов.
Методика. Объектом исследования были 12 сортов ярового двурядного ячменя ( Hordeum vulgare L.), контрастных по устойчивости к действию Pb2+. Для анализа изоферментного состава использовали зародыши наклюнувшихся жизнеспособных семян, у которых корешок через 1 сут после закладки на проращивание достигал длины 1 мм и более. Проращивание выполняли рулонным методом в соответствии с требованиями ГОСТ (16). Проанализировали по 15 проб (экстрактов зародышей) каждого из 12 сортов для каждого из рассматриваемых ферментов. Эксперимент повторяли для образцов урожаев всех трех лет: для каждого сорта по одному ферменту за урожай одного года — 180 проб; для урожаев трех лет — 540 проб; общее число проб в экспериментов — 1620.
Анализ изоформ ферментов выполняли с трис-глициновым электродным буфером (рН 8,3) (17, 18) в вертикальных пластинах 7,5 % полиакриламидного геля (рН 8,9), подготовленного согласно рекомендациям (19), по системам глутаматдегидрогеназы (GDH, К.Ф. 1.4.1.2), суперок-сиддисмутазы (SOD, К.Ф. 1.15.1.1) и пероксидазы (PER, К.Ф. 1.11.1.7). Зародыши семян гомогенизировали в стеклянной ступке со смесью, состоящей из 50 мкл экстракционной смеси (1 % раствор Тритона Х-100 и 0,2 % раствор β -меркаптоэтанола в объемном соотношении 1:1) и равного объема 50 % раствора сахарозы. Полученный экстракт вносили в карманы гелевого блока. Разделение проводили на аппарате для вертикального электрофореза P9DS («Owl», США) при напряжении ∼ 350 В и силе тока ∼ 50 мА в течение 3 ч. В качестве лидирующего красителя в буфер добавляли 1 мл 0,1 % раствора бромфенолового синего. После этого гель извлекали из блока, разрезали на три части и идентифицировали зоны активности изучаемых энзимов с помощью гистохимического окрашивания в соответствии с описанной методикой (20). Окрашенные гели фотографировали для проведения дальнейшего анализа. Оценивали частоту каждой обнаруженной на гистограмме зоны активности фермента.
Полученные данные сравнивались для групп устойчивых и чувствительных сортов с помощью критерия углового преобразования Фишера ϕ (21), как это рекомендуется для подобных исследований (5).
Результаты. Из 100 сортов ячменя разного географического происхождения урожая 2009 года на основе анализа морфологических показателей были отобраны 12 контрастных по устойчивости к действию свинца (по шесть устойчивых и чувствительных) (табл. 1). Процедура исследования их морфологических реакций на влияние ТМ подробно описана нами в опубликованной ранее работе (4). Адекватность выбора была подтверждена при дополнительном исследовании семян, полученных в 2008 и 2010 годах.
1. Контрастные по устойчивости к действию свинца сорта ярового двурядного ячменя ( Hordeum vulgare L.) разного происхождения, использованные в работе
|
Название и происхождение |
Разновидность |
¹ по каталогу ВИР |
|
Вятский (Кировская обл.) |
Устойчивые nutans |
к-30848 |
|
Тео (Великобритания) |
nutans |
к-29871 |
|
Заря (Кировская обл.) |
nutans |
к-4731 |
|
Donum (Чехия) |
nutans |
к-30863 |
|
Симфония (Харьковская обл.) |
medicum |
к-30996 |
|
Pongo (Швеция) |
nutans |
к-30946 |
|
Медикум 336 (Самарская обл.) |
Чувствительные medicum |
к-30962 |
|
Мыть (Украина) |
medicum |
к-30993 |
|
Jelen (Югославия) |
nutans |
к-30955 |
|
NSGL 1 (Югославия) |
nudum |
к-30956 |
|
Заветный (Ростовская обл.) |
medicum |
к-30959 |
|
Рубеж (Беларусь) |
nutans |
к-29446 |
П р и м еч а ни е. ВИР — Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова, г. Санкт-Петербург.
При изучении полиморфизма антиоксидантных ферментов у сортов на проявленных электрофореграммах наблюдали распределение изоформ, которое обобщенно иллюстрирует схема, представленная на рисунке.
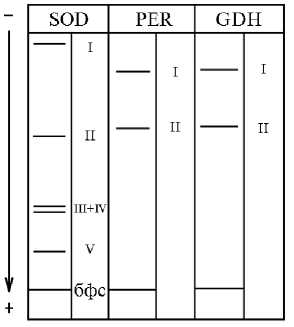
Обобщенная схема распределения вариантов супероксиддисмута-зы (SOD) , пероксидазы (PER) и глутаматдегидрогеназы (GDH) у 12 изученных сортов ярового двурядного ячменя ( Hordeum vulgare L.) разного происхождения, контрастных по устойчивости к действию свинца в модельном опыте : I, II, III, IV, V — аллельные варианты, бфс — индикатор бромфеноловый синий.
Найденные аллели обозначали цифрами в зависимости от положения соответствующей зоны в геле, определяемого относительно расстояния до линии лидирующего красителя. Изозимы SODII, PERI и GDHI были облигатными и обнаруживались во всех исследованных вариантах, в то время как SODI, SODIII+IV (встречались всегда вместе), SODV, PERII и GDHII оказались факультативными (их отмечали лишь время от времени). В большинстве случаев у суперок-сиддисмутазы имелось три аллеля — SODII, SODIII и SODIV, у пероксидазы один — PERI, у глутаматдегидрогеназы также один — GDHI. Помимо этого, редко появлялись зоны активности SODI, SODV, PERII, GDHII. Аллели SODIII и SODIV также относились к редким в отличие от аллеля SODII, стабильно присутствующего у всех сортов ячменя в 100 % случаев.
На основе анализа электрофореграмм, полученных для 12 контрастных по устойчивости сортов ячменя из урожаев 3 лет мы оценили частоту аллельных форм ферментов, встречающихся нерегулярно
(SODI, SODV, PERII, GDHII), с помощью ϕ -критерия углового преобразования Фишера (табл. 2). Также была установлена частота встречаемости для изоферментов SODIII и SODIV, которые рассматривали совместно, так как на гистограмме соответствующие зоны активности проявлялись или отсутствовали всегда в виде пары зон активности, расположенных близко друг к другу. Аллель SODII здесь нами не рассматривается, поскольку его присутствие стабильно выявлялось и у толерантных, и у чувствительных сортов, а также у разных сортов внутри этих групп. Аналогичным образом были исключены из рассмотрения формы PERI и GDHI.
2. Встречаемость изоформ супероксиддисмутазы (SOD) , пероксидазы (PER) и глутаматдегидрогеназы (GDH) у 12 изученных сортов ярового двурядного ячменя ( Hordeum vulgare L.) разного происхождения, контрастных по устойчивости к действию свинца в модельном опыте
|
Изофермент |
Частота встречаемости, % |
Значение критерия углового преобразования Фишера ϕ |
|
|
у устойчивых сортов |
у чувствительных сортов |
||
|
SODI |
45,11 |
41,97 |
1,21 |
|
SODIII+IV |
47,23 |
71,69 |
7,79 |
|
SODV |
4,04 |
11,85 |
4,35 |
|
PERII |
12,86 |
18,41 |
1,85 |
|
GDHII |
20,37 |
9,91 |
3,41 |
В подавляющем числе вариантов рассчитанная величина ϕ -критерия Фишера оказалась больше критической ϕ кр.0,01 = 2,31. Исключение составила изоформа PERII, по которой различия между устойчивыми и чувствительными сортами были значимыми при ϕ кр.0,05 = 1,64, и SODI, где достоверных различий мы не выявили. Таким образом, выделенные нами редко встречающиеся изоформы исследуемых ферментов можно рассматривать в качестве биохимических маркеров чувствительности или устойчивости ячменя к действию свинца. Как показали наши исследования, SODV и PERII чаще встречаются у чувствительных к воздействию свинца сортов, GDHII — у устойчивых (см. табл. 2). Частота SODIII и SODIV также достоверно различалась у устойчивых и чувствительных сортов.
Таким образом, из представленных в таблице 2 данных следует, что обнаруженный нами при изучении 100 сортов ярового ячменя полиморфизм по устойчивости к действию свинца (4) сопряжен с биохимическим полиморфизмом изоформ антиоксидантных ферментов. Тяжелые металлы, в том числе свинец, могут вызывать оксидативный стресс у высших растений (22-23). Активные формы кислорода (АФК) — главный источник повреждения растительных клеток (24-26). В своем предыдущем исследовании мы показали (4), что воздействие свинца существенно угнетает ростовые процессы у проростков ячменя и вызывает морфологические нарушения. Вероятно, эти проявления оказываются следствием повышенной продукции АФК. Такие АФК, как О2 -• , Н2О2, ОН • постоянно генерируются в результате метаболических процессов в хлоропластах, митохондриях и пероксисомах (27). В нормальных условиях производство АФК контролируют антиоксидантные системы организма (28). Однако при стрессе существует опасность серьезного повреждения клеток за счет избыточной выработки АФК (29). Их повышенное количество способно существенно нарушить многие функции клетки за счет модификации ДНК, окисления белков и липидов (30, 31). В то же время АФК способны вызывать повышенную экспрессию генов, кодирующих ферменты SOD или PER, отвечающие за их ликвидацию, и таким образом также нарушать внутренний гомеостаз клеток.
Ниже приведем общие схемы работы рассматриваемых ферментов:
О2 • + О2 • + 2Н+ SOD--- > Н2О2 + О2
2H 2 O 2 PER 2H 2 O+ О 2
L-глутамат + Н2О + NADP+ GDH 2-оксоглутарат + NH3 + NADPH + H+ Супероксиддисмутаза — один из основных ферментов, ответственных за защиту от стрессовых воздействий, связанных с генерацией АФК (32). Ее главная задача заключается в превращении активных форм кислорода (супероксид-радикал О - • ), способных нанести существенный вред клетке из-за повышенной реакционной способности, в перекись водорода (с последующим образованием из нее воды и кислорода) и молекулярный кислород. Неблагоприятные воздействия приводят к неодинаковому развитию оксидативного стресса в разных компартментах клетки, что влечет за собой экспрессию тех генов SOD, которые кодируют изоформы этого фермента, необходимые для специфической защиты соответствующих клеточных структур (33). Существование изоферментов SOD в растениях и их генетическая основа были впервые продемонстрированы на кукурузе (34, 35). В нашей работе было обнаружено, что у устойчивых к свинцу сортов ячменя частота редких форм SOD и PER выше, чем у чувствительных. Можно полагать, что устойчивость этих сортов связана с большим генетическим разнообразием их антиоксидантных систем, что позволяет растениям лучше переносить условия стресса. Известно, что при повышении полиморфизма (в частности, на биохимическом уровне) организмы лучше справляются с техногенным стрессом (36). К такого рода полиморфизму относится появление факультативных изомеров SOD. Чем выше их частота и разнообразие, тем выше степень полиморфизма. Данные, полученные нами в настоящем исследовании, свидетельствуют о том, что эти редкие изоформы способствуют росту устойчивости растений.
Причиной возникновения и повышенной частоты факультативных изоформ SOD у устойчивых к ТМ сортов по сравнению с чувствительными может быть проведение селекционной работы на фоне повышенной нагрузки по АФК (например, в засушливых регионах, на почвах с засолением, в зонах залегания месторождений металлов, при воздействии других естественных экстремальных факторов). Из имеющихся в специальной литературе публикаций (37, 38) следует, что ответная реакция антиоксидантных систем растений на действие ТМ и естественных факторов среды сходна. Здесь следует учитывать и техногенную нагрузку на биосферу. Три устойчивых сорта из шести выделенных нами происходят из индустриально высокоразвитых стран (Великобритания, Чехия, Швеция), где для многих регионов характерно повышенное содержание ТМ в почве. Это можно рассматривать как свидетельство в пользу высказанной нами гипотезы. Действительно, сообщается (39), что сорта сельскохозяйственных растений, произрастающих на почвах с высоким природным содержанием мышьяка, дифференцированы по устойчивости. В подобных условиях имеющие адаптивную ценность более эффективные изоформы антиоксидантных энзимов могли быть закреплены отбором, а кодирующие их аллели — сохраниться в геноме. В то же время селекция по хозяйственно ценным признакам тоже могла способствовать формированию обнаруженных биохимических особенностей. Так, семена некоторых сортов имеют высокое содержание жиров, что при действии атмосферного кислорода ведет к образованию повышенного количества органических перекисей и, как следствие, свободных радикалов. Эти обстоятельства могли привести к возникновению у таких сортов дополнительных изоформ антиоксидантных ферментов, необходимых для поддержания гомеостаза. Подобные особенности ферментной системы могут быть закреплены в наследственном аппарате (40), что было показано при изучении транскрипции гена, кодирующего синтез изоформы Mn-SOD. Как оказалось, воздействие ртути вызывает повышенную экспрессию этого гена, и в 94
итоге активность изофермента повышается, что вполне согласуется с нашей гипотезой. Еще одним подтверждением того, что более полиморфные образцы лучше переносят стрессовые воздействия, можно считать данные V. Ran-celis с соавт. (36). Они показали, что при обработке растений бобов солями кобальта возрастает частота редких вариантов SOD. В этой связи можно также упомянуть работу, в которой сообщается о повышенной частоте встречаемости факультативных изоформ антиоксидантных ферментов (SOD, PER и др.) в хронически облучаемых популяциях сосны ( Pinus sylvestris L.), произрастающих на территориях, которые подверглись радиоактивному загрязнению в результате аварии на Чернобыльской АЭС (41). Этот пример также указывает на единство механизмов ответа организма на разные стрессоры.
Образующийся в клетках вследствие работы SOD Н2О2 токсичен (42), и его концентрация должна поддерживаться на низком уровне. Перекись водорода вместе с прочими АФК также может генерироваться в результате воздействия ионов металлов или патогенов. Например, сообщается (43, 44), что у чувствительных вариантов содержание Н2О2 значительно выше, чем у устойчивых. В то же время в низких концентрациях Н2О2 активирует ряд защитных механизмов (45), в том числе регенерацию клеточной стенки (43), связывание и нейтрализацию патогенов и вредных ионов (46), реакцию на гиперчувствительность, синтез индуцируемых патогенном белков и фитоалексинов (47). Поэтому можно полагать, что у устойчивых сортов такие соединения образуются в относительно небольших количествах и стимулируют защитные функции организма, позволяя лучше сопротивляться воздействию стресса, вызванного ТМ, и сорта оказываются более приспособленными к стрессовым условиям. Что же касается чувствительных сортов, то у них имеется избыток Н2О2, что ведет, напротив, к ослаблению защиты и возникновению повреждений. Рассмотренные механизмы действия перекисей в клетках могут прояснить, каким образом растения изученных сортов реагируют на присутствие Pb2+.
Однако при обсуждении полученных данных необходимо учитывать не только эффекты низкомолекулярных соединений. Как уже отмечалось, важнейшую роль в защите от средового стресса и возникающих избыточных концентраций АФК играет система антиоксидантных энзимов. За освобождение внутренней среды от избытка перекисей отвечает PER. Наблюдаемая нами более высокая частота встречаемости изоформы PERII у чувствительных сортов, вероятно, связана с их большей уязвимостью к действию ионов ТМ. Пероксидаза — очень лабильный фермент, способный реагировать на большинство нарушений гомеостаза. Так, на разных линиях клевера красного было установлено (48), что один из изозимов пероксидазы определяет большую устойчивость растения к вирусным инфекциям. При этом активируется расщепление перекиси, в связи с чем авторы предложили использовать эту форму как маркер общей устойчивости, учитывая в целом сходный характер механизмов ответа растений на разные стрессоры. Подобные данные свидетельствуют, что пероксидазные маркеры позволяют более полно характеризовать защитные механизмы растений к разным факторам среды, и учет этих механизмов может быть полезен в селекционной работе.
Биологическая роль GDH заключается в катализе реакции восстановительного аминирования 2-оксоглутарата до глутамата и обратного ей процесса окислительного дезаминирования (49) с участием восстановленных и окисленных форм NAD в качестве кофермента. В основном благодаря этому растение поглощает из среды соединения азота и включает их в метаболизм (синтез азотистых органических соединений и их разрушение с 95
высвобождением азота в виде солей аммония). Таким образом, этот фермент выступает связующим звеном для двух фундаментальных процессов, характерных для автотрофного организма, — ассимиляции азота и углерода, и играет важную роль в контроле развития растений. GDH имеет ряд изоформ, в частности у растений встречаются две формы энзима — более легкая и более тяжелая (50, 51). Первая катализирует реакцию аминирования, вторая — дезаминирования. Различия в содержании этих форм регулируют в организме баланс между катаболизмом и анаболизмом. В соответствии с принципом Ле-Шателье катализатор ускоряет химическую реакцию в обоих направлениях, то есть фермент усиливает аминирование и дезаминирование с равной вероятностью, и смещение кинетического равновесия (52, 53) может зависеть от условий среды, стрессовых воздействий на растение. С функцией GDH в клетках связано накопление различных биологически активных веществ (сахара, аминокислоты, ионы аммония), что может косвенно способствовать развитию устойчивости к неблагоприятным факторам среды (засуха, засоление), накоплению биомассы и повышению толерантности к действию токсикантов (например, гербицидов, а возможно, и ТМ) (54, 55). Существенное смещение равновесия в сторону образования 2-оксоглутарата удалось получить при генетической модификации растений.
Учитывая большую электрофоретическую подвижность GDHII по сравнению с GDHI, допустимо предположить, что первая из них соответствует более легкой из описанных выше изоформ, преимущественно катализирующей реакцию аминирования. Следовательно, у имеющих такой изозим вариантов реакции анаболизма протекают более активно, чем у тех, где этот изомер отсутствует. В связи с полученными нами данными эта тенденция представляет особый интерес, поскольку в среде создается избыток глутамата и преимущественно должна протекать реакция его дезаминирования (прямая). Так как были отмечены случаи, когда выявляется изозим, катализирующий в первую очередь синтез глутамата, то обнаруженная изоформа должна проявлять повышенную активность. Поскольку мы показали, что GDHII чаще встречается у устойчивых сортов, можно полагать, что формирование их толерантности связано с более высокой активностью процессов синтеза, способствующих интенсивному формированию биомассы. Аналогичные результаты были получены в работе R. Ameziane с соавт. (56). В итоге растения, несущие аллель GDHII, быстрее развиваются и легче переносят негативные воздействия среды. В исследовании, посвященном изучению генетического контроля устойчивости Pinus sylvestris L. к воздушному загрязнению (57), были получены результаты, близкие к нашим, — фермент GDH имел две изоформы, причем аллель более легкой (GDHII) встречался чаще именно у устойчивых сортов.
В то же время имеются сведения (58), что GDH катаболического типа активируется не только ионами аммония, но и одно- и двухзарядными катионами металлов, причем сродство к таким катионам может оказаться выше, чем к NH4+. Логично предположить, что у чувствительных сортов относительно высокая концентрация ионов Pb2+ может способствовать смещению равновесия синтеза ферментов именно к такой форме GDH, и это может быть закреплено наследственно. Поэтому такой изозим у чувствительных сортов способен экспрессироваться даже без влияния ТМ. С этих позиций становится понятно, почему у чувствительных сортов ячменя более легкая форма GDH, ответственная за анаболизм и, следовательно, менее подверженная действию катионов, встречается реже.
Итак, из полученных нами данных следует, что полиморфизм ярового ячменя по устойчивости к действию свинца связан с биохимическим 96
полиморфизмом и коррелирует с определенным комплексом изоферментов супероксиддисмутазы, пероксидазы и глутаматдегидрогеназы. Очевидно, существуют специфические аллельные варианты, кодирующие синтез изоформ этих трех ферментов и обусловливающие в определенной степени устойчивость или чувствительность сорта. Обнаружены изоферменты супер-оксиддисмутазы и пероксидазы, частота встречаемости которых выше у чувствительных к действию свинца сортов, и установлена повышенная частота встречаемости изозима глутаматдегидрогеназы у устойчивых сортов. Различия между группами контрастных по устойчивости сортов по встречаемости изоформ подтверждены статистически. Таким образом, предлагается рассматривать эти изоформы супероксиддисмутазы, гваяколовой пероксидазы и глутаматдегидрогеназы в качестве биохимических маркеров для дифференциации сортов ярового двурядного ячменя на устойчивые и чувствительные. Полученные данные могут быть использованы в селекционной работе по созданию устойчивых к воздействию свинца сортов ячменя.
Список литературы Исследование изозимного полиморфизма у сортов ярового ячменя (Hordeum vulgare L.), контрастных по устойчивости к свинцу
- Гуральчук Ж.З. Механизмы устойчивости растений к действию тяжелых металлов. Физиология и биохимия культурных растений, 1994, 26(2): 107-117.
- Феник С.И., Трофимяк Т.Б., Блюм Я.Б. Механизмы формирования устойчивости растений к тяжелым металлам. Успехи современной биологии, 1995, 115(3): 261-276.
- Sharma Р., Dubey R.S. Lead toxicity in plants. Braz. J. Plant Physiol., 2005, 17(1): 35-52.
- Дикарев А.В., Дикарев В.Г., Дикарева Н.С., Гераськин С.А. Внутривидовой полиморфизм ярового ячменя (Hordeum vulgare L.) по устойчивости к действию свинца. Сельскохозяйственная биология, 2014, 5: 78-87 ( , 10.15389/agrobiology.2014.5.78eng) DOI: 10.15389/agrobiology.2014.5.78rus
- Сарапульцев Б.И., Гераськин С.А. Генетические основы радиорезистентности и эволюция. М., 1993.
- Конарев В.Г. Белки растений как генетические маркеры. М., 1983.
- Созинов А.А. Полиморфизм белков и его значение в генетике и селекции. М., 1985.
- Чесноков Ю.В. ДНК-фингерпринтинг и анализ генетического разнообразия у растений. Сельскохозяйственная биология, 2005, 1: 20-40.
- Алтухов Ю.П. Генетические процессы в популяциях. М., 2003.
- Тимошкина Н.Н., Водолажский Д.И., Усатов А.В. Молекулярно-генетические маркеры в исследовании внутри-и межвидового полиморфизма осетровых рыб (Acipenseriformes). Экологическая генетика, 2010, 8(1): 12-24.
- Staszak J., Grulke N.E., Marrett M.J., Prus-Glowacki W. Isozyme markers associated with O3 tolerance indicate shift in genetic structure of ponderosa and Jeffrey pine in Sequoia National Park, California. Environ. Pollut., 2007, 149: 366-375 ( ) DOI: 10.1016/j.envpol.2007.05.026
- Алтухов Ю.П., Салменкова Е.А. Полиморфизм ДНК в популяционной генетике. Генетика, 2002, 38(9): 1173-1195.
- Cartes P., McManus M., Wulf-Zotelle C. Differential superoxide dismutase expression in ryegrass cultivars in response to short term aluminum stress. Plant Soil, 2012, 350: 353-363 ( ) DOI: 10.1007/s11104-011-0919-3
- Wang C., Tian Y., Wang X., Geng J., Jiang J., Yu H., Wang C. Lead-contaminated soil induced oxidative stress, defense response and its indicative biomarkers in roots of Vicia faba seedlings. Ecotoxicology, 2010, 19: 1130-1139 ( ) DOI: 10.1007/s10646-010-0496-x
- Drazkiewicz M., Skorzynska-Polit E., Krupa Z. The redox state and activity of superoxide dismutase classes in Arabidopsis thaliana under cadmium or copper stress. Chemosphere, 2007, 67: 188-193 ( ) DOI: 10.1016/j.chemosphere.2006.08.032
- ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести/Под ред. T.И. Василенко. М., 2010.
- Маурер Г. Диск-электрофорез. М., 1971.
- Остерман Л.А. Методы исследования белков и нуклеиновых кислот. Электрофорез и ультрацентрифугирование. М., 1981.
- Плешков Б.П. Практикум по биохимии растений. М., 1976.
- Manchenko G.P. Handbook of detection of enzymes on electrophoretic gels. NY, 1994.
- Зыкова Н.Ю. Методы математической обработки данных. Воронеж, 2008.
- Boening D.W. Ecological effects, transport and fate of mercury: a general review. Chemosphere, 2000, 40: 1335-1351 ( ) DOI: 10.1016/S0045-6535(99)00283-0
- Wang Y., Greger M. Clonal differences in mercury tolerance, accumulation and distribution in willow. J. Environ. Qual., 2004, 33: 1779-1785 ( ) DOI: 10.2134/jeq2004.1779
- Zhou Z.S., Huang S.Q., Guo K., Mehta S.K., Zhang P.C., Yang Z.M. Metabolic adaptations to mercury-induced oxidative stress in roots of Medicago sativa L. J. Inorg. Biochem., 2007, 101: 1-9 ( ) DOI: 10.1016/j.jinorgbio.2006.05.011
- Cho U.H., Park J.O. Mercury-induced oxidative stress in tomato seedlings. Plant Sci., 2000, 156: 1-9 ( ) DOI: 10.1016/S0168-9452(00)00227-2
- Cargnelutti D., Tabaldi L.A., Spanevello R.M. Mercury toxicity induces oxidative stress in growing cucumber seedlings. Chemosphere, 2006, 65: 999-1006 ( ) DOI: 10.1016/j.chemosphere.2006.03.037
- Chen J., Shiyab S., Han F.X. Bioaccumulation and physiological effects of mercury in Pteris vittata and Nephrolepis exaltata. Ecotoxicology, 2009, 18: 110-121 ( ) DOI: 10.1007/s10646-008-0264-3
- Apel K., Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annu. Rev. Plant Biol., 2004, 55: 373-399 (doi: 10.1146/annurev.arplant.55.031903.141701).
- del Rió L.A., Sandalio L.M., Corpas F.J., Palma J.M., Barroso J.B. Reactive oxygen species and reactive nitrogen species in peroxisomes, production, scavenging, and role in cell signaling. Plant Physiol., 2006, 141: 330-335 ( ) DOI: 10.1104/pp.106.078204
- Полесская О.Г. Растительная клетка и активные формы кислорода. М., 2007.
- Mittler R., Vanderauwera S., Gollery M., Van Breusegem F. Reactive oxygen gene network of plants. Trends Plant Sci., 2004, 9: 490-498 ( ) DOI: 10.1016/j.tplants.2004.08.009
- Fried R. Enzymatic and non-enzymatic assay of superoxide-dismutase. Biochemie, 1975, 57: 657-660 ( ) DOI: 10.1016/S0300-9084(75)80147-7
- Inze D., Montagu M. Oxidative stress in plants. Curr. Opin. Biotechnol., 1995, 6: 153-158 ( ) DOI: 10.1016/0958-1669(95)80024-7
- Scandalios J.G. Oxygen stress and superoxide dismutases. Plant Physiol., 1993, 101: 7-12.
- Alscher R.G., Erturk N., Heath L.S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. J. Exp. Bot., 2002, 53: 1331-1341 ( ) DOI: 10.1093/jexbot/53.372.1331
- Rancelis V., Cesniene T., Kleizaite V. Influence of cobalt uptake by Vicia faba seeds on chlorophyll morphosis induction, SOD polymorphism and DNA methylation. Environ. Toxicol., 2010, 10: 5-15 ( ) DOI: 10.1002/tox.20609
- Taylor N.L. Targets of stress-induced oxidative damage in plant mitochondria and their impact on cell carbon/nitrogen metabolism. J. Exp. Bot., 2004, 55(394): 1-10 ( ) DOI: 10.1093/jxb/erh001
- Vacca R.A. Production of reactive oxygen species, alteration of cytosolic ascorbate peroxidase, and impairment of mitochondrial metabolism are early events in heat shock-induced programmed cell death in tobacco. Plant Physiol., 2004, 134(3): 1100-1112 ( ) DOI: 10.1104/pp.103.035956
- Mallick S., Sinam G., Sinha S. Study on arsenate tolerant and sensitive cultivars of Zea mays L.: differential detoxification mechanism and effect on nutrient status. Ecotoxicology and Environmental Safety, 2011, 74: 1316-1324 ( ) DOI: 10.1016/j.ecoenv.2011.02.012
- Elbaz A., Wei Y., Meng Q. Mercury-induced oxidative stress and impact on antioxidant enzymes in Chlamidomonas reinhardtii. Ecotoxicology, 2010, 10: 8-18.
- Волкова П.Ю., Гераськин С.А. Полиморфизм антиоксидантных ферментов в хронически облучаемых популяциях сосны обыкновенной. Экологическая генетика, 2013, 9(3): 48-62.
- Dat J., Vandenabeele S., Vranova E. Dual action of the active oxygen species during plant stress responses. Cell. Mol. Life Sci., 2000, 57: 779-795 ( ) DOI: 10.1007/s000180050041
- Lanubile A., Bernardi J., Marocco A. Differential activation of defense genes and enzymes in maize genotypes with contrasting levels of resistance to Fusarium verticillioides. Environ. Exp. Bot., 2012, 78: 39-46 ( ) DOI: 10.1016/j.envexpbot.2011.12.006
- Lamb C., Dixon R.A. The oxidative burst in plant disease resistance. Annu. Rev. Plant. Physiol. Plant. Mol. Biol., 1997, 48: 251-275 ( ) DOI: 10.1146/annurev.arplant.48.1.251
- Bolwell G.P., Butt V.S., Davies D.R., Zimmerlin A. The origin of the oxidative burst in plants. Free Radic. Res., 1995, 23: 517-523 ( ) DOI: 10.3109/10715769509065273
- Lane B.G. Oxalate, germin, and the extracellular matrix of higher plants. FASEB J., 1994, 8: 294-301.
- Hammond-Kosack K.E., Jones J.D.G. Resistance gene-dependent plant defense responses. Plant Cell., 1996, 8: 1773-1791 ( ) DOI: 10.2307/3870229
- Sheen S.J., Diachun S. Peroxidases of red clover resistant and susceptible to bean yellow mosaic virus. Acta Phytopathol. Acad. Sci. Hung., 1978, 13(2): 21-28.
- Grabowska A., Nowicki M., Kwinta J. Glutamate dehydrogenase of the germinating triticale seeds: gene expression, activity distribution and kinetic characteristics. Acta Physiologiae Plantarum, 2011, 33: 1981-1990 ( ) DOI: 10.1007/s11738-011-0801-1
- Loulakakis K.A., Roubelakis-Angelakis K.A. The seven NAD(H)-glutamate dehydrogenase isoenzymes exhibit similar anabolic and catabolic activities. Physiol. Plant., 1996, 96: 29-35 ( ) DOI: 10.1111/j.1399-3054.1996.tb00179.x
- Purnell M.P., Scopelites D.S., Roubelakis-Angelakis K.A. Modulation of higher-plant NAD(H) dependent glutamate dehydrogenase activity in transgenic tobacco via alteration of beta-subunit level. Planta, 2005, 222: 167-180 ( ) DOI: 10.1007/s00425-005-1510-z
- Диксон М., Уэбб Э. Ферменты. В 3 т. М., 1982.
- Мецлер Д. Биохимия. Химические реакции в живой клетке. В 3 т. М., 1980.
- Mungur R., Glass A.D.M., Goodenow D.B., Lightfoot D.A. Metabolite fingerprinting in transgenic Nicotiana tabacum altered by the Escherichia coli glutamate dehydrogenase gene. J. Biomed. Biotechnol., 2005, 2: 198-214 ( ) DOI: 10.1155/JBB.2005.198
- Mungur R., Wood A.J., Lightfoot D.A. Water potential is maintained during water deficit in Nicotiana tabacum expressing the Escherichia coli glutamate dehydrogenase gene. Plant Growth Regulation, 2006, 50(2): 231-238 ( ) DOI: 10.1007/s10725-006-9140-4
- Ameziane R., Bernhardt K., Lightfoot D.A. Expression of the bacterial gdhA gene encoding a glutamate dehydrogenase in tobacco and corn increased tolerance to the phosphinothricin herbicide. In: Nitrogen in a sustainable ecosystem: from the cell to the plant/M.A. Martins-Loucao, S.H. Lips (eds.). Leiden, 2000.
- Geburek T., Scholz F., Knabe W. Genetic studies by isozyme gene loci on tolerance and sensitivity in air polluted Pinus sylvestris field trial. Silvae genetica, 1987, 36(2): 49-53.
- Wooton J.C. Re-assessment of ammonium-ion affinities of NADP-specific glutamate dehydrogenases. Biochem J., 1983, 209: 527-531.


