Исследование эффективности метода диагностики заболеваний дыхательной системы по анализу выдыхаемого воздуха с применением газоаналитического комплекса
Автор: Кульбакин Д. Е., Обходская Е. В., Обходский А. В., Родионов Е. О., Сачков В. И., Чернов В. И., Чойнзонов Е. Л.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Цель и масштаб исследования: изучить у пациентов зависимость состава выдыхаемого воздуха от патологических процессов, протекающих в дыхательной системе, в том числе рака легких, внебольничной пневмонии и COVID-19.Материал и методы. Исследования проводились на базе газоаналитического комплекса с применением метода нейросетевого анализа данных. Газоаналитический комплекс включает полупроводниковые датчики, с помощью которых измеряются концентрации газовых компонентов в выдыхаемом воздухе с чувствительностью в среднем 1 ppm. По сигналам с датчиков нейронная сеть проводит классификацию и выявляет пациентов с теми или иными патологическими процессами.Результаты. Статистический набор данных для обучения нейронной сети и проверки метода включал пробы от 173 пациентов. В нашем исследовании были взяты пробы выдыхаемого воздуха у групп пациентов со злокачественным новообразованием легких, пневмонией и COVID-19. В случае рака легких параметры диагностического прибора определены на следующих уровнях: чувствительность - 95,24%, специфичность - 76,19%. Для пневмонии и COVID-19 эти параметры составили 97,36 и 98,63% соответственно.Заключение. С учетом известной ценности таких методов диагностики, как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), достигнутые в ходе исследования показатели чувствительности и специфичности газоаналитического комплекса отражают перспективность предлагаемой методики в диагностике опухолевых процессов у больных раком легких, COVID-19 и внебольничной пневмонией.
Рак легких, пневмония, газоаналитический комплекс, полупроводниковые датчики, искусственная нейронная сеть, скрининг пациентов
Короткий адрес: https://sciup.org/149144436
IDR: 149144436 | УДК: 616.2:612.231]-07 | DOI: 10.29001/2073-8552-2023-653
Текст научной статьи Исследование эффективности метода диагностики заболеваний дыхательной системы по анализу выдыхаемого воздуха с применением газоаналитического комплекса
the study was supported by the Russian Science Foundation grant № 23-15-00177 «Theoretical and clinical substantiation of the molecular assessment of the composition of exhaled air for the diagnosis of oncological diseases»,
Kulbakin D.E., Obkhodskaya E.V., Obkhodskiy A.V., Rodionov E.O., Sachkov V.I., Chernov V.I., Choynzonov E.L. Study of the effectiveness of diagnostic method for respiratory system diseases by analyzing the exhaled air using a gas analytical complex. The Siberian Journal of Clinical and Experimental Medicine. 2023;38(4):260–269.
Анализ образцов выдыхаемого воздуха является одним из перспективных методов для массового скрининга населения [1–3]. Для количественного и качественного анализа веществ в этом методе часто применяют устройства газовой хроматографии-масс-спектрометрии или приборы лазерной спектроскопии с флуорометрическими датчиками [4]. Несмотря на большое количество работ, показывающих эффективность этого метода при диагностировании опухолевой патологии дыхательной системы, для его реализации требуется высококвалифицированный персонал, на интерпретацию результатов затрачивается сравнительно много времени, оборудование для проведения анализа является сложным в использовании и дорогостоящим.
В результатах немногочисленных экспериментальных исследований с пациентами для случая рака легкого доказано, что состав выдыхаемого воздуха в организме больных злокачественными новообразованиями в результате метаболизма изменяется [5–7]. Похожие исследования проводились и для пациентов с другими заболеваниями дыхательной системы.
Схожая картина складывается и с инфекционными заболеваниями и особенно проявляется при заболеваниях легких. Возможно, в острой фазе заболевания, например, при пневмонии, происходят структурные изменения всех звеньев газового обмена на уровне «альвеола-капилляр» [8]. Данные изменения приводят к нарушению диффузии различных молекул. Как показывает практика, молекулы кислорода и углекислого газа могут в большей или меньшей степени диффундировать через слои даже при их повреждении и поддерживать газовый состав крови у больных насколько это возможно в зависимости от степени дыхательной недостаточности [9].
Более сложные продукты обмена веществ, имеющие большую молекулярную массу, которые в норме определяются в небольших количествах в выдыхаемом воздухе, практически не будут проходить через функциональный слой газообмена «альвеола-капилляр» и будут выделяться другими экскреторными системами. Следовательно, в выдыхаемом воздухе ожидаемо будет снижение концентрации сложных молекул обмена веществ (спирты, эфиры, альдегиды и т. п.) и повышение их концентрации в крови и моче.
В России за 2021 г. было выявлено 580 415 случаев злокачественных новообразований. Прирост данного показателя по сравнению с 2011 г. составил 41% [10]. На 2020 г. в структуре смертности населения России злокачественные новообразования занимают второе место 14% от общего числа после болезней системы кровообращения, которые составляют 44% от общего числа заболеваний.
Согласно оценкам Международного агентства по изучению рака, в мире в 2020 г. диагностировано более 2,2 млн новых случаев злокачественных новообразований легкого и около 1,8 млн смертей от данной патологии [11]. Прогноз по раку легких остается плохим: даже при наличии достаточного количества ресурсов пятилетняя выживаемость находилась в пределах от 32,9% в Японии и до 13,3% в Великобритании в период 2010–2014 гг. [12].
По сравнению с другими распространенными видами, такими как рак предстательной железы и молочной железы, рак легких имеет гораздо более низкие показатели выживаемости. Долгосрочная выживаемость от рака легких оставалась постоянной и не улучшилась существенно за последние 20 лет. При этом достижения в области компьютерной томографии (КТ), позитронно-эмиссионной томографии (ПЭТ), хирургических методов и послеоперационного лечения, радиотерапии и новых химиотерапевтических агентов значительны [13].
В последние 3 года в связи с распространением COVID-19 большое внимание в мировом научном сообществе уделялось созданию методов для своевременной диагностики и лечения данной патологии. Это заболевание также можно отнести к патологии дыхательной системы. У большинства пациентов начальные симптомы COVID-19 имеют неспецифический характер и развива- ются в течение первых 10 дней, что приводит к высокой степени распространения и препятствует диагностике заболевания на ранней стадии. При этом специфические изменения газового состава выдыхаемого воздуха у больных, инфицированных COVID-19, могут возникать уже на ранней стадии вследствие изменения патофизиологических процессов, протекающих в организме.
В ряде случаев поражение легких у больных COVID-19 сопровождается ложноотрицательными результатами лабораторного исследования мазков из рото- и носоглотки на наличие РНК SARS-CoV-2 (до 23% по ряду исследований) [14]. В подобных ситуациях важна точная дифференциальная диагностика между пневмониями, вызванными COVID-19, и другими этиологическими факторами (вирус гриппа, бактериальные, микоплазменные пневмонии и т. д.). Дифференциальная диагностика в данном случае также будет основываться на особенностях патогенеза пневмоний, не связанных с COVID-19.
Поскольку биохимические процессы, протекающие при опухолевых процессах дыхательной системы, COVID-19 и внебольничной пневмонии, отличаются, высокочувствительные газовые датчики совместно с искусственной нейронной сетью (ИНС) могут обеспечить выявление особенностей газового состава выдыхаемого воздуха, характерных для отдельного заболевания.
Цель работы: исследование образцов выдыхаемого воздуха, полученных у пациентов с раком легкого, COVID-19 и внебольничной пневмонией, с обеспечением единства методики отбора проб на базе типовой газоаналитической системы [15]. На текущей стадии исследования с помощью обученной ИНС проводилась классификация пациентов с заболеваниями и здоровых по характерным сигнальным паттернам, регистрируемым с полупроводниковых газовых датчиков.
Материал и методы
В ходе исследования были взяты пробы выдыхаемого воздуха у 173 человек в возрасте от 18 до 75 лет.
Рентгенологические методы диагностики выполнялись на магнитно-резонансном томографе Siemens Magnetron Essenza 1,5 T и компьютерном томографе Siemens Somatom Emotion 6.
Эндоскопические методы диагностики осуществлялись на двух аппаратах: эндоскопической стойке OLYMPUS EVIS EXERA II серии 180 с применением бронхоскопов (диаметр – 4,8 мм) компании Olympus и эндоскопического видеоблока Karl Storz TELE PACK с применением жесткого телеларингоскопа (диаметр – 5,8 мм, угол зрения – 70°) и фибро-рино-фаринго-ларингоскопе (диаметр – 3,5 мм).
Ультразвуковое исследование лимфатических узлов шеи и органов брюшной полости выполнялось на аппарате Aloka SSD 5500 с использованием линейного датчика с частотой 10 МГц и конвексного – с частотой 3,5 МГц, с применением полипозиционного серошкального сканирования (В-режим) и цветового допплеровского картирования в реальном масштабе времени.
Все участники исследования были разделены на 4 группы (рис. 1): 1-я группа – 21 пациент с морфологически подтвержденными злокачественными новообразованиями в легких Т1-4Т0-3М0-1 фазы. Всем пациентам 1-й группы, согласно действующим международным стандартам и рекомендациям по диагностике злокачественных новообразований, было проведено комплексное об- следование для уточнения распространенности и стадии опухолевого процесса. С этой целью были использованы методы эндоскопической и рентгенологической (спиральная компьютерная и магнитно-резонансная томографии (МРТ)) диагностики, а также в обязательном порядке выполнена морфологическая верификация новообразований по биопсийному материалу.
Во 2-ю группу вошли 38 человек с положительным результатом лабораторного исследования на наличие РНК SARS-CoV-2 с применением методов амплификации нуклеиновых кислот или антигена SARS-CoV-2 путем им-мунохроматографического анализа мазков из носо / ротоглотки. В 3-ю группу вошли 38 человек с подтвержденным диагнозом внебольничной пневмонии и отрицательным тестом на наличие РНК SARS-CoV-2. Всем пациентам 2-й и 3-й групп было проведено стандартное обследование для уточнения степени тяжести заболевания с определением характерного поражения легочной ткани и дыхательной недостаточности. Для этого использовались методы рентгенологической диагностики (обзорная рентгенография легких, КТ легких) и / или ультразвуковое исследование легких и плевральных полостей.
В контрольную 4-ю группу вошли 76 человек, у которых на момент проведения исследования не было ни анамнестически, ни по результатам ранее проведенного клинического, рентгенологического и лабораторного исследования данных о наличии злокачественной патологии, COVID-19 или внебольничной пневмонии. Критерии исключения из контрольной группы: злокачественное образование в анамнезе, наличие факта проведения любого лечения по поводу злокачественной опухолевой патологии, возраст до 18 лет, инфекционная болезнь, проводимое лечение антибиотиками, беременность или кормление грудью.
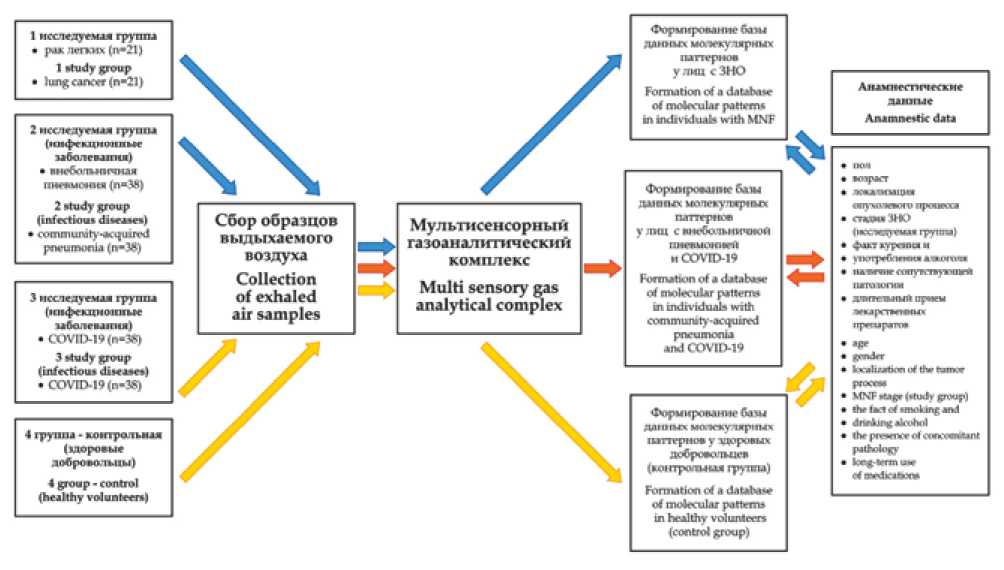
Рис. 1. Дизайн исследования
Fig. 1. Research design
Результаты исследования участников для решения задачи классификации с помощью ИНС были сгруппированы в три датасета. Датасет 1 включал результаты 21 человека из контрольной выборки (4-я группа) и всю 1-ю группу со злокачественными новообразованиями в легких (21 человек). Датасет 2 состоял из результатов всей контрольной 4-й группы (76 здоровых лиц) и суммированных данных о пациентах с COVID-19 и внебольничной пневмонией (76 больных). Датасет 3 включал 2-ю группу (38 пациентов с COVID-19) и 3-ю группу (38 пациентов с внебольничной пневмонией).
Отбор пробы воздуха каждого из 173 исследуемых человек проводился через мешок объемом 5 литров, состо- ящий из двух слоев. Внешний слой сделан из материала EVON толщиной 90 мкм, а внутренний из VLDPE толщиной 50 мкм. Интервал времени от момента взятия пробы до ее обработки прибором не превышал 12 ч. До момента сбора образцов выдыхаемого воздуха пациенты воздерживались от приема еды и питья, кроме воды, не использовали какие-либо средства личной гигиены, такие как ароматизированное мыло или парфюмерию, а также воздерживались от курения и чистки зубов на протяжении 6 ч и более до момента обследования. Благоприятным временем для сбора образцов проб были утренние часы. У больных исследуемых групп образцы выдыхаемого воздуха забирались после проведения всех диагностических процедур.
Для сбора и хранения данных о пробах выдыхаемого воздуха от всех участников исследования применялся типовой газоаналитический комплекс на основе набора полупроводниковых датчиков [15]. Он состоит из пробоотборной камеры, внутри которой установлен измерительный модуль, содержащий 24 MOS датчика (табл. 1), 2 постоянно работающих вентиляторов, распределяющих воздух пробы равномерно по цилиндрической камере объемом 1 литр, а также модуль управления MCU (рис. 2). Перед установкой датчики предварительно прогревались в течение 200 ч. Это обеспечивает их очистку, согласно рекомендациям производителей. Сигналы со всех датчиков при каждом очередном запуске пробоотборного устройства нормируются с помощью управляемых потенциометров на уровень сигнала в диапазоне шкалы аналого-цифрового преобразователя и на один и тот же уровень ноля шкалы измерения.
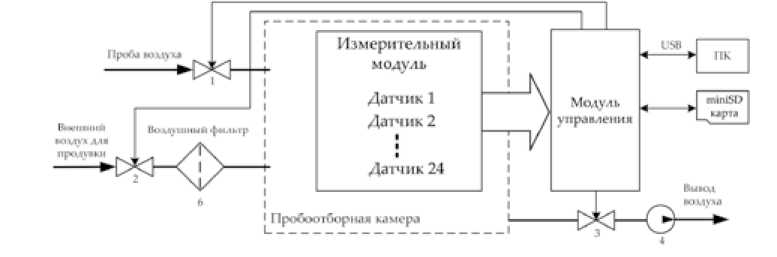
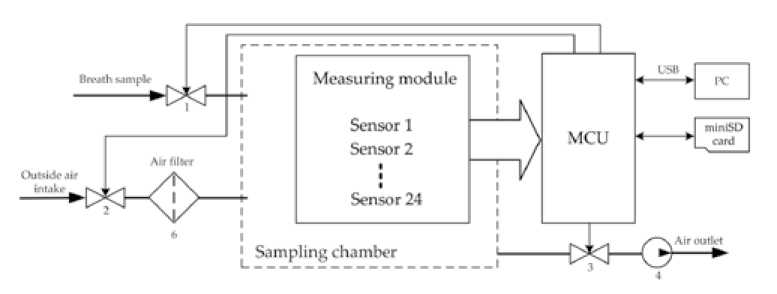
Рис. 2. Обобщенная структура газоаналитического комплекса
Fig. 2. Generalized structure of the gas analytical complex
Таблица 1. Датчики в составе газоаналитического комплекса
Table 1. Sensors of the gas analytical complex
|
№ |
Сенсор Sensor |
Чувствительность Sensitivity |
|
1 |
MP503 |
спирты, дымы, изобутан, метаналь alcohols, smoke, i-butane, methanal |
|
2 |
WSP2110 |
толуол, бензен, метан toluene, benzene, methanal |
|
3 |
MQ3 |
Спирты alcohols |
|
4 |
MQ2 |
изобутан, пропан, метан, спирты, водород, дымы LPG, i-butane, propane, methane, alcohol, hydrogen, smoke |
|
5 |
MQ7 |
CO CO |
|
6 |
MQ131 |
O 3 O 3 |
|
7 |
MQ135 |
NH3,NOx, спирты, бензен, дымы, CO2 ammonia gas, sulfide, benzene, alcohol, smoke, CO2 |
|
8 |
MQ8 |
водород hydrogen |
Окончание табл. 1
End of table 1
|
№ |
Сенсор Sensor |
Чувствительность Sensitivity |
|
9 |
MQ138 |
n-гексан, бензен, NH3, спирты, дымы, CO n-hexane, toluene, acetone, alcohol, smoke, CO |
|
10 |
TGS822 |
метан, CO, изобутан, n-гексан, бензен, этанол, ацетон methane, CO, isobutane, n-hexane, benzene, ethanol, acetone |
|
11 |
TGS2602 |
этанол, толуол, NH3, H2S ethanol, toluene, NH3, H2S |
|
12 |
TGS2620 |
метан, CO, изобутан, водород, этанол methane, CO, i-butane, hydrogen, ethanol |
|
13 |
TGS2600 |
изобутан, водород, этанол i-butane, hydrogen, ethanol |
|
14 |
TGS2603 |
водород, H2S, этанол, метантиол, триметиламин и др. hydrogen, H2S, ethanol, methanethiol, trimethylamine and others |
|
15 |
MQ-6 |
Изобутан, пропан, сниженные углеводородные газы i-butane, propane, LPG |
|
16 |
MQ-5 |
Горючие газы LPG, natural gas , town gas |
|
17 |
MQ-9 |
Угарный газ, углеводородные газы CO, CH4, LPG. |
|
18 |
MQ-136 |
Сульфид водорода hydrogen, sulfide |
|
19 |
MQ-137 |
Аммиак ammonia |
|
20 |
MP-2 |
Пропан, дым C3H8, smoke |
|
21 |
MP-5 |
Углеводороды, горючие газы LPG |
|
22 |
TGS813 |
Метан, пропан, бутан methane, propane, butane |
|
23 |
TGS2609 |
Окись углерода, водород, изобутан, алкоголь, метан CO, hydrogen, isobutane, alcohol, methan |
|
24 |
TGS2610 |
Горючие газы LPG |
Клапан (1) служит для забора пробы выдыхаемого воздуха из мешка, клапаны (2, 3) совместно с насосом – для продувки и очистки камеры. Датчики работают в режиме термоциклирования (3,5 с – нагрев, 5,5 с – охлаждение). До начала взятия пробы после включения прибора датчики прогреваются до тех пор, пока показания не выйдут на заданный постоянный уровень, это занимало до 30 мин. На протяжении всего времени стабилизации показаний датчиков насос продувает камеру. По завершению подготовки пробоотборного устройства осуществлялся ввод воздушной пробы из мешка, в результате чего по каждому отдельному измерению формировался массив значений из 24 числовых рядов.
Программное обеспечение модуля управления активирует процесс сбора данных в течение 90 с. Данные собираются с частотой дискретизации 50 Гц с каждого датчика. Режим термоциклирования между пробами не прерывается для исключения дестабилизации работы датчиков.
Методика анализа и используемый метод диагностики
Исследуемые и контрольная группа участников исследования были сопоставимы по полу и возрасту. Отбор проб проводился в помещении, где размещался газоаналитический комплекс, температура окружающего воздуха поддерживалась в среднем на уровне +24 °С. После проведения процедуры отбора проб пациенты находились под наблюдением в течение 30 мин для оценки их общего состояния. На начальном этапе исследования изучалось влияние патологии дыхательной системы именно на состав выдыхаемого воздуха. Поэтому весь набор данных при обработке не использовался. В дальнейшем учет дополнительных сведений (например, факт курения, пол, возраст и др.) при обработке данных может улучшить работу нейронной сети при классификации участников исследования и методику диагностики в целом.
После наполнения выдыхаемым воздухом мешок подключается к входному клапану пробоотборного устройства в составе газоаналитического комплекса. Для инжекции пробы воздуха в пробоотборную камеру открываются клапаны 1 и 3, затем на 2 с включается насос 4. Автоматизация процесса измерения обеспечивает всегда одинаковый объем вводимого воздуха для проб всех пациентов, равный 250 мл. После ввода пробы в камеру входной и выходной клапаны закрываются, начинается процесс сбора данных. Датчики на протяжении всего времени работы комплекса работают в режиме термоциклирования, и за время сбора данных измеряется нескольких полных циклов. По завершении сбора данных включается продувка устройства очищенным воздухом.
Исходя из поставленных задач исследования, наиболее подходящим вариантом архитектуры нейронной сети для классификации здоровых добровольцев и пациентов с заболеваниями дыхательной системы является нейронная сеть прямого распространения типа персептрон. На вход нейронной сети подавались значения сигналов соотношения 4 и 1 периодов термоциклирования с 24 датчиков от точки остывание-нагрев до точки нагрев-остывание, всего 17 × 24 значений для каждого пациента. Общая размерность входного слоя нейронной сети составила 408. Размерность скрытого слоя составила 816 значений. Выходной слой – один нейрон, принимающий безразмерные значения в диапазоне от «–1» до «1».
Результаты и обсуждение
В ходе исследования проведено три серии экспериментов на трех датасетах, в которых определялись возможности нейронной сети для разделения здоровых лиц и пациентов с раком легкого, здоровых лиц и пациентов с COVID-19 или внебольничной пневмонией, пациентов с COVID-19 и пациентов с внебольничной пневмонией. Такой подход позволяет использовать характерные преимущества бинарных классификаторов. В перспективе подход может использоваться в диагностике заболеваний путем последовательного применения обученных нейронных сетей.
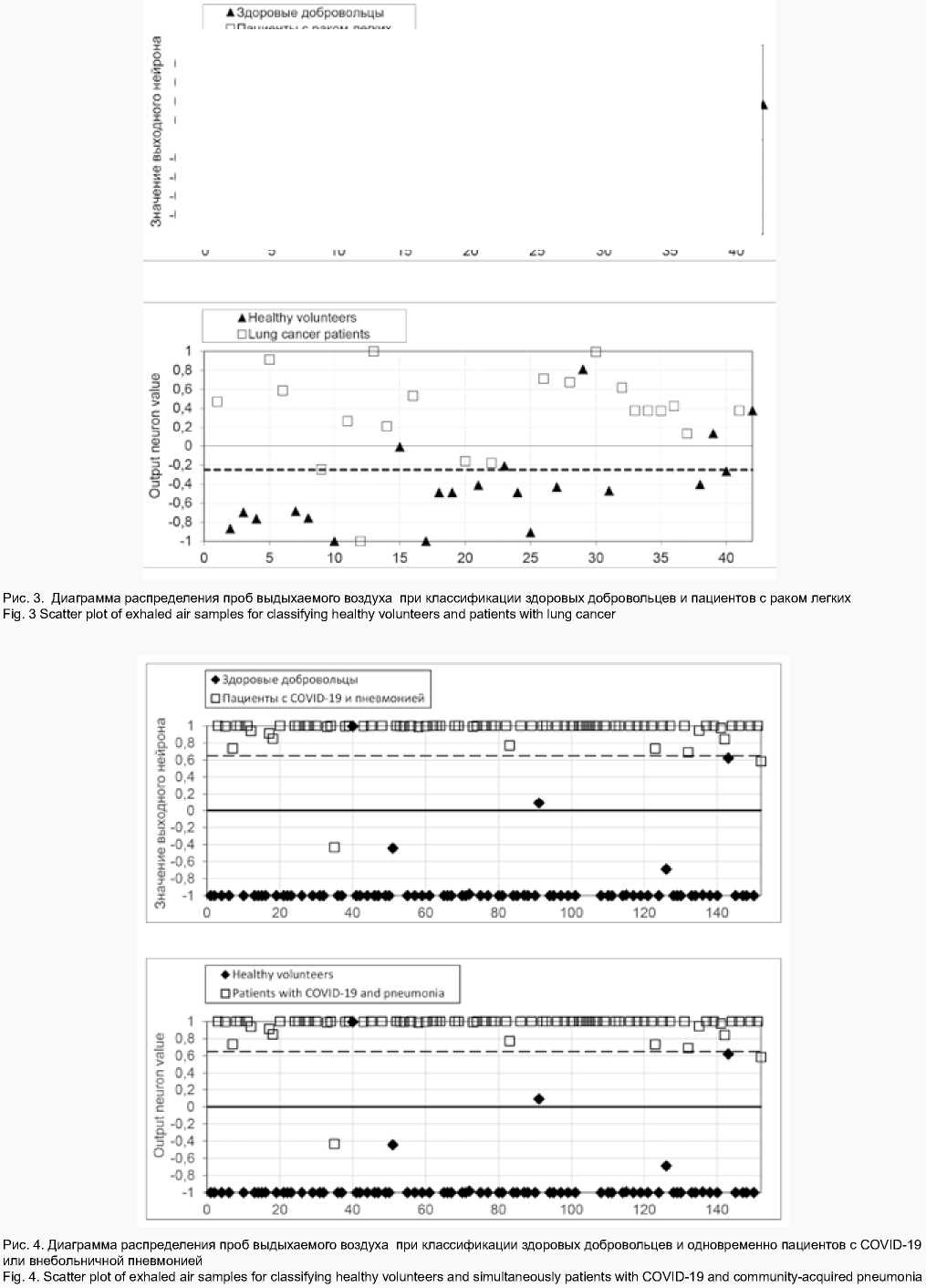
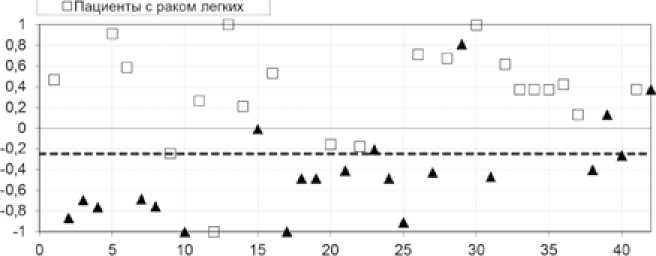
В первом эксперименте соотношение числа пациентов с раком легкого и здоровых лиц было одинаково, что необходимо для обеспечения высокого качества обучения ИНС. Результаты перекрестной проверки для датасета 1 представлены на рис. 3. Точность составила 85,71%, чувствительность – 95,24% (один больной раком легкого был неверно классифицирован), специфичность – 76,19%.
Здесь и далее на диаграммах по оси абсцисс откладывается порядковый номер участника эксперимента. Уточненный порог разделения проб здоровых добровольцев и пациентов с раком легких составил –0,25. Значение выходного нейрона выше порога разделения проб и до максимального значения (+1) для пациентов с раком легких означает верную работу классификатора, значение выходного нейрона менее –0,25 является для этой группы ошибочным. Для здоровых лиц верную работу классификатора означает значение выходного нейрона ниже порога разделения проб и до значения (–1), значение более –0,25 ошибочно для этой группы.
Во втором эксперименте на датасете 2 получены результаты, представленные на рис. 4. Точность диагностики составила 97,98%, чувствительность – 97,36%, специфичность – 98,63%. Уточненный порог разделения проб здоровых добровольцев и пациентов с COVID-19 или с внебольничной пневмонией составил 0,65. Если значение на выходном нейроне после обработки данных было выше порога, то нейронная сеть классифицировала пробу с патологией, если ниже – пробу здорового добровольца.
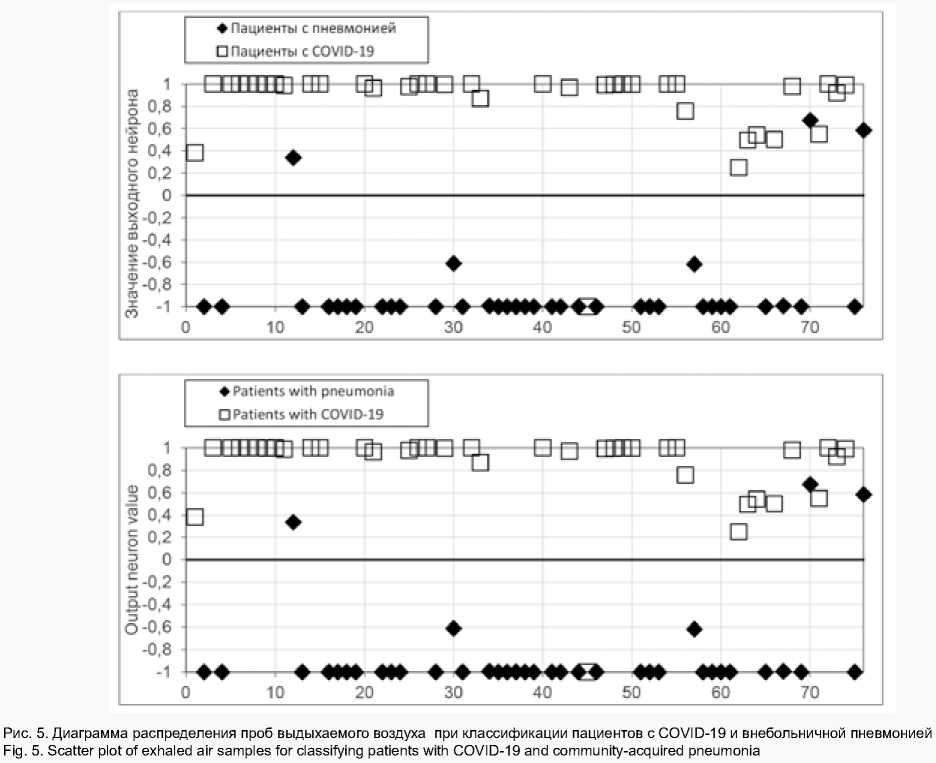
Результаты третьего эксперимента на датасете 3 представлены на рис. 5. Порог разделения проб равен нулю; если значение на выходном нейроне выше порога, то нейронная сеть классифицировала пробу от пациента с COVID-19, если ниже – то от пациента с внебольничной пневмонией. Точность классификации составила 94,87%, чувствительность – 97,5%, специфичность – 92,11%.
В таблице 2 приведены сводные результаты газоаналитического метода диагностики, основанного на применении полупроводниковых неселективных датчиков.
Таблица 2. Достигнутые параметры газоаналитического комплекса
Table 2. Achieved parameters of the gas analytical complex
|
Датасет для ИНС Dataset for ANN |
Точность Precision |
Чувствительность Sensitivity |
Специфичность Specificity |
|
1 |
85,71% |
95,24% |
76,19% |
|
2 |
97,98% |
97,36% |
98,63% |
|
3 |
94,87% |
97,5% |
92,11% |
Примечание: ИНС – искусственная нейронная сеть.
Note: ANN – artificial neural network.
Ученые г. Ухань (Китай) сообщили о неинвазивном подходе к выявлению и последующему наблюдению за лицами, находящимися в группе риска или имеющими инфекцию COVID-19, как инструменте, способном помочь в борьбе с пандемией [16]. В предлагаемом авторами методе используется неинвазивное устройство, состоящее из гибридной сенсорной матрицы на основе наноматериалов, которое может обнаруживать специфические для заболевания биомаркеры выдыхаемого воздуха для быстрой диагностики заболевания.
Проведенное исследование показывает, что для анализа состава выдыхаемого воздуха могут применяться стандартизированные серийно выпускаемые полупроводниковые сенсоры. COVID-19 существенно влияет на состав выдыхаемого воздуха, который сильно отличается от схожих по симптомам заболеваний, например, вне-больничной пневмонии. Накопление данных по составу выдыхаемого воздуха и их систематизация в сочетании с технологиями нейронных сетей может привести к созданию устройств для неинвазивной диагностики целого ряда заболеваний, в том числе рака легких.
Анализ дыхания с целью скрининга опухолей в легких и других заболеваний дыхательной системы является быстро развивающейся областью. Ускорение темпов разработки надежной панели маркеров, которые могут быть применены для клинического использования, потребует стандартизированного подхода в трех ключевых обла- стях, таких как разработка стандартизированных и гибких протоколов отбора проб дыхания, многоцентровые клинические испытания и понимание биохимических процессов, протекающих при развитии и прогрессировании заболеваний дыхательной системы.
Предложенная методика позволяет диагностировать рак легких с чувствительностью 95,24% и специфичностью 76,19%. Достаточно высокие значения операционных характеристик теста могут быть обусловлены наличием в выдыхаемом воздухе информативных маркеров рака легкого, которые улавливаются набором датчиков и различаются нейронной сетью с малой погрешностью. Задача детекции пациентов с COVID-19 или с внеболь-ничной пневмонией в противовес здоровым лицам решена с достижением очень высоких характеристик метода: чувствительность – 97,36%, специфичность – 98,63%. Практически такие же параметры получены при дифференцировке случаев COVID-19 и пациентов с внеболь-ничной пневмонией: чувствительность – 97,5%, специфичность – 92,11%.
Анализ газового состава выдыхаемого воздуха у пациентов с COVID-19 показал практически полное отсутствие молекулярно-сложных продуктов обмена веществ (эфиры, спирты и др.), что является характерным признаком поражения газового обмена на уровне альвеола-капилляр и само по себе может являться диагностическим маркером COVID-19.
Заключение
Проведен анализ проб выдыхаемого воздуха у четырех групп людей: пациентов с раком легких, COVID-19, пациентов с пневмонией, не связанной с COVID-19, и здоровых добровольцев, которые на момент исследования не имели признаков респираторной инфекции, воспаления или опухолевого процесса в легких. Все полученные пробы оцифрованы с помощью разработанного газоаналитического комплекса.
С учетом известной диагностической ценности столь точных и дорогостоящих методов диагностики, как КТ и МРТ [17, 18], достигнутые в ходе исследования показатели чувствительности и специфичности газоаналитического комплекса наглядно отражают пер- спективность предлагаемой методики в диагностике рака легких, COVID-19 и воспалительных заболеваний легких, не связанных с COVID-19. Отличительные особенности применяемого газоаналитического комплекса заключаются в неинвазивности методики, мобильности и возможности размещения в медицинских учреждениях разного уровня. Использование данного скринингового метода даст возможность осуществить отбор лиц, нуждающихся в детальном обследовании с применением традиционных методов диагностики (эндоскопические, рентгенологические и морфологические). Это повысит эффективность и своевременность выявления заболеваний на ранней стадии и позволит проводить функ-ционально-щадящее лечение с сохранением высокого качества жизни.
Список литературы Исследование эффективности метода диагностики заболеваний дыхательной системы по анализу выдыхаемого воздуха с применением газоаналитического комплекса
- Krilaviciute A., Stock C., Leja M., Brenner H. Potential of non-invasive breath tests for preselecting individuals for invasive gastric cancer screening endoscopy. J. Breath Res. 2018;12(3):036009. https://doi.org/10.1088/1752-7163/aab5be.
- Opitz P., Herbarth O. The volatilome - investigation of volatile organic metabolites (VOM) as potential tumor markers in patients with head and neck squamous cell carcinoma (HNSCC). J. Otolaryngol. Head Neck Surg. 2018;47(1):42. https://doi.org/10.1186/s40463-018-0288-5.
- Leunis N., Boumans M.-L., Kremer B., Din S., Stobberingh E., Kessels A.G.H. et al. Application of an electronic nose in the diagnosis of head and neck cancer. Laryngoscope. 2013;124(6):1377-1381. https://doi.org/10.1002/lary.24463.
- Jia Z., Patra A., Kutty V.K., Venkatesan T. Critical review of volatile organic compound analysis in breath and in vitro cell culture for detection of lung cancer. Metabolites. 2019;9(3):52. https://doi.org/10.3390/metabo9030052.
- Feinberg T., Alkoby-Meshulam L., Herbig J., Cancilla J.C., Torrecilla J.S., Mor N.G. et al. Cancerous glucose metabolism in lung cancer - Evidence from exhaled breath analysis. J. Breath Res. 2016;10(2):026012. https://doi.org/10.1088/1752-7155/10/2/026012.
- Handa H., Usuba A., Maddula S., Baumbach J.I., Mineshita M., Miyazawa T. Exhaled breath analysis for lung cancer detection using ion mobility spectrometry. PLoS One. 2014;9(12):e1145557. https://doi.org/10.1371/journal.pone.0114555.
- Hakim M., Broza Y.Y., Barash O., Peled N., Phillips M., Amann A. et al. Volatile organic compounds of lung cancer and possible biochemical pathways. Chem. Rev. 2012;112(11):5949-5966. https://doi.org/10.1021/cr300174a.
- Yu Y., Fei A. Atypical pathogen infection in community-acquired pneumonia. Biosci. Trends. 2016;10(1):7-13. https://doi.org/10.5582/bst.2016.01021.
- Arnold F., Summersgill J., Ramirez J. Role of atypical pathogens in the etiology of community-acquired pneumonia. Semin. Respir. Crit. Care Med. 2016;37(6):819-828. https://doi.org/10.1055/s-0036-1592121.
- Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.). Состояние онкологической помощи населению России в 2021 году. Москва: МНИОИ им. П.А. Герцена. Филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2022:239. URL: https://oncology-association.ru/wp-content/uploads/2023/08/sop-2022-el.versiya_compressed.pdf (08.11.2023).
- The Global Cancer Observatory (GCO): Global variations in lung cancer incidence by histological subtype in 2020: a population-based study. URL: https://gco.iarc.fr (11.10.2023).
- Allemani C., Matsuda T., Di Carlo V., Harewood R., Matz M., Nikšić M. et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018;391(10125):1023-1075. https://doi.org/10.1016/S0140-6736(17)33326-3.
- Ghosal R., Kloer P., Lewis K.E. A review of novel biological tools used in screening for the early detection of lung cancer. Postgrad. Med. J. 2009;85(1005):358-363. https://doi.org/10.1136/pgmj.2008.076307.
- Levine-Tiefenbrun M., Yelin I., Uriel H., Kuint J., Schreiber L., Herzel E. et al. Association of COVID-19 RT-qPCR test false-negative rate with patient age, sex and time since diagnosis. J. Mol. Diagn. 2022;24(2):112-119. https://doi.org/10.1016/j.jmoldx.2021.10.010.
- Chernov V.I., Choynzonov E.L., Kulbakin D.E., Obkhodskaya E.V., Obkhodskiy A.V., Popov A.S. et al. Cancer diagnosis by neural network analysis of data from semiconductor sensors. Diagnostics. 2020;10(9):677. https://doi.org/10.3390/diagnostics10090677.
- Shan B., Broza Y.Y., Li W., Wang Y., Wu S., Liu Z. et al. Multiplexed nanomaterial-based sensor array for detection of COVID-19 in exhaled breath. ACS Nano. 2020;14(9):12125−12132. https://doi.org/10.1021/acsnano.0c05657.
- Becker M., Zaidi H. Imaging in head and neck squamous cell carcinoma: the potential role of PET/MRI. Br. J. Radiol. 2014;87(1036):20130677. https://doi.org/10.1259/bjr.20130677.
- Rivera M.P., Mehta A.C., Wahidi M.M. Establishing the diagnosis of lung cancer: Diagnosis and management of lung cancer, 3rd ed.: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143(5 Suppl.):e142S-e165S. https://doi.org/10.1378/chest.12-2353.


