Исследование электрохимических свойств сульфидных минералов в кислых средах
Автор: Макаров Д.В., Павлов В.В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 1 т.7, 2004 года.
Бесплатный доступ
С применением методов потенциометрии, ИК-спектроскопии и оптической микроскопии исследованы электрохимические свойства сульфидных минералов в кислых средах. Последовательность окисления сульфидных минералов, определенная исходя из ряда электродных потенциалов в растворе H2SО4: сфалерит → галенит → пентландит → пирротин → пирит; в растворе FeCl3: галенит → пентландит → сфалерит → пирит → халькопирит → пирротин. В условиях выведенных из эксплуатации хвостохранилищ из-за лучшей аэрации и насыщения кислородом поровых растворов происходит сдвиг потенциалов сульфидных минералов в анодную область, что обусловливает увеличение скорости окисления сульфидов и загрязнение окружающей среды тяжелыми металлами. Состав продуктов окисления минералов определяется гидродинамическими условиями и концентрацией кислорода и ионов трехвалентного железа в растворе.
Короткий адрес: https://sciup.org/142100803
IDR: 142100803
Текст научной статьи Исследование электрохимических свойств сульфидных минералов в кислых средах
-
1. Введение
Реализация концепции рационального недропользования предполагает широкое вовлечение в разработку сырья техногенного происхождения ( Трубецкой , 1995; Чантурия , 1995; Воробьев , 2001). Сульфидсодержащие отходы горнопромышленного комплекса, с одной стороны, содержат значительные запасы ценных компонентов, с другой – наносят ущерб окружающей среде. Они относятся к группе наиболее опасных в экологическом плане горнопромышленных отходов ( Калинников и др ., 1997). Сульфиды железа и цветных металлов в процессе хранения интенсивно окисляются, что приводит к закислению поверхностных и подземных вод, загрязнению тяжелыми металлами. К наиболее существенным факторам, определяющим механизм и кинетику окислительных процессов, наряду с климатическими условиями, относятся тип минеральных ассоциаций и гидрологический режим.
-
2. Методика экспериментов
Установленные закономерности физико-химических процессов, протекающих в сульфидсодержащих горнопромышленных отходах, могут быть использованы при создании новых геотехнологий, направленных на снижение негативного влияния сульфидсодержащих отходов, и стать основой для разработки гидрометаллургических методов переработки техногенного сырья.
В составе горнопромышленных отходов принципиально возможна реализация нескольких механизмов окисления сульфидов, однако электрохимические процессы зачастую вносят определяющий вклад (Чантурия и др., 1998). Известно, что большинство сульфидных минералов обладает электронной проводимостью, обусловливающей наличие скачка потенциала на границе сульфид-раствор, причем такие сульфиды, как пентландит (Fe,Ni)9S8, ковеллин CuS, галенит PbS и пирротин Fe1-xS, по проводимости приближаются к металлам (Чантурия, Вигдергауз, 1993). К минералам-полупроводникам с хорошей проводимостью относятся пирит FeS2, борнит Cu5FeS4, халькозин Cu2S, халькопирит CuFeS2, арсенопирит FeAsS. Электрохимический механизм растворения контактирующих сульфидов обусловлен, по мнению некоторых исследователей, образованием локальных микрогальванических пар (Макаров и др., 1979). По нашему мнению, этот процесс в значительной степени определяется присутствием в растворе окислителей, прежде всего – кислорода и ионов трехвалентного железа. В связи с тем, что последовательность окисления сульфидов определяется величинами стационарных потенциалов, а кинетика процессов – их разностью, представляло интерес изучение величин электродных потенциалов сульфидных минералов в зависимости от рН раствора и концентрации окислителя. Известно, что для сульфидных минералов характерно образование сростков с другими сульфидами или оксидами, что также оказывает влияние на окислительные процессы (Чантурия и др., 1998). Поэтому рассматривали также окисление минералов в контакте.
Для исследований использовали:
-
1) пирротин из богатой руды Печенгского рудного поля и синтетический пирротин. Синтез пирротина осуществляли по методике, описанной А.М. Калинкиным с соавторами ( Kalinkin et al. , 2000). Состав синтетического минерала по данным химического анализа отвечал Fe10S11, химический состав природного пирротина может быть представлен в виде формулы (Fe0.8706Ni0.0063Co0.0002)0.8771S;
-
2) сплошную медно-никелевую руду Печенгского рудного поля;
-
3) пирит Ковдорского месторождения апатито-магнетитовых руд, средний состав минерала Fe 0.9653 Ni 0.0023 Cu 0.0114 Co 0.0329 S 2 ;
-
4) галенит (Рудный Алтай), состав минерала соответствовал PbS;
-
5) сфалерит (Рудный Алтай), имеющий состав Zn 0.0940 Cd 0.0128 Fe 0.010 Mn 0.0456 S, высокожелезистый сфалерит Zn 0.0832 Cd 0.0022 Fe 0.156 Mn 0.0211 S и синтетический сфалерит стехиометрического состава, полученный по методике ( Gärd et al. , 1995).
-
3. Результаты и их обсуждение
Для измерений потенциалов применяли стандартную электрохимическую ячейку. Исследуемые сульфиды представляли собой торцевые электроды, поверхность которых перед опытами полировали. В качестве электрода сравнения использовали хлорсеребряный электрод. Измерение разности потенциалов осуществляли с помощью потенциостата ПИ-50.1 в течение 5000 минут. Условия насыщенного воздухом раствора в зоне аэрации хвостохранилища моделировали в открытой ячейке со свободным доступом воздуха. Раствор с недостатком кислорода (зона хвостохранилища ниже уровня оборотных и грунтовых вод) моделировали продувкой через электролит аргона с изоляцией ячейки через гидравлический затвор.
Как показано ранее ( Чантурия и др ., 2000), по соотношению рудных и нерудных материалов сульфидсодержащие отходы и заскладированные руды можно разделить на две группы. Первую группу составляют продукты, в которых содержания сульфидов и нерудных минералов соизмеримы. Образующиеся при окислении сульфидов кислоты и кислые соли не могут быть нейтрализованы взаимодействием с нерудными минералами. Вследствие этого поровые растворы характеризуются устойчивой кислой реакцией с преобладанием сульфат-ионов. Вторую группу (около 90 % от общего числа) составляют продукты, в которых содержание нерудных минералов на порядок и более превышает содержание сульфидов. Величина pH поровых растворов, соотношение в них сульфат- и гидрокарбонат-ионов в этом случае будут зависеть от состава нерудных минералов. Нами для измерений были выбраны растворы H2SO4, FeSO4 и FeCl3. Использование хлоридных растворов разной концентрации обусловлено проводящимися в последнее годы исследованиями по выщелачиванию сульфидных концентратов в хлоридных растворах ( Dutrizac , 1992).
Обработку минералов в режиме попеременного увлажнения и высыхания проводили дистиллированной водой и раствором FeSO 4 по методике описанной в работе ( Kalinkin et al. , 2001).
Микроскопические исследования выполнены с использованием микроскопа Versamet. Спектроскопический анализ продуктов окисления сульфидов проводили на Фурье-ИК спектрометре Perkin-Elmer 2000.
В результате проведенных измерений в 0.1 N растворе H2SО4 для стационарных потенциалов в воздушной атмосфере над раствором установлен следующий ряд в порядке убывания: пирит > пирротин > пентландит > галенит > железистый сфалерит (рис. 1). При продувке раствора аргоном потенциалы сульфидов располагаются в той же последовательности, но потенциалы минералов несколько отрицательнее (рис. 2). Исходя из полученного ряда потенциалов, в первую очередь, будут подвержены окислению сфалерит и галенит. Эти минералы относятся к одним из самых распространенных сульфидов.
При окислении сфалерита основную опасность для окружающей среды несут катионы цинка, кадмия и другие, содержащиеся в виде изоморфных примесей. Учитывая малые значения величин ПДК, окисление сфалерита может создать концентрации цветных металлов в поровых растворах, многократно превышающие ПДК, и привести к загрязнению поверхностных и подземных вод.
В галените устанавливаемые химическим анализом примеси (Ag, Cu, Zn, Bi, As и др.) связаны, как правило, с микровключениями других минералов. Продукты окисления галенита – PbO, Pb(OH)2, PbSO 4 – нерастворимы в воде. Вследствие этого загрязнение свинцом более вероятно в непосредственной близости от источника.
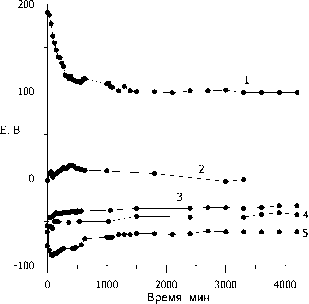
Рис. 1. Потенциалы сульфидных минералов в растворе серной кислоты относительно хлорсеребряного электрода сравнения в атмосфере воздуха: 1 – пирит; 2 – пирротин; 3 – пентландит; 4 – галенит; 5 – железистый сфалерит.
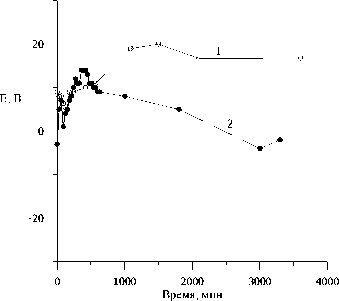
Рис. 2. Кривые изменения значений потенциалов пирротина во времени.
1 – воздушная атмосфера;
2 – продувка аргоном.
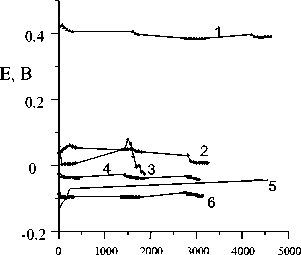
Время, мин
Рис. 3. Потенциалы минералов в деаэрированном аргоном 0.1 N растворе FeCl3. 1 – пирротин; 2 – халькопирит; 3 – пирит; 4 – железистый сфалерит; 5 – пентландит;
6 – галенит.
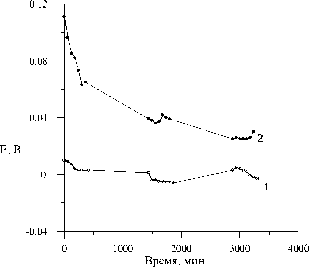
Рис. 4. Потенциалы пирита в деаэрированных аргоном растворах FeCl3 относительно хлорсеребряного электрода сравнения. Концентрации растворов: 1 – 0.025 N; 2 – 0.2 N.
В деаэрированном аргоном растворе FeCl 3 (рН = 1.96) получен другой ряд потенциалов в порядке убывания: пирротин > халькопирит > пирит > сфалерит > пентландит > галенит (рис. 3). Вообще, при переходе от щелочных к кислым растворам характерно смещение потенциала пирротина в катодную область относительно других сульфидов. Это связано с изменением реакции, обусловливающей стационарный потенциал минерала. В случае раствора FeCl 3 , очевидно, сдвиг потенциала пирротина связан с участием ионов трехвалентного железа в потенциалопределяющей реакции.
Рис. 4 иллюстрирует зависимость величины стационарного потенциала пирита от концентрации ионов трехвалентного железа. С увеличением концентрации окислителя потенциал минерала смещается в катодную область.
Влияние гидрологических условий и концентрации окислителя в растворе на механизм и кинетику окисления сульфидных минералов иллюстрирует рис. 5а. Видно, что стационарный потенциал сульфидного минерала в случае большей активности окислителя в растворе принимает более положительное значение, что и наблюдается в эксперименте (рис. 4). При этом растет скорость окисления и, возможно, изменяется механизм процесса: происходит окисление сульфидной серы до более высоких степеней окисления. Известно, что сила катодного тока прямо пропорциональна разности активностей окислителя в объеме раствора и у поверхности минерала и обратно пропорциональна толщине диффузионного слоя. При достаточно большой скорости диффузии возможен переход к электрохимической кинетике, что, вероятно, наблюдается в условиях хранения горнопромышленных отходов при попеременном увлажнении – высыхании, или в тонких пленках электролита.
Таким образом, при попеременном увлажнении и высыхании образование продуктов, неблагоприятно влияющих на окружающую среду, протекает более интенсивно. В процессе эксплуатации хвостохранилищ хвосты находятся ниже зеркала оборотной воды. В этих условиях интенсивность образования водорастворимых продуктов невелика. Вследствие различий в составе газовой фазы раствора на выведенных из эксплуатации и действующих хвостохранилищах создаются принципиально разные условия для окисления сульфидов. В условиях выведенных из эксплуатации хвостохранилищ из-за лучшей аэрации и насыщения кислородом поровых растворов происходит сдвиг потенциалов сульфидных минералов в анодную область, что обусловливает увеличение скорости окисления сульфидов и загрязнение окружающей среды тяжелыми металлами. При этом большое значение имеет рН поровых растворов. Известно, что в кислых растворах растворимость кислорода снижается, и его влияние относительно невелико. В этих условиях основным окислителем является ион Fe3+. Состав продуктов окисления минералов также определяется гидрологическими условиями и концентрацией окислителя в растворе.
Разность потенциалов, определяющая электрохимическое окисление минералов, может возникать вследствие неоднородности сульфидных зерен и наличия сростков их с другими сульфидами или оксидами. Раскрытые сульфидные зерна неоднородны по химическому составу и кристаллической структуре (например, моноклинный и гексагональный пирротины, сфалериты с разным содержанием железа и т.д.), некоторые сульфиды имеют дефектную структуру и неравномерное распределение дефектов; различные грани, грани и ребра, ребра и вершины одного и того же кристалла могут иметь различный потенциал ( Чантурия и др ., 1998). Для сульфидных минералов характерно образование сростков ( Бочаров , 1985; Чантурия и др. , 1998). Нахождение сростков сульфидов в агрессивной среде (растворе электролита) приводит к тому, что скорость окисления электроположительного минерала замедляется, а более электроотрицательного – ускоряется ( Скорчелетти , 1973). Роль гальваноэффекта при флотации сульфидов исследована рядом авторов ( Pozzo et al ., 1990; Bozkurt et al. , 1998). Процессы, протекающие на различных участках поверхности минералов, могут быть описаны следующими схемами:
-
• на анодных участках:
MenSm = nMem++mS+mne-, (1)
-
• на катодных участках:
2Н 2 О+O 2 +4е- = 4ОН- (2)
или
Fe3++e-= Fe2+.
При этом в зависимости от гидрологических условий и концентрации окислителя возможно окисление сульфидной серы до сульфит-, тиосульфат- и сульфат-ионов (рис. 5а).
Диаграмма на рис. 5б иллюстрирует влияние контакта различных сульфидных минералов на процесс окисления. Соотношение площадей контактирующих минералов, характер катодного процесса на их поверхностях, разность потенциалов будут определять скорости окисления минералов в контакте. В случае, показанном на рис. 5б, на поверхности минерала Me n S m сосредоточен весь анодный процесс.
Микроскопические исследования обработанных в режиме попеременного увлажнения-высыхания дистиллированной водой синтетического
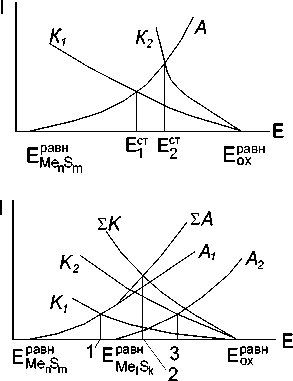
Рис. 5. а) Влияние концентрации окислителя в растворе на скорость окисления сульфидного
минерала;
б) окисление сульфидных минералов в контакте. Обозначения: Е – потенциал, I – ток,
Ест – стационарный потенциал,
равн – равновесный потенциал сульфида, Me n S m
и природного пирротинов показали, что в случае природного минерала окисление поверхности происходит с большей скоростью. Этот факт может быть объяснен как наличием изоморфных примесей в природном минерале, так и неоднородностью его поверхности в сравнении с синтетическим.
На рис. 6 представлены микрофотографии
E с р т авн – равновесный потенциал окислителя,
А и К, соответственно – анодная и катодная кривые, 1 – стационарный потенциал минерала MenSm, 2 – cтационарный потенциал минерала MelSk, 3 – cтационарный потенциал минералов в контакте.
сростков пирита, галенита и сфалерита. После
обработки 0.05 N раствором FeSO 4 в режиме попеременного увлажнения-высыхания (16 часов) наблюдается преимущественное окисление галенита, особенно интенсивное вблизи контакта с пиритом (рис. 6, в центре), что обусловлено его более отрицательным потенциалом и относительно низкой электропроводностью раствора ( Скорчелетти , 1973). В сростках со сфалеритом окисление поверхности галенита менее интенсивно (рис. 6, справа).
Очевидно, с такими же процессами связано изменение кинетики окислительного процесса и его механизма, зафиксированное при спектроскопических исследованиях смесей сульфидных минералов.

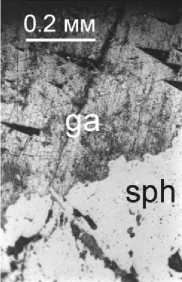
Рис. 6. Микрофотографии сростков сульфидов: ga – галенит, py – пирит, sph – сфалерит. Исходный сросток (слева) и сростки после обработки в режиме увлажнение-высыхание.
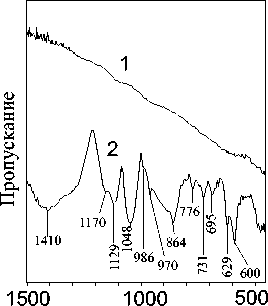
Сопоставление спектров обработанных в режиме попеременного увлажнения-высыхания 0.05 N раствором FeSO4 пирита, галенита и смеси галенита и пирита показало существенные различия. Известно, что электродный потенциал галенита отрицательнее, поэтому на его поверхности преимущественно протекает анодная реакция. Для пирита процессы поверхностного окисления характерны уже для необработанного минерала. При обработке эти процессы существенно ускоряются, при этом наблюдается образование на поверхности минерала α -FeOOH и Fe2(SO4)3. Наглядно сопоставление ИК-спектров галенита, обработанного в течение 10 часов, и обработанной в тех же условиях смеси галенита и пирита, представлено на рис. 7а. На спектрах смеси минералов фиксируются полосы, отвечающие группам SO 4 2- (600, 629, 970, 1170 cм-1), S 2 O 3 2-(986 и 1129 cм-1) и CO 3 2- (1410 cм-1) ( De Donato et al ., 1999), и характеризующие окисление поверхности галенита с образованием сульфата, тиосульфата и карбоната свинца, в то время как после обработки одного галенита заметных изменений спектра не наблюдается. Полосы в интервале 600-800 см-1 (рис. 7а) относятся к продуктам поверхностного окисления пирита ( α -FeOOH).
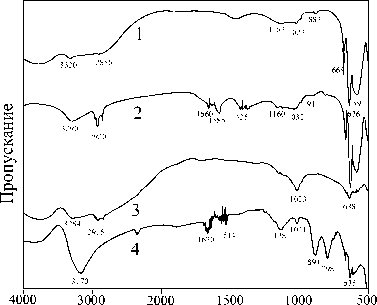
Характер окислительных процессов на поверхности сфалерита обусловлен низкой электропроводностью минерала. Именно этим объясняется отсутствие заметных изменений поверхности минерала (рис. 7б) и спектров обработанного сфалерита. Вероятно, основной вклад в процесс окисления сфалерита вносят процессы неокислительного растворения, так что режим попеременного увлажнения водой – высыхания не является "жестким" для этого минерала. В.А. Чантурия и В.Е. Вигдергауз (1993), изучавшие электрохимическое поведение высокожелезистого сфалерита, отмечают, что низкая электропроводность сфалерита обусловливает значительную зависимость электрохимического поведения от электронной структуры. У хорошо проводящих сульфидов влияние электронной структуры маскируется эффектом их химической природы. В то же время наличие даже малых примесей в сфалерите, не изменяя его химической природы, проявляется в электрохимическом поведении. ИК-спектр обработанного в течение 50 часов высокожелезистого сфалерита заметно отличается от спектров исходного синтетического минерала и природного маложелезистого сфалерита, обработанного в режиме попеременного увлажнения-высыхания в тех же условиях. Ряд полос может свидетельствовать о наличии сульфата железа Fe2(SO4)3.nH2O ( De Donato et al ., 1999), что наблюдается для пирита.
см -1 см -1
-
а) б)
Рис. 7. ИК-спектры:
-
а) 1 – галенит, время обработки 10 часов, 2 – смесь галенита и пирита (1:1), время обработки то же.
-
б) сфалерит, 1 – синтетический исходный, 2 – синтетический, обработанный в течение 50 часов, 3 – природный железистый, обработанный в течение 50 часов, 4 – смесь синтетических сфалерита и пирротина (1:1), время обработки то же.
4. Заключение
1) Вследствие различий в составе газовой фазы раствора на выведенных из эксплуатации и действующих хвостохранилищах создаются принципиально разные условия для электрохимического окисления сульфидов. В условиях выведенных из эксплуатации хвостохранилищ из-за лучшей аэрации и насыщения кислородом поровых растворов происходит сдвиг потенциалов сульфидных минералов в анодную область, что обусловливает увеличение скорости окисления сульфидов и загрязнение окружающей среды тяжелыми металлами. Состав продуктов окисления минералов определяется гидродинамическими условиями и концентрацией кислорода и ионов трехвалентного железа в растворе.
2) Последовательность окисления сульфидных минералов, определенная исходя из ряда электродных потенциалов, сохраняется независимо от состава газовой фазы раствора, но изменяется при переходе от раствора серной кислоты к раствору FeCl3:
в растворе H 2 SО 4 : сфалерит → галенит → пентландит → пирротин → пирит;
в растворе FeCl 3 : галенит → пентландит → сфалерит → пирит → халькопирит → пирротин.


