Исследование кинетики цементации кадмия в присутствии ПАВ
Автор: Агеенко Егор Игоревич, Колесников Александр Васильевич, Павловский Данил Андреевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.15, 2023 года.
Бесплатный доступ
Целью данной работы является изучение кинетики цементации кадмия порошком цинка в водных средах в непрерывном режиме с использованием ионоселективного кадмиевого электрода. Восстановление кадмия из водных растворов проводили порошком цинка, крупностью от 63 до 200 мкм. В ряде опытов проверяли влияние на процесс цементации кадмия катионоактивного флокулянта Besfloc K6645. Процесс проводили в области температур от 30 до 50 °С при непрерывном перемешивании со скоростью 200 об/мин верхнеприводной мешалкой. Кинетические кривые записывались с использованием кадмий-селективного электрода. Кинетические кривые условно разбивались на линейные участки. К каждому участку были проведены касательные, что позволило определять кажущиеся константы скорости по уравнению первого порядка и коэффициенты режима по уравнению Ерофеева - Колмогорова. Повышение температуры оказывает положительное влияние на цементацию. Введение в электролит флокулянта в количестве 70 мг/л снижало степень цементации от двух до трех раз за период времени 600 с. Полученные данные позволили рассчитать энергии активации скоростей процесса на линейных участках кинетических кривых, которые составили ориентировочно 46, 32 и 11-13 кДж/моль на первом, втором и третьем участке соответственно при проведении восстановления без добавки флокулянта и 117-130 и 82-85 кДж/моль в присутствии флокулянта Besfloc K6645. Показано, что в присутствии флокулянта происходит возрастание энергии активации, особенно на первом участке, характеризующемся замедленной скоростью цементации. В работе отмечено влияние добавки Besfloc K6645 на продолжительность начального участка кинетических кривых цементации.
Цементация кадмия, цинк, скорость реакции, константа, механизм процесса, кажущиеся энергии активации
Короткий адрес: https://sciup.org/147240921
IDR: 147240921 | УДК: 544.4+669.536.23 | DOI: 10.14529/chem230210
Текст научной статьи Исследование кинетики цементации кадмия в присутствии ПАВ
Цементационная очистка растворов находит свое применение как в гидрометаллургии, так и в гальванотехнике. Использование очищенных растворов обусловливает увеличение производительности оборудования, снижение расхода электроэнергии при последующем электролизе цинка и в конечном счете уменьшение себестоимости его производства.
Кроме промышленных предприятий, цементационная очистка может быть использована на очистных сооружениях, для очистки сточных вод от тяжелых металлов, таких как медь, кадмий, никель, кобальт. В отличие от других известных методов очистки сточных вод, цементационная очистка растворов имеет ряд преимуществ, это экономичность, эффективность очистки, выделение металлов в относительно чистом виде, простые требования к контролю, низкое энергопотребление [1, 2]. Влияние температуры на кинетику цементации изучено в большом перечне работ. В большинстве случаев, как показывает практика, повышение температуры увеличивает скорость процесса цементации. Например, в работе [3] на цементацию меди цинком из раствора цианида меди температура оказывает положительное влияние, увеличивая скорость выхода продукта. Аналогичные закономерности наблюдаются в работах [4–9]. Изменяя температуру раствора, в котором проходит реакция, можно определить характеристики процесса, а именно, оценив кажущуюся энергию активации, можно сделать предположение о том, диффузионная или химическая поляризация лимитирует процесс [10].
Для расчета энергии активации применяют уравнение Аррениуса, что позволяет уточнить механизм реакции [10]. Энергия активации химически контролируемых реакций > 40 кДж/моль; в то время как реакции, контролируемые диффузией, имеют энергию активации около 10 кДж/моль или меньше [11, 12]. Часто в работах по изучению кинетики цементационных сис- тем можно встретить зависимости процентного выхода продукта и скорости реакции от расхода металла-цементатора [13, 14]. Помимо площади цементирующего металла следует учитывать возможность образования на его поверхности оксидных пленок. Для устранения негативного эффекта следует активировать поверхность металла-осадителя, удалив пленку как механическим (ультразвуковое воздействие, абразивное истирание), так и химическим методом (обработка поверхности кислотами при pH раствора от 1 до 3) [15].
Во всех цементационных системах pH раствора оказывает воздействие на кинетику процесса. В многочисленных работах [16–18] изучается влияние pH на самые разные системы. В большинстве публикаций приходят к выводу о том, что слабокислая среда благоприятно влияет на кинетику процесса, а щелочная или сильнокислая приводит к побочным реакциям, замедляющим ход процесса. Например, в работе [18] показано, что поддержание pH > 6 в растворах приводит к образованию основных солей цинка (металла-цементатора), которые образуют пассивирующий слой на частицах цинка. В работе [6] проводили исследования, изменяя pH в диапазоне от 1 до 4,5. При этом показали, что pH 3 и 4 в данном случае оказались наиболее удачными, так как в этих областях не происходит образования побочных продуктов. Определить наиболее подходящий pH для процесса цементации можно только экспериментально. Так, кислая среда приводит к замедлению реакции из-за выделения водорода, который начинает блокировать поверхность металла-цементатора, а в нейтральной среде процесс сопровождается образованием нерастворимых твердых продуктов – гидрооксосульфатов цинка ZnSO 4 ∙3Zn(OH) 2 ∙4H 2 O, затрудняющих диффузионный обмен на границе раздела фаз.
Взаимодействие ионов кадмия с металлическим цинком протекает самопроизвольно, поскольку стандартные окислительно-восстановительные потенциалы для редокс-пар Zn2+/Zn0 и Cd2+/Cd0 равны –0,763 В и –0,402 В [19]. Несмотря на то, что удаление ионов кадмия цинковым порошком характеризуется большой константой равновесия [19] на практике равновесие достигается редко. Поэтому цементация будет описываться скоростью реакции, а не конечными условиями равновесия [2, 11, 19]. В ряде работ [7, 11, 19–24] сообщается, что цементация подчиняется кинетике первого порядка. Кинетическое уравнение первого порядка в интегральном виде имеет следующий вид:
ln c ° = k"VT = к каж "Т, (1)
где τ – время, с; k – константа скорости, м · с–1; S – площадь поверхности цинка, м2; V – объем раствора, м3; С 0 – начальная концентрация; С τ – концентрация в текущий момент времени; k каж – кажущаяся константа скорости, с–1.
Однако следует учитывать, что электрохимическая реакция протекает на поверхности цинка, поэтому использование кинетического уравнения для гомогенных реакций первого порядка с теоретической точки зрения не является обоснованным. Незначительное количество трудов [25], посвященных цементации основаны на моделях гетерогенной кинетики, например, уравнении Ерофеева – Колмогорова:
a = 1 -e kt , (2)
« = ^ , (3)
(-0
где С о – начальная концентрация кадмия, М; С t – концентрация кадмия в текущий момент времени, М; n – коэффициент режима реакции, степень отклонения кинетики процесса от диффузионной; к - постоянная; a - степень цементации.
Величина n отражает характер развития реакционной зоны. Когда n > 1, исследуемый процесс находится в кинетической области. При n < 1 процесс находится в диффузионной области. Константа скорости k может быть рассчитана по уравнению [26]:
к = п(к' ^п . (4)
Органические вещества присутствуют в растворах гидрометаллургического производства, поступая туда случайным образом или из материалов и веществ, использующихся в заводской технологии [27], что не может не оказывать влияние на кинетику цементации кадмия. Известно, что положительно заряженные флокулянты, например Besfloc K6645, снижают как плотность катодного тока при электролизе цинка и меди, так и скорость их восстановления в процессе цементации цинковой пылью [28–29]. Катионные реагенты марки Besfloc являются сополимерами акриламида с частицами катионных мономеров. Внесенные ими в полимер катионные группы имеют в водном растворе положительные заряды. Состав: поли[акриламид-диметиламиноэтил-акрилат метилхлорид] – 92 %, вода – 8 %. Их получают полимеризацией солей четвертиной аммонийной или третичной аминовой основы диметиламиноэтилметакрилата (акрилата) или их сополимеризацией с акриламидом [30].
Целью данной работы является изучение кинетики цементации кадмия порошком цинка в водных средах в непрерывном режиме с использованием ионоселективного кадмиевого электрода. Исследования проведены с добавкой и без добавки ПАВ – катионоактивного флокулянта Besfloc К6645.
Экспериментальная часть
В качестве цементирующего агента использовали порошок цинка, крупностью от 63 до 200 мкм. Стандартный раствор 0,2 М сульфата кадмия готовили путем растворения в дистиллированной воде навески 3 CdSO 4 ∙ 8 H 2 O. Для каждого эксперимента разбавляли стандартный раствор до концентрации ионов Cd2+ 0,01 М, pH раствора доводили до 4,0. Выбор концентрации ионов кадмия в модельном растворе обусловлен содержанием кадмия в промышленных растворах гидрометаллургических предприятий [27]. Для поддержания рН использовали раствор, приготовленный путем 100-кратного разбавления концентрированной серной кислоты (ρ = 1,83 г/мл). Добавка Besfloc K6645 составляла 7,5–200 мг/л.
Исследование проводили в химическом стакане, содержащем 200 мл модельного раствора, установленным в водяной бане UT-4302E. В раствор погружали индикаторный кадмий-селективный электрод «ЭЛИТ-241» и верхнеприводную мешалку LABTEX OS-20 LT. Скорость перемешивания составляла 200 об/мин. Точную навеску порошка цинка засыпали таким образом, чтобы распределить её по поверхности раствора. Запись кинетической кривой производилась на персональный компьютер в течение 60 мин с интервалом 10 секунд. Электродная функция кад-мий-селективного электрода зависит от pH исследуемого раствора [31], поэтому рН раствора во время проведения всего опыта поддерживался в диапазоне 3,9–4,1 добавлением раствора серной кислоты. Цементацию производили в течение 60 мин либо до достижения pCd ≥ 4. Процесс повторяли трижды.
Результаты и их обсуждение
Чтобы изучить кинетику и механизм реакции цементации, провели эксперименты при разных температурах с использованием экспериментальной установки, описанной ранее. В этом разделе проводили цементацию кадмия в отсутствии катионного полиэлектролита. На рис. 1а приведена типичная кинетическая кривая, по оси ординат отложена степень цементации, рассчитанная по формуле (3), а по оси абсцисс – время проведения процесса в секундах (с). На кинетической кривой, построенной в координатном пространстве ln(C 0 /C) – τ, можно выделить три участка (рис. 1б). Первый участок соответствует минимальной скорости процесса, после которого скорость процесса резко возрастает (второй участок), и по мере достижения высоких степеней цементации реакция снова замедляется, что наблюдается на третьем участке.
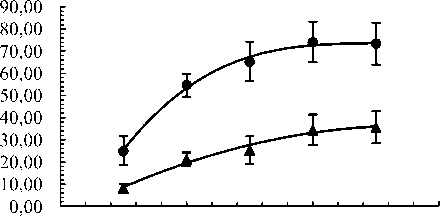
Увеличение температуры раствора с 30 до 50 °С позволяет сократить продолжительность начального участка в 2,85 раза (рис. 2). Похожие результаты были получены в работе, посвящённой изучению цементации меди алюминием [12]. Повышение температуры оказывает положительное влияние на цементацию. Так, рост температуры с 30 до 50 °С вызывает увеличение степени цементации кадмия с 25 до 73 % в первые 600 секунд протекания процесса (рис. 3).
Для изучения механизма цементации проводили опыты при 30, 35, 40, 45, 50 °С. Для расчетов по кинетике первого порядка были построены кинетические кривые в координатном пространстве ln (C0/C) – τ. Полученная зависимость нелинейная, что говорит об изменении механизма реакции во времени и отклонении порядка реакции от первого (рис. 1б). К каждому из трех участков были проведены касательные, что позволило определить кажущиеся константы скорости согласно уравнению (1). Результаты представлены в табл. 1.
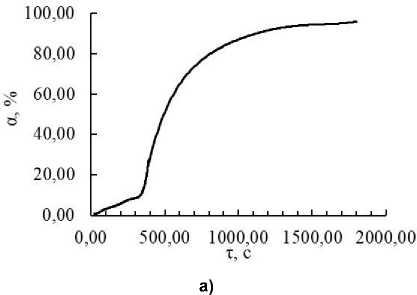
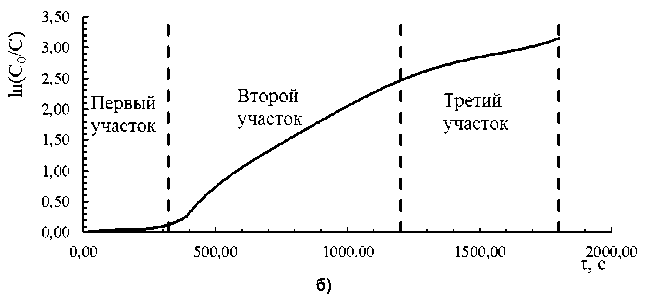
Рис. 1 . Кинетическая кривая цементации кадмия при 40 °С: а – построенная в координатном пространстве α – τ; б – построенная в координатном пространстве ln(C 0 /C) – τ. На кривой выделены три участка (пояснения в тексте)
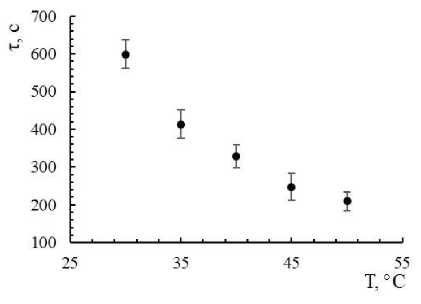
Рис. 2. Изменение продолжительности начального участка на кинетической кривой (τ, с) с возрастанием температуры процесса (Т, °С)
25 35 45 55
T ,°С
• С(Besfloc K6645)=0 мг/л A С(Besfloc K6645)=70 мг/л
Рис. 3. Зависимость степени цементации от температуры проведения процесса за период времени 600 с. α, % – степень цементации кадмия; Т, °C – температура
Таблица 1
Натуральные логарифмы констант скорости, рассчитанные по уравнению первого порядка
|
Добавка Besfloc K6645, мг/л |
0 |
70 |
|||
|
Участок T, °С |
Первый |
Второй |
Третий |
Первый |
Второй |
|
30 |
–8,52 ± 0,16 |
–6,47 ± 0,44 |
–7,29 ± 0,39 |
–8,97 ± 0,07 |
–7,68 ± 0,31 |
|
35 |
–8,14 ± 0,65 |
–5,97 ± 0,32 |
–7,27 ± 0,34 |
–8,15 ± 0,29 |
–7,25 ± 0,42 |
|
40 |
–7,75 ± 0,22 |
–5,75 ± 0,13 |
–7,14 ± 0,11 |
–7,34 ± 0,19 |
–6,73 ± 0,47 |
|
45 |
–7,52 ± 0,66 |
–5,47 ± 0,40 |
–7,05 ± 0,08 |
–6,56 ± 0,15 |
–6,14 ± 0,33 |
|
50 |
–7,41 ± 0,54 |
–5,30 ± 0,29 |
–6,99 ± 0,22 |
–5,81 ± 0,21 |
–5,71 ± 0,24 |
При анализе кинетических кривых с помощью уравнения Ерофеева – Колмогорова потребовалось построить кривые в координатном пространстве ln(-ln(1-α)) – ln τ. На полученных зависимостях снова можно выделить 3 участка (рис. 1б). По уравнению (2) после двойного логарифмирования были получены коэффициенты режима реакции k ʹ, соответствующие коэффициенту угла наклона. Коэффициенты режима позволяют предположить механизм цементации на исследуемом участке. Коэффициенты оказались равными 2,47 ± 0,14; 1,00 ± 0,07; 0,63 ± 0,08 для первого, второго и третьего участков соответственно. Таким образом, первый участок характеризуется кинетическими ограничениями, третий – диффузионными, а второй соответствует смешанной кинетике. Константы скорости были получены по уравнению (4), результаты приведены в табл. 2.
Таблица 2
Натуральные логарифмы констант скорости, рассчитанные по уравнению Ерофеева – Колмогорова
|
Добавка Besfloc К6645, мг/л |
0 |
70 |
|||
|
Участок T, °С |
Первый |
Второй |
Третий |
Первый |
Второй |
|
30 |
–6,29 ± 0,13 |
–6,47 ± 0,08 |
–6,29 ± 0,15 |
–7,56 ± 0,62 |
–8,02 ± 0,22 |
|
35 |
–5,87 ± 0,15 |
–6,15 ± 0,22 |
–6,23 ± 0,34 |
–6,99 ± 0,27 |
–7,66 ± 0,18 |
|
40 |
–5,67 ± 0,18 |
–6,14 ± 0,07 |
–6,15 ± 0,12 |
–6,32 ± 0,44 |
–7,11 ± 0,11 |
|
45 |
–5,36 ± 0,16 |
–5,86 ± 0,29 |
–6,06 ± 0,17 |
–5,67 ± 0,43 |
–6,50 ± 0,11 |
|
50 |
–5,13 ± 0,14 |
–5,65 ± 0,38 |
–6,04 ± 0,18 |
–4,65 ± 0,32 |
–5,98 ± 0,10 |
При расчетах энергий активаций использовали уравнение Аррениуса (1), по коэффициентам угла наклона получены следующие значения кажущихся энергий активаций (табл. 3). Рассчитанные данные также подтверждают, что скорость в начальный момент времени ограничивается химической реакцией, а на конечной стадии лимитируется диффузионными процессами. Диффузионные ограничения вызваны затруднением транспорта ионов Cd2+ через слой кадмия, покрывающего металлический цинк. В среднем конечная стадия наступает через 2500, 2150, 1400, 1200 и 950 с при проведении цементации при 30, 35, 40, 45, 50 °С соответственно. Нами была выдвинута гипотеза, что замедление скорости на участке 1 связано с кинетическими ограничениями окисления кадмия на цинке из-за оксидной пленки на поверхности цинка.
Таблица 3
Кажущаяся энергия активации процесса цементации
|
Участок кривой |
Ea, кДж/моль |
|||
|
Без добавки |
В присутствии Besfloc K6645 (70 мг/л) |
|||
|
По кинетическому уравнению реакции первого порядка |
По уравнению Ерофеева– Колмогорова |
По кинетическому уравнению реакции первого порядка |
По уравнению Ерофеева– Колмогорова |
|
|
Первый |
46 ± 5 |
46 ± 5 |
129 ± 8 |
116 ± 9 |
|
Второй |
32 ± 3 |
32 ± 1 |
82 ± 3 |
85 ± 5 |
|
Третий |
13 ± 2 |
11 ± 1 |
||
Таким образом, на участке 1 наблюдаются кинетические ограничения восстановления кадмия, что видно по высокому значению энергии активации. После растворения оксидной пленки наблюдается возрастание скорости (участок 2). Однако по мере увеличения степени цементации порошок цинка частично покрывается кадмием. По мере увеличения блокирования кадмием поверхности цинка процесс переходит в смешанный режим. Дальнейшее увеличение осаждения кадмия на цинке затрудняется из-за замедления скорости транспортировки катионов кадмия к восстановителю. Это приводит к изменению механизма цементации, и процесс переходит в диффузионный режим (участок 3).
Для изучения влияния присутствия Besfloc K6645 на механизм цементации кадмия получена кинетическая кривая (рис. 4). Введение добавки флокулянта несколько изменило форму кинетической кривой, построенной в координатном пространстве ln (C0/C) – τ. Наблюдаемая зависимость уже не имеет третьего участка в рассмотренный период времени в сравнении с данными, полученными без добавки флокулянта. Поэтому при дальнейшей обработке кинетических кривых рассматривали только два участка.
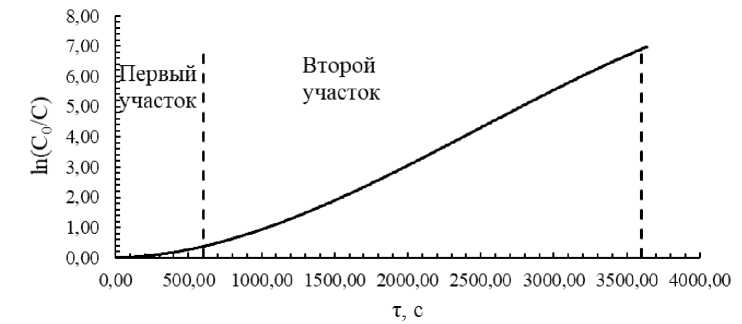
Рис. 4. Кинетическая кривая цементации кадмия при 40 °С в присутствии Besfloc K6645 (70 мг/л)
Степень цементации за период времени 600 с в присутствии в растворе флокулянта Besfloc K6645 примерно в 3 раза меньше по сравнению со степенями цементации в растворах без добавки, что согласуется с теорией электрохимических процессов и с нашими работами [26–28]. При этом показано, что с повышением температуры процесса возрастает степень цементации кадмия как в отсутствии добавки флокулянта, так и в его присутствии (см. рис. 3.)
Сравнивая полученные значения, можно прийти к выводу, что введение добавки флокулянта увеличивает энергию активации цементации на каждом участке примерно в 2,5 раза. Разряд катионов кадмия на цинке проходит с повышенным сопротивлением из-за блокирования поверхности цинка высокомолекулярным соединением, что приводит к возрастанию энергии активации.
Заключение
В работе проведены исследования цементации кадмия цинковой пылью с автоматической записью кинетической кривой на компьютер с использованием кадмий-селективного электрода. Для расчетов по кинетике первого порядка были построены кинетические кривые в координатном пространстве ln (C0/C) – τ. Полученная зависимость была нелинейной, что говорило об изменении механизма реакции во времени и отклонении порядка реакции от первого. Кинетические кривые условно разбивались на линейные участки. К каждому участку были проведены касательные, что позволило определять кажущиеся константы скорости по уравнению первого порядка и коэффициенты режима по уравнению Ерофеева – Колмогорова. Полученные данные позволили рассчитать энергии активации скоростей процесса на линейных участках кинетических кривых, которые составили ориентировочно 46, 32, 11–13 кДж/моль на первом, втором и третьем участке соответственно при проведении восстановления без добавки флокулянта и 117–130 и 82–85 кДж/моль в присутствии флокулянта Besfloc K6645. Показано, что введение в раствор добавки флокулянта увеличивает энергию активации цементации на каждом участке примерно в 2,5 раза. Отмечено, что на этом участке процесс лимитирует электрохимическая стадия разряда катионов кадмия на неактивированной поверхности цинковой пыли. Разряд катионов кадмия на цинке проходит с повышенным сопротивлением из-за блокирования поверхности цинка высокомолекулярным соединением, что приводит к заметному возрастанию энергии активации.
Список литературы Исследование кинетики цементации кадмия в присутствии ПАВ
- Колесников А.В., Казанбаев Л.А., Козлов П.А. Влияние органических веществ на процессы цементации и электролиза цинка // Цвет. мет. 2006. № 8. С. 24-28.
- Ku Y., Wu M.H., Shen Y.S. A study on the cadmium removal from aqueous solutions by zinc cementation // Sep. Sci. Technol. 2002. Vol. 37, no. 3. P. 571-590. DOI: 10.1081/SS-120001448.
- Nassef E. Removal of copper from wastewater by cementation from simulated leach liquors // J. Chem. Eng. Process Technol. 2015. Vol. 6, no. 1. P. 1-6. DOI: 10.4172/2157-7048.1000214.
- Колмачихина Э.Б. Изучение влияния лигносульфоната натрия, анионных поверхностно-активных веществ и их смесей на показатели цементации ионов меди цинком // Изв. высш. учебн. завед. Цвет. металл. 2020. № 4. С. 29-35. DOI: 10.17073/0021-3438-2020-4-29-35
- Исследование извлечения меди в барабанном цементаторе / Б.Д. Халезов, Н.А. Ватолин, Ю.Н. Макурин, Н.А. Быков // ГИАБ. 2005. № 5. С. 302-311.
- Demirkiran N. A kinetic study of copper cementation with zinc in aqueous solutions // Int. J. Miner. Process. 2007. V. 82, № 2. P. 80-85. DOI: 10.1016/j.minpro.2006.10.005
- Nosier S.A. Removal of cadmium ions from industrial wastewater by cementation // Chem. Bio-chem. Eng. Q. 2003. V. 17, № 3. P. 219-224.
- Karavasteva M. Effect of certain surfactants on co cementation using zinc dust in the presence of both Cu and Sb // Can. Metall. Q. 2005. V. 44, № 4. P. 457-462. DOI: 10.1179/cmq.2005.44.4.457
- Ahmed I.M., El-Nadi Y.A., Daoud J.A. Cementation of copper from spent copper-pickle sulfate solution by zinc ash // Hydrometallurgy. 2011. V. 110, № 4. P. 62-66. DOI: 10.1016/ j.hydromet.2011.08.007
- Farahmand F. Optimization and kinetics of the cementation of lead with aluminum powder // Hydrometallurgy. 2009. V. 98, № 2. P. 81-85. DOI: 10.1016/j.hydromet.2009.04.001
- Younesi S.R., Alimadadi H., Keshavarz E., Marashi S.P.H. Kinetic mechanisms of cementation of cadmium ions by zinc powder from sulphate solutions // Hydrometallurgy. 2006. Vol. 84. № 3-4. P. 155-164. DOI: 10.1016/j.hydromet.2006.05.005
- Asadrokht M., Zakeri A. Effect of concurrent ball milling on cementation reactions: the case of Cu-Al system // Miner. Eng. 2018. Vol. 125. P. 15-25. DOI: 10.1016/j.mineng.2018.05.024
- Krause B., Sandenbergh R.F. Optimization of cobalt removal from an aqueous sulfate zinc leach solution for zinc electrowinning // Hydrometallurgy. 2015. V. 155. P. 132-140. DOI: 10.1016/j .hydromet.2015.05.001
- Raghavan R., Mohanan P.K., Verma S.K. Modified zinc sulphate solution purification technique to obtain low levels of cobalt for the zinc electrowinning process // Hydrometallurgy. 1999. V. 51, № 2. P. 187-206. DOI: 10.1016/S0304-386X(98)00076-0
- Алкацев М.И. Процессы цементации в цветной металлургии. М.: Металлургия, 1981. 116 с.
- Lew R.W. The removal of cobalt from zinc sulphate electrolytes using the copper-antimony process: dis. Vancouver, 1994. 99 p.
- Gutknecht T., Colombus Y., Steenari B.M. Recycling zinc from metal oxide varistors through leaching and cementation of cobalt and nickel // J. Sustain. Metall. 2017. V. 3, № 2. P. 239-250. DOI: 10.1007/s40831-016-0072-6
- Nelson A., Wang W., Demopoulos G.P., Houlachi G. The removal of cobalt from zinc electrolyte by cementation: a critical review // Miner. Process. Extr. Metall. Rev. 2000. V. 20, № 1. P. 325356. DOI: 10.1080/08827509908962481
- Vanysek P. CRC Handbook of chemistry and physics. Chemical Rubber Company Press, USA, 2012.
- Sousa S., De Carvalho J.R., Correia M.J.N. Cadmium removal from industrial effluents by cementation with zinc powder // Int. J. Environ. Waste Manage. 2012. Vol. 9, № 3-4. P. 284-292. DOI 10.1504/IJEWM.2012.046393.
- Karavasteva M. The effect of certain eurfactants on the cementation of cadmium by suspended zinc particles // Hydrometallurgy. 1997. Vol. 47, № 1. P. 91-98. DOI: 10.1016/S0304-386X(97)00037-6
- Kinetics of copper and cadmium cementation by zinc powder / V. Oliveira, J. Penna, L. Magalhaes et al. // Tecnol. Metal. Mater. e Miner. 2019. Vol. 16, № 2. P. 255-262. DOI: 10.4322/2176-1523.20191661
- Taha A.A., Abd El-Ghani S.A.H. Effect of surfactants on the cementation of cadmium // J. Colloid Interface Sci. 2004. Vol. 280, № 1. P. 9-17. DOI: 10.1016/j.jcis.2004.07.023
- Review on cadmium removal from aqueous solutions / K.S. Rao, M. Mohapatra, S. Anand, P. Venkateswarlu // Int. j. eng. sci. technol. 2010. Vol. 2, № 7. DOI: 10.4314/ijest.v2i7.63747
- Исследование электроцементационной очистки растворов, полученных при атмосферном выщелачивании низкокачественных цинковых концентратов / С.В. Мамячиков, О.С. Анисимова, Н А. Куленова, Ж.С. Оналбаева // J.S. 2019. T. 65, № 7. С. 11.
- Новый справочник химика и технолога. Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия. СПб.: АНО НПО «Профессионал», 2004. 838 с.
- Колесников А.В., Працкова С.Е. Теория и практика очистки растворов цинковой пылью в гидрометаллургии. Экспериментальные и теоретические данные. Palmarium Academic Publishing. 2017. 130 с.
- Колесников А.В. Исследование причин эффективного использования лигносульфоната в электролизе цинка // Бутлеровские сообщения. 2014. Т. 40. № 12. С. 110.
- Колесников А.В., Цыганова И.В. Электролиз сульфатных цинковых растворов. Экспериментальные и теоретические данные. Palmarium Academic Publishing, 2018. 115 с.
- Тормоз В.В., Майборода Ю.В., Назимко Е.И. Исследование процесса осветления воды, содержащей угольный шлам, с использованием флокулянтов марки Besfloc // Вют Донецького прничого шституту. 2013. № 2 (2). С. 41-45.
- Справочное руководство по применению ионоселективных электродов: пер. с англ. Мир, 1986. 231 с.


