Исследование неферментативного взаимодействия селена и серебра с цистеином и глутатионом с помощью приборного комплекса МХ-5310
Автор: Новиков А.В., Кошелева Г.Н., Бубляев Р.А., Манойлов А.В., Козьмин Ю.П., Краснов Н.В., Миргородская О.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии. Интерпретация данных, методология, применение
Статья в выпуске: 4 т.18, 2008 года.
Бесплатный доступ
С помощью разработанного в Институте аналитического приборостроения РАН приборного комплекса, включающего времяпролетный масс-спектрометр с электрораспылением МХ-5310 и жидкостной хроматограф Милихром А-02, было проведено исследование взаимодействия селена (Se) с элементами биологических систем на примере цистеина (Cys) и глутатиона (GSH). Выявлено образование двух типов продуктов - дисульфидов и Se-дисульфидов и определены условия, позволяющие изменять соотношения концентраций между этими типами продуктов при взаимодействии Se c GSH. Проведено сравнение процессов взаимодействия Se с GSH, Cys, и смеси GSH с Cys, которое выявило конкуренцию за Se у таких сульфгидрильных соединений. Определено также, что в конкурентных условиях не происходит образование Se-дисульфида Cys, но в значительной степени образуется смешанный дисульфид без Se и с Se. Показано, что образование смешанного Se-дисульфида может протекать через замещение GSH на Cys в симметричном Se-дисульфиде GSH. Можно полагать, что именно селективность замещения лежит в основе регуляции физиологических процессов с участием Se и различных тиолов в биологических средах.
Короткий адрес: https://sciup.org/14264577
IDR: 14264577 | УДК: [577.1:
Текст научной статьи Исследование неферментативного взаимодействия селена и серебра с цистеином и глутатионом с помощью приборного комплекса МХ-5310
ВВЕДЕНИЕ сутствующего в сопоставимых с GSH количествах
Антиоксидантная роль селена (Se) впервые была выявлена английским биохимиком А. Диплоком в 1970 г. [1]. В основе этого процесса лежит взаимодействие Se с глутатионом (GSH) [2].
GSH присутствует в клетке в восстановленном состоянии (SH) в концентрации около 5 мМ. Фактически такая высокая концентрация GSH в клетке приводит к тому, что он может восстанавливать любую дисульфидную связь (S–S), образующуюся между цистеинами цитозольных белков. При этом восстановленная форма GSH превращается в окисленную форму GSH — дисульфид глутатиона (GSSG). GSSG может быть восстановлен под действием фермента глутатионредуктазы, который постоянно находится в клетке в активном состоянии и индуцируется при оксидативном стрессе [1]. Важную роль в этих процессах выполняет Se, участвуя главным образом в функционировании Se-зависимых глутатионпероксидаз. Было показано, что процесс окисления GSH в безфер-ментативной среде ускоряется в присутствии Se (обычно в виде SeO 2 ). При этом зарегистрировано образование двух типов продуктов — окисленной формы GSH (GS-SG) и Se-дисульфида глутатиона (GS-Se-SG) [2]. Представляло интерес в рамках настоящей работы изучить особенности этого неферментативного взаимодействия Se с GSH, а также влияние на этот процесс другого сульфгидрильного соединения — цистеина (Cys), при-
во многих биологических средах [1–2].
В связи с тем что постулируется участие GSH в дезинтоксикации тяжелых металлов [3], представлялось целесообразным проверить возможное конкурентное участие в этом процессе Se на примере изучения воздействия на этот процесс ионов серебра, относящегося также к классу тяжелых металлов.
Для изучения особенностей неферментативного взаимодействия GSH и Cys с Se (в виде SeO 2 ) и в том числе в присутствии ионов серебра использовались два инструментальных метода: масс-спектрометрия с электрораспылением (ESI-o-TOF-MS) — для качественной и высокоэффективная жидкостная хроматография (ВЭЖХ) — для количественной оценок.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Независимое взаимодействие SeIV с GSH и SeIV с Cys
Для исследования взаимодействия SeIV с GSH и SeIV с Cys использовались смеси этих соединений в различных концентрациях. На рис. 1 представлены масс-спектры реакционных смесей, полученных при взаимодействии SeIV с GSH (а) и SeIV с Cys (б) в молярном соотношении 1:1 в водной среде.
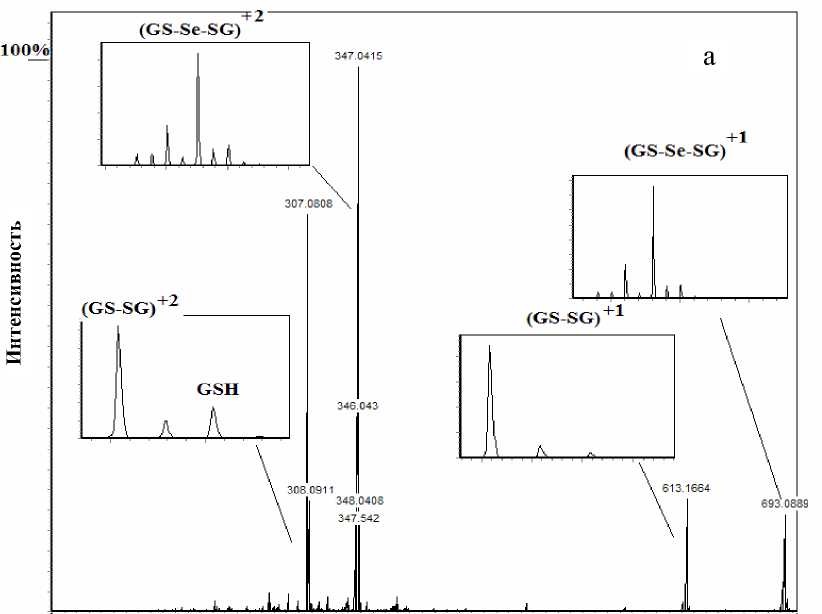
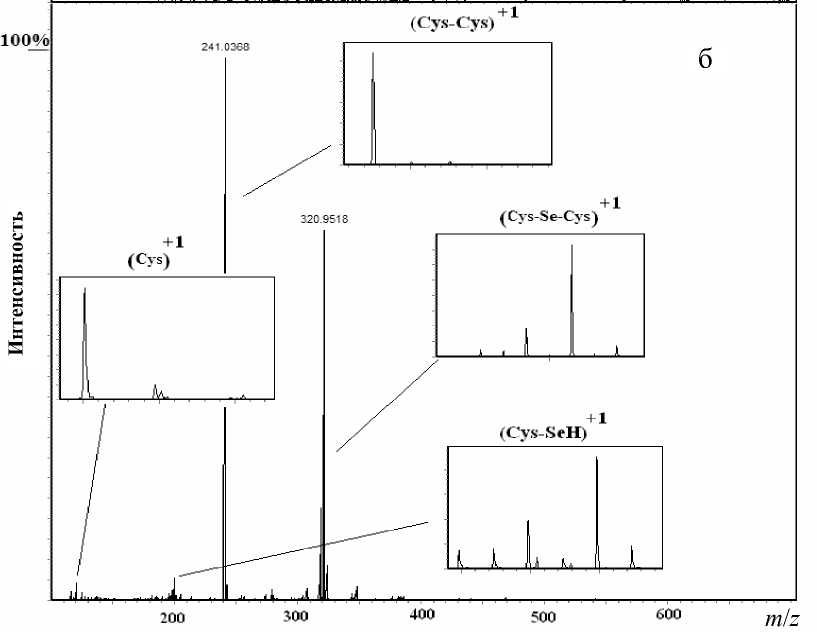
Рис. 1. ESI-масс-спектры реакционных смесей, полученных при взаимодействии SeIV с GSH (а) и SeIV с Cys (б)
Из рис. 1 следует, что в реакционных смесях образовались продукты окисления, а именно дисульфид глутатиона (GS-SG), представленный в масс-спектре двухзарядным ионом с m / z = 307.08 и однозарядным ионом с m / z = 613.16 (рис. 1, а), и дисульфид Cys (Cys-Cys) в виде только однозарядного иона с m / z = 241.04 (рис. 1, б).
Кроме того, наблюдается образование Se-содержащих продуктов для GSH (GS-Se-SG), представленных в масс-спектре двухзарядным ионом с m / z = 307.3 и однозарядным ионом с m / z = 693.16 (рис. 1, а), а для Cys-содержащих продуктов — Se-дисульфида (Cys-Se-Cys) (рис. 1, б). Все Se-содержащие продукты имеют изотопное распределение, характерное для Se.
В настоящей работе проведен количественный анализ образующихся продуктов в смеси SeIV с GSH с помощью ВЭЖХ. Результаты обработки полученных данных при различных количествах SeIV и GSH в водной среде представлены в табл. 1. Там же представлены данные по спонтанному окислению GSH без SeIV. Концентрации всех продуктов выражены в процентах, рассчитанных из площадей соответствующих хроматографических пиков, что отражает распределение в них глутатиона.
Из табл. 1 видно, что уже через 5 мин наблюдается значительная убыль GSH и появление продуктов окисления, основным из которых при соотношениях с Se и GSH 1:1 и 1:2 является GS-Se-SG. Отметим, что контрольный эксперимент показал, что в тех же условиях, но без Se окисление GSH не наблюдается по крайней мере в течение часа. Отметим, что доминирование образования GS-Se-SG, возникающее на первых 5 минутах, сохраняется в течение длительного времени (~20 ч).
Как показывают результаты представленные в табл. 2, в присутствии бикарбоната аммония (рН 7.4) ускоряется как реакция GSH с Se, так и скорость спонтанного окисления. В 1 %-й уксусной кислоте скорость взаимодействия с Se замедляется. При этом как в водной среде, так и в присутствии уксусной кислоты, спонтанное окисление GSH в отсутствие Se не наблюдается. Из анализа полученных результатов может быть сделан вывод о том, что увеличение в продуктах реакции доли окисленной формы (GS-SG) при переходе от кислой к щелочной среде связано с изменением концентрации непротонированных сульфгидрильных групп GSH, необходимых для образования этой формы, в то время как образование GS-Se-SG не зависит от рН. В конечном итоге это приводит к перераспределению конечных продуктов реакции и значительному изменению соотношения GS-SG и GS-Se-SG.
Табл. 1. Количественные характеристики реакционных смесей и продуктов реакции
|
№ п/п |
Исходные реагенты |
Время реакции, мин |
Состав продуктов, содержащих глутатион, % |
|||
|
SeIV, мМ |
GSH, мМ |
GSH |
GS-SG |
GS-Se-SG |
||
|
1 |
0.33 |
0.33 |
5 |
9 |
27 |
64 |
|
2 |
0.165 |
0.33 |
5 |
31 |
21 |
48 |
|
3 |
0.165 |
0.33 |
60 |
5 |
25 |
70 |
|
4 |
0.165 |
0.33 |
1140 |
0 |
26 |
74 |
|
5 |
0 |
0.33 |
60 |
100 |
0 |
0 |
Табл. 2. Состав реакционной смеси окиси селена и глутатиона при соотношении 1: 1 в разных средах
|
№ п/п |
Реакционная среда |
Время реакции, мин |
Состав продуктов, содержащих глутатион, % |
||
|
GSH |
GS-SG |
GS-Se-SG |
|||
|
1 |
Вода |
5 |
9 |
27 |
64 |
|
2* |
— ” — |
60 |
100 |
0 |
0 |
|
3 |
20 мМ NH 4 HCO 3 |
5 |
0 |
69 |
31 |
|
4* |
20 мМ NH 4 HCO 3 |
5 |
96 |
4 |
0 |
|
5 |
1 % CH 3 COOH |
14 |
16 |
20 |
64 |
|
6 |
1 % CH 3 COOH |
90 |
0 |
21 |
79 |
|
7* |
1 % CH 3 COOH |
60 |
100 |
0 |
0 |
Примечание. * — контроль без селена.
Bit
1800 000
GS-Cys 427.24
а
1600 000
1400 000
1200 000
1000 000
800 000
600 000
400 000
200 000
50 000
Cys-Cys
241.11
+2 (GS-Se-SG) 347.16
GSH 308.19
GS-Se-Cys
50719 GS-Se-SG
GS-SG 693.33
613.38 I
100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
m / z
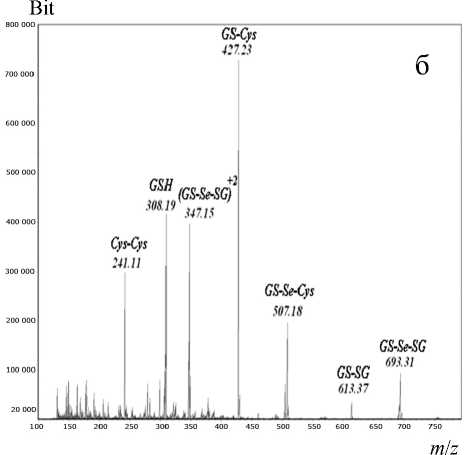
Рис. 3. ESI-масс-спектры реакционных смесей, полученных при взаимодействии SeIV с GSH и Cys при эквимолярном соотношении концентраций SeIV и сульфгидрильных соединений 1:1:1 (а) и при концентрации Se, в 2 раза уменьшенной — 1: 2 : 2 (б)
Конкурентное взаимодействие сульфгидрильных групп цистеина и глутатиона с селеном
Свободный цистеин, являющийся предшественником глутатиона, присутствует в биологических жидкостях одновременно с глутатионом. Оба соединения являются компонентами антиоксидантной защиты организма человека. Наличие в каждом из них свободной сульфгидрильной группы позволяет обоим соединениям конкурировать друг с другом при взаимодействии с селеном.
В настоящей работе были проведены масс-спектрометрические и хроматографические иссле- дования взаимодействия SeIV с GSH и Cys при различных концентрациях SeIV и сульфгидрильных соединений.
На рис. 3 представлены результаты масс-спектрометрической детекции смесей Cys и GSH с Se в различных концентрациях. Из рис. 3 видно, что в обоих случаях наиболее интенсивным из дисульфидов является ион с m/z 427.24, соответствующий смешанному дисульфиду SG-Cys. Кроме того, на масс-спектрах присутствуют ионы, соответствующие Cys-Cys и GS-SG. В обоих спектрах также регистрируется Se-дисульфиды GS-Se-SG и GS-Se-Cys в виде одно- и двухзарядных ионов и "следы" иона Se-дисульфид-цистеина (Cys-Se-Cys) даже в смеси с наибольшей концентрацией Se.
При хроматографии смесей SeIV с GSH и Cys (рис. 4) регистрируются только продукты, содержащие глутатион, поскольку как сам цистеин, так и его окисленная форма спектрофотометрически не детектируются. Наличие продуктов в хроматографических пиках, указаных на этих рисунках, подтверждено масс-спектрометрически. Отметим, что в пиках, подходящих для количественного анализа, не зарегистрирован продукт SG-Cys, однако его концентрация может быть рассчитана из баланса по GSH.
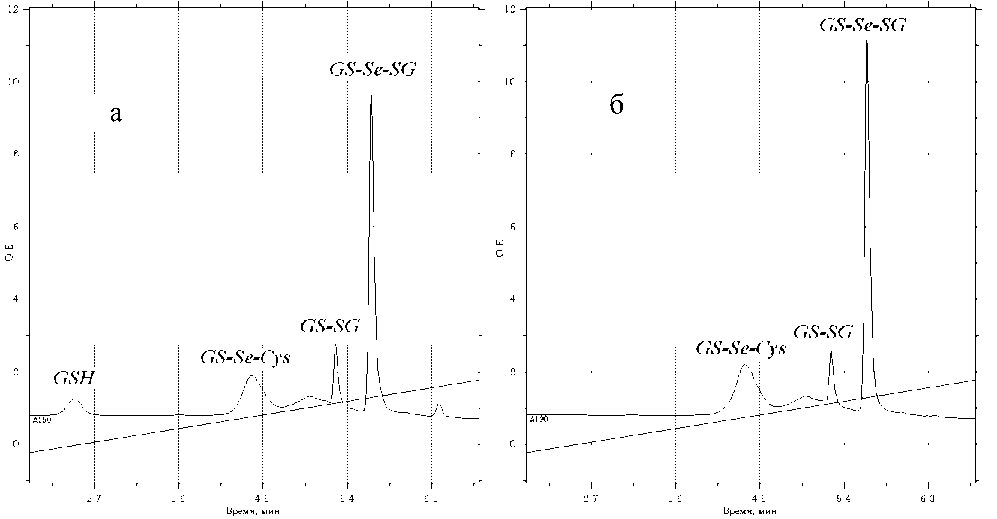
Рис. 4. Хроматограммы реакционных смесей, полученных при взаимодействии SeIV с GSH и Cys при эквимолярном соотношении концентраций SeIV и сульфгидрильных соединений 1:1:1 (а) и при концентрации Se, в 2 раза уменьшенной — 1: 2 : 2 (б)
Табл. 3. Распределение продуктов реакции Cys, GSH и Se в водных смесях при различных соотношениях реагентов
|
№ п/п |
Исходные реагенты, мM |
Состав продуктов, содержащих глутатион, % |
|||||
|
Se |
GSH |
Cys |
GSSG |
GS-Cys |
GSSeSG |
GS-Se-Cys |
|
|
1 |
3.33 |
3.33 |
3.33 |
2.0 |
14.3 |
37.9 |
45.8 |
|
2 |
1.66 |
3.33 |
3.33 |
2.5 |
31.4 |
31.8 |
34.3 |
|
3 |
0.83 |
3.33 |
3.33 |
32.0 |
28.5 |
16.4 |
23.1 |
|
4 |
0.33 |
3.33 |
3.33 |
5.1 |
68.6 |
16.6 |
9.8 |
С учетом вышеупомянутого из хроматографических данных было рассчитано содержание продуктов, содержащих GSH (табл. 3). Из представленных в таблице данных следует:
-
• содержание Se-дисульфидов с GSH (GS-Se-SG и GS-Se-Cys) сопоставимо между собой, но выше, чем соответствующих дисульфидов (GS-SG и GS-Cys);
-
• концентрация GS-Cys существенно превышает концентрацию GS-SG;
-
• соотношение концентраций обоих типов дисульфидов и Se-дисульфидов выравнивается при уменьшении концентрации в среде.
Для интерпретации полученного набора несимметричных продуктов, образующихся при одновременном взаимодействии с Se, были проведены специальные эксперименты для оценки возможности последующих превращений симметричных продуктов реакции с участием исходных сульфгидрильных соединений. Для этого первоначально была осуществлена реакция GSH c SeIV до полного превращения GSH в смесь окисленного глутатиона и его Se-дисульфида (рис. 5, а). Далее к реакционной среде, содержащей только продукты GS-SG и GS-Se-SG добавлялись в эквимолярных количествах либо GSH, либо Cys, либо их смесь в равных соотношениях. Хроматографический анализ полученных реакционных смесей после 2.5 ч инкубации представлен на рис. 5 (концентрации исходных реагентов и концентрации дополнительно вносимых в реакционную смесь сульфгидрильных соединений приведены в разделе "Материалы и методы").
Анализируя полученные результаты, представленные на рис. 5, можно отметить, что введение дополнительной порции GSH привело к дополнительному образованию GS-SG и GS-Se-SG (б), что указывает на достаточное количество SeO 2 в реакционной среде. Аналогичным образом продолжается реакция и при дополнительном введении смеси GSH и Cys (в). Однако при внесении одного Cys в реакционную среду в отсутствие GSH наблюдается исчезновение GS-Se-SG (10.1 мМ), и при этом образуется эквивалентное количество смешанного Se-дисульфида — GS-Se-Cys (9.5 мМ).
Таким образом, представленные выше эксперименты подтверждают наличие обменных процессов с участием Se-дисульфидов при наличии соединений со свободными сульфгидрильными группами со скоростями, сопоставимыми с образованием основных продуктов. При этом в процессе замещения
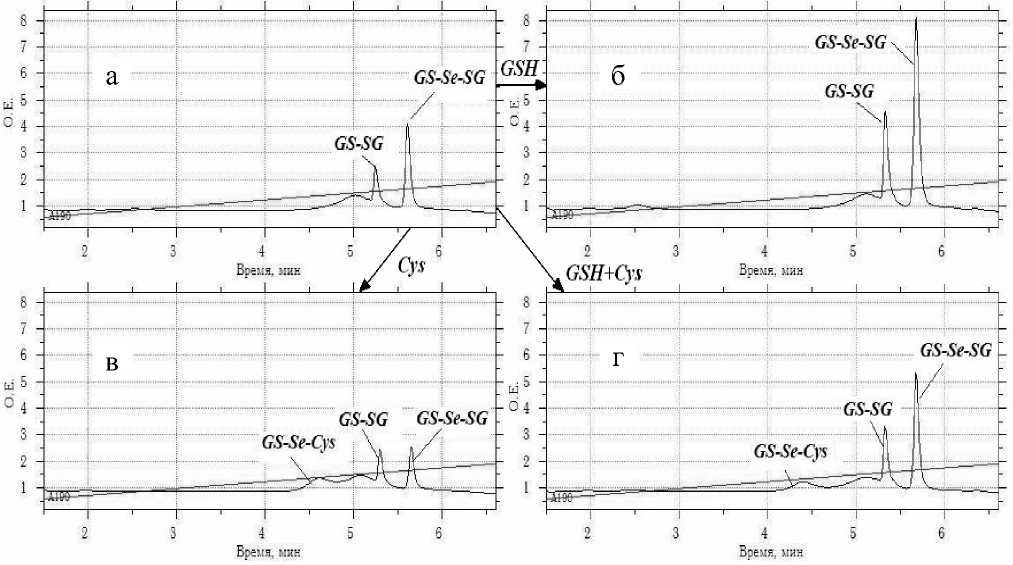
Рис. 5. Хроматограммы реакционных смесей до (а) и после дополнительного введения в реакционную среду GSH (б), Cys (в) и их смеси (г)
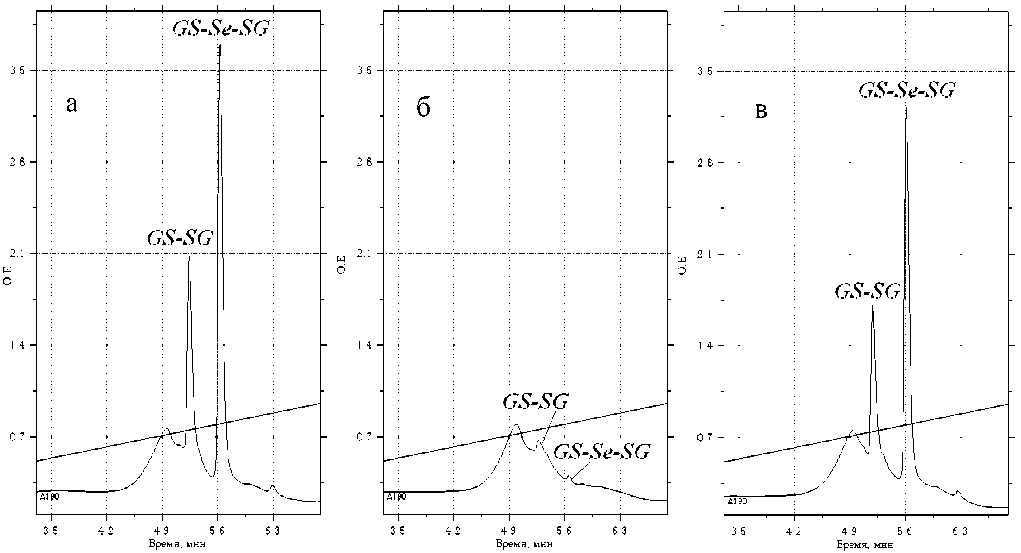
Рис. 6. Хроматограммы реакционных смесей при одновременном добавлении AgNO3 и Se к GSH (а) и при добавлении AgNO3 после взаимодействия GSH с Se
в симметричном Se-дисульфиде GS на Cys свободный GSH не регистрируется, поскольку он вступал бы в реакцию с SeO 2 с образованием тех же самых продуктов, которые имелись в реакционной среде до внесения Cys. В конечном итоге система через 2.5 ч приходит к некоторому равновесию, которое представлено набором продуктов, обозначенных на рис. 5, г.
Конкурентное взаимодействие сульфгидрильных групп глутатиона с селеном и ионами серебра
Как уже отмечалось выше, ряд биологически активных соединений и в том числе глутатион принимают активное участие в дезинтоксикациии, вызванной присутствием ионов тяжелых металлов. Такое действие может быть обусловлено взаимодействием с металлами сульфгидрильных групп GSH. Можно предположить, что и другие компоненты биологических сред, в том числе и селен, могут корректировать этот процесс. В связи с этим нами были проведены эксперименты по выяснению влияния ионов металлов на взаимодействие глутатиона с селеном на примере ионов серебра.
Эксперименты проводились следующим образом: в раствор со смесью селена и азотнокислого серебра добавлялся GSH. Далее реакционная смесь анализировалась с помощью ВЭЖХ по методике, описанной в предыдущем разделе. На рис. 6 представлены результаты хроматографии исследованных смесей; анализа хроматограмм — в табл. 4.
В экспериментах контролировалось образование двух продуктов: GS-SG и GS-Se-SG. Отметим, что ни хроматографически, ни масс-спектрометрически продукты GSH с ионами серебра не регистрируются, поскольку образование данного продукта приводит к потере растворимости GS-Ag.
Вместе с тем, как следует из результатов, представленных в табл. 4, при одновременном введении ионов серебра с продуктами реакции пропорционально уменьшается количество двух продуктов GS-SG и GS-Se-SG.
Введение ионов серебра после взаимодействия GSH с селеном не изменяет концентрации продуктов GS-SG и GS-Se-SG. Также было обнаружено, что ионы серебра не взаимодействуют с Se-дисульфидами.
ЗАКЛЮЧЕНИЕ
Таким образом, проделанные эксперименты свидетельствуют о том, что даже неферментативные реакции селена с глутатионом и цистеином представляют собой совокупность сложных процессов, приводящих к образованию набора продуктов, которые продолжают претерпевать изменения при изменении состава реакционной среды. Этим и обусловливается регуляция различных процессов, протекающих с участием GSH и Se
Табл. 4. Состав реакционных смесей после дополнительного введения азотнокислого серебра в концентрациях от 0 до 33 мM в реакционную среду, состоящую из 33 мM глутатиона и 33 мM селена
|
№ п/п |
AgNO3, мM |
GS-SG и GS-Se-SG |
GS-Ag, мМ |
|
|
мМ |
% |
|||
|
1 |
0 |
0.333 |
100 |
0 |
|
2 |
0.0165 |
0.32 |
96 |
0.013 |
|
3 |
0.0494 |
0.28 |
84 |
0.053 |
|
4 |
0.0825 |
0.25 |
76 |
0.083 |
|
5 |
0.165 |
0.08 |
23 |
0.253 |
|
6 |
0.333 |
0 |
0 |
0.333 |
|
7 |
0.333* |
0.333 |
100 |
0 |
Примечание. * — в течение 30 мин проведена прединкубация GSH c Se перед добавлением азотнокислого серебра.
в биологических средах, в которых активно участвует и ряд ферментов [4–6]. Отметим, что реальные биологические среды являются более многокомпонентными по набору соединений с сульфгидрильными группами. Они представлены как в белках и пептидах, так и в виде низкомолекулярных соединений, таких как гомоцистин, концентрация которого при ряде патологий существенно превосходит концентрацию GSH [7].
МАТЕРИАЛЫ И МЕТОДЫ
В работе были использованы вещества: глутатион восстановленный; глутатион окисленный; L-цистеин 99 % (Sigma); диоксид селена (ООО Вектон); муравьиная кислота (Merck); ацетонитрил (НПК Криохром).
Экспериментальные работы по разработке методики исследования влияния ионов тяжелых металлов и селена на биологические объекты проводились на приборе МХ-5310, оборудованном электрораспылительным источникам ионов (electrospray ionization, ESI) и времяпролетным масс-анализатором (TOF) с ортогональным вводом ионов, разработанным в Лаборатории биомедицинской масс-спектрометрии ИАнП РАН. Все спектры получены в режиме детектирования положительных ионов.
Хроматографию проводили на микроколоноч-ном жидкостном хроматографе Милихром А02 (Эконова, Новосибирск). Хроматографическая колонка размером 2 × 75 мм заполнена сорбентом Prontosil 120-5С18AQ (Bischoff, Германия). Элюцию осуществляли градиентом концентрации аце- тонитрила от 2 до 90 % (по объему) в растворе 0.25 % муравьиной кислоты со скоростью 100– 150 мкл/мин. При проведении анализа объем анализируемой пробы составлял 10 мкл, скорость подачи раствора образца — 2 мкл/мин. Площади пиков вычисляли, учитывая, что коэффициент молярной экстинкции глутатиона равен 1.5∙107.


