Исследование обоняния серых и гренландских тюленей с помощью метода оперантного обучения
Автор: Литвинов Юрий Владимирович, Пахомов Мирон Владимирович
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Морская зоология
Статья в выпуске: 2 т.21, 2018 года.
Бесплатный доступ
Представлены результаты исследования обоняния серых и гренландских тюленей в процессе выработки двигательного условного рефлекса на запах объекта; установлена способность подопытных тюленей дифференцировать различные запахи. Исследование включало три этапа, в ходе которых тюленей обучали дифференцировать: 1) контейнер с раствором камфоры от контейнера с дистиллированной водой; 2) контейнер с раствором диметилсульфида (ДМС) от контейнера с дистиллированной водой (на этих этапах определяли возможность выработки у исследуемых тюленей двигательного условного рефлекса на обонятельный раздражитель); 3) при парном предъявлении контейнер с раствором диметилсульфида от контейнера с раствором камфоры (выявляли способность тюленей различать запахи). Эксперимент проводили в условиях аквакомплекса ММБИ (в Кольском заливе); в качестве подопытных животных были выбраны две самки серого тюленя ( Halichoerus grypus, Fabricius, 1791) в возрасте семи лет и две самки гренландского тюленя ( Pagophilus groenlandicus, Erxleben, 1777) в возрасте двух лет. Для проведения экспериментов стимульные вещества разводили в дистиллированной воде до такой концентрации, чтобы интенсивность запаха была минимальна, затем раствор помещали в контейнер. Результаты работы продемонстрировали способности подопытных тюленей вырабатывать двигательный условный рефлекс на обонятельные раздражители и отличать один запах от другого. Скорость обучения серых и гренландских тюленей в процессе дифференцировки контейнера с запахом от пустого контейнера была сравнительно одинакова, а при дифференцировке двух запахов гренландские тюлени обучались на порядок медленнее серых тюленей. Данное отличие в скорости обучения, вероятно, связано с видовыми особенностями исследуемых тюленей и свидетельствует о более высокой пластичности нервной системы серых тюленей.
Серый тюлень, гренландский тюлень, обоняние, камфора, диметилсульфид
Короткий адрес: https://sciup.org/142215146
IDR: 142215146 | УДК: 57.045 | DOI: 10.21443/1560-9278-2018-21-2-336-343
Текст научной статьи Исследование обоняния серых и гренландских тюленей с помощью метода оперантного обучения
Морские млекопитающие долгое время рассматривались как аносматики или микросматики [1; 2]. У китообразных обоняние почти утрачено; обонятельные доли мозга и обонятельные нервы отсутствуют полностью (зубатые киты) или имеются в зачаточном состоянии (усатые киты) [3]; также в их геноме утрачены или находятся в неактивном состоянии гены, отвечающие за обоняние [4].
Наблюдения за поведением ластоногих в естественных условиях позволяют сделать вывод, что обоняние, возможно, играет важную роль в их социальной коммуникации, репродуктивном поведении [5] и выборе пищи [6].
Обонятельное поведение и назо-назальные контакты южноафриканских морских котиков (Arctocephalus pusillus, Schreber, 1775), содержащихся в неволе, были описаны G. J. Ross [7]. Самки гренландского тюленя (Pagophilus groenlandicus, Erxleben, 1777) определяли своих щенков визуально, вокально и с помощью обоняния, но окончательное подтверждение наблюдалось только после обнюхивания щенков [8]. Кормлению почти всегда предшествововал назо-назальный контакт [8; 9], в течение первых двух дней после рождения самки обнюхивали щенков значительно чаще, чем во время остального периода грудного вскармливания [8]. Самки северного морского котика (Callorhinus ursinus, Linnaeus, 1758) также часто обнюхивают щенков после рождения и во время периода лактации и используют назо-назальный контакт как средство идентификации своих щенков [10]. Этот же контакт как заключительное признание самкой своего щенка был описан у южноамериканских морских котиков (Arctocephalus australis, Zimmermann, 1783) [11], кергеленских морских котиков (Arctocephalus gazella, Peters, 1875) [12], австралийских морских львов (^eophoca cinerea, Peron, 1816) [13] и сивучей (Eumetopias jubatus, Schreber, 1776) [14].
Важную роль обоняние играет и в репродуктивном поведении морских млекопитающих. Самцы новозеландских морских котиков (Arctocephalus forsteri, Lesson, 1828) обнюхивали самок в области головы и задней части тела в период размножения, по-видимому оценивая готовность самок к спариванию [15]. Обонятельное поведение сивучей различалось как между животными разного пола и возраста, так и в разные периоды их жизни (репродуктивный и пострепродуктивный) [16]. У самцов кольчатых нерп (Phoca hispida, Schreber, 1775) в период размножения усиливалась секреция сальных и апокринных желез, которые издавали сильный специфический аромат [17]. Возможно, он используется для маркировки территории и/или для привлечения самок [18].
Южноафриканские морские котики могли дифференцировать запах рыбы от аромата эфирных масел, а также различать виды рыб по запаху [6].
В научной литературе представлены экспериментальные исследования физиологии и поведения ушастых тюленей; работы по изучению настоящих тюленей представлены недостаточно и в основном посвящены рассмотрению результатов наблюдения за поведением животных. По этой причине нами было проведено исследование обоняния представителей двух видов настоящих тюленей с использованием метода оперантного обучения.
Материалы и методы
Эксперимент проводили в условиях аквакомплекса ММБИ на акватории Кольского залива; подопытные животные – две самки серого тюленя (Halichoerus grypus, Fabricius, 1791 ) в возрасте семи лет и две самки гренландского тюленя (Pagophilus groenlandicus, Erxleben, 1777) в возрасте двух лет. К началу экспериментальных работ все животные были здоровы и обучены по схеме "выбор из двух стимулов".
В качестве обонятельных стимулов использовались 10%-е растворы камфорного масла и диметилсульфида. Запах камфоры был выбран потому, что он, во-первых, согласно современной стереохимической теории обоняния относится к первичным запахам, а во-вторых, тюлени, обитающие в Арктике, не могли сталкиваться с данным запахом ранее, поэтому камфора являлась для них индифферентным раздражителем. Запах диметилсульфида, предположительно, имеет важное биологическое значение для ластоногих. Диметилсульфид образуется в ходе метаболического разложения диметилсульфониопропионата, выделяемого в воду фитопланктоном в период его цветения [19]. Установлено, что северная качурка (Oceanodroma leucorhoa, Vieillot, 1818) [20], странствующий альбатрос (Diomedea exulans, Linnaeus, 1758) [21] и голубой буревестник (Halobaena caerulea, Gmelin, 1789) [22] находят места кормления по запаху диметилсульфида. Пингвины резко увеличивают свою двигательную активность в местах распыления ДМС [23]. Возможно, что по наличию в воде ДМС находят места скопления планктона некоторые виды акул [24] и рифовых рыб [25]. Экспериментально выявлена высокая чувствительность обыкновенных тюленей (Phoca vitulina, Linnaeus, 1758) к диметилсульфиду и установлено, что она на порядки выше, чем у людей [26].
Эксперимент был разделен на три этапа. На первом этапе животных обучали дифференцировать контейнер с раствором камфоры от пустого контейнера; на втором – дифференцировать контейнер с раствором ДМС от пустого контейнера; на третьем – дифференцировать контейнер с ДМС от контейнера с раствором камфоры. Для проведения экспериментов стимульные вещества разводили в дистиллированной воде до такой концентрации, чтобы интенсивность запаха была минимальна, затем раствор помещали в контейнер.
Экспериментальная установка представляла собой две трубы, закрепленные на деревянном брусе (рис. 1). Трубы имели длину 30 см и диаметр 6 см, благодаря чему тюлени могли свободно просовывать в них переднюю часть головы и дышать. В каждой трубе было вырезано отверстие диаметром 8 см, в которое помещались контейнеры с тестовыми веществами. С противоположного конца трубы закреплен электрический вентилятор, который создавал ток воздуха в трубе, что позволяло минимизировать влияние таких факторов, как ветер и посторонние запахи.

Рис. 1. Экспериментальная установка Fig. 1. Experimental installation
Экспериментальную установку помещали в вольер на расстоянии 1 м от стартовой позиции животного. Тюленей обучали по команде засовывать переднюю часть головы в трубу и оставаться в таком положении до 10 с. Также животных приучали к звуку работающего вентилятора.
В контейнер помещали тестовое вещество (положительный стимул), в другой контейнер – дистиллированную воду (отрицательный стимул) и устанавливали их в трубы. На третьем этапе, когда изучалась способность исследуемых тюленей дифференцировать между собой растворы диметилсульфида и камфоры, в один контейнер помещали диметилсульфид (положительный стимул), в другой – камфору (отрицательный стимул). Взаиморасположение контейнеров меняли в случайном порядке, но не более двух одинаковых комбинаций подряд, чтобы избежать "ассоциации с местоположением" у исследуемых тюленей.
Тюлень занимал стартовую позицию и по команде должен был найти трубу с положительным стимулом и зафиксировать переднюю часть головы в нем на 10 с. Животному разрешалось обследовать обе трубы. В случае правильного выполнения следовало пищевое подкрепление в виде рыбы. Эксперименты проводились в утреннее (10:00) и вечернее (17:00) время.
С животными проводили обучающие тренировки, когда тренер подталкивал к правильному выбору; количество предъявлений за тренировку не лимитировалось; учитывался только результат последней тренировки, который должен быть выше вероятности случайного выбора. Готовность к проведению контрольных испытаний определял тренер тюленя. Обучающие тренировки проводили в осенне-зимний период при стабильной безветренной погоде без атмосферных осадков и полном отсутствии посторонних запахов.
В ходе контрольных испытаний проводилось по 20 тренировок с 20 демонстрациями пар стимулов на каждой; за верные выборы стимула тюлень получал фиксированное пищевое поощрение. Тренировки осуществлялись по возможности при полном штиле (или максимум при 2 баллах по шкале Бофорта) и отсутствии сильных посторонних запахов, атмосферных осадков и иных раздражителей. Перед началом тренировки с тюленем проводились тестовые испытания для определения уровня работоспособности, состоящие из команд на возбуждение и торможение ЦНС и команд по переходу из состояния возбуждения в состояние торможения и обратно. К тренировке приступали только при высоком уровне работоспособности животного. Эти условия соблюдались для того, чтобы минимизировать влияние внешних факторов среды и изменений состояния подопытного животного на количество верных выборов.
Результаты и обсуждение
На первом этапе обучение серого тюленя 1 заняло шесть тренировок (в результате наблюдалось 75 % верных выборов), серого тюленя 2 – три тренировки (80 %), гренландского тюленя 1 – семь тренировок (80 %), гренландского тюленя 2 – семь тренировок (75 % верных выборов).
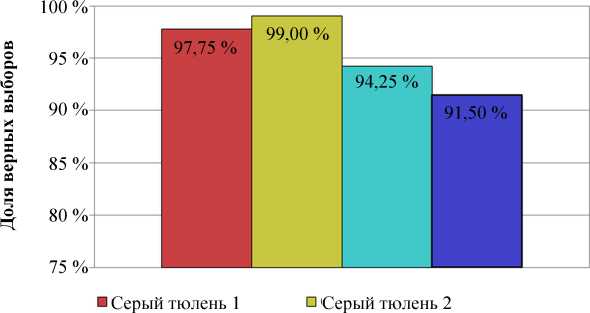
При проведении контрольных испытаний все тюлени достоверно отличали контейнер с раствором камфоры от ложного контейнера (рис. 2), при этом серые тюлени в среднем совершали одну ошибку за тренировку, гренландские тюлени – две-три ошибки за тренировку.
□ Гренландский тюлень 1 □ Гренландский тюлень 2
Рис. 2. Доля верных выборов при дифференцировке контейнера с раствором камфоры от пустого контейнера
Fig. 2. The proportion of correct choices when differentiating a container with a solution of camphor from an empty container
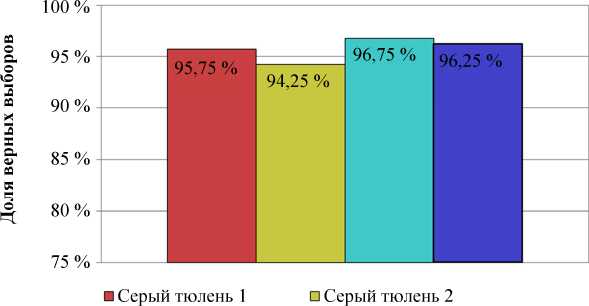
На втором этапе серый тюлень 1 обучился отличать контейнер с раствором ДМС в ходе четвертой тренировки (75 % верных выборов), серый тюлень 2 – седьмой тренировки (75 %), гренландские тюлени обучились во время двенадцатой тренировки (80 % верных выборов) (рис. 3). При проведении контрольных испытаний все тюлени достоверно отличали контейнер с раствором ДМС от пустого контейнера. При этом серые тюлени в среднем совершали по две ошибки за тренировку, гренландские – по одной ошибке.
□ Гренландский тюлень 1 □ Гренландский тюлень 2
Рис. 3. Доля верных выборов при дифференцировке контейнера с раствором ДМС от пустого контейнера Fig. 3. The proportion of correct choices when differentiating a container with a solution of LCA from an empty container
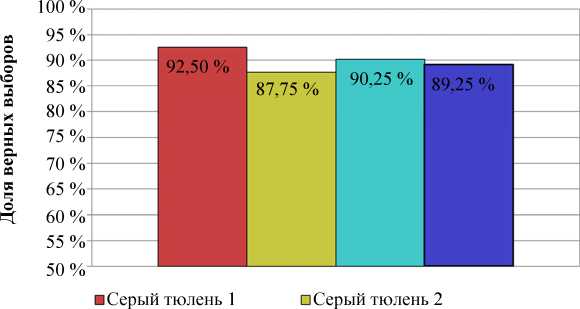
На третьем этапе серые тюлени уже на первой тренировке достоверно отличали контейнер с раствором ДМС от контейнера с раствором камфоры, при этом запах ДМС тюлени выбирали с первого предъявления пары стимулов. У серого тюленя 1 результат составил 95 % верных выборов, у серого тюленя 2 – 90 %. Обучение гренландского тюленя 1 заняло 20 тренировок (75 % верных выборов); гренландского тюленя 2 – 21 тренировку (85 % верных выборов); при этом на первых тренировках, несмотря на отсутствие подкрепления, тюлени в большинстве случаев (более 70 % выборов) выбирали контейнер с раствором камфоры (рис. 4).
□ Гренландский тюлень 1 □ Гренландский тюлень 2
Рис. 4. Доля верных выборов при дифференцировке контейнера с раствором ДМС от контейнера с раствором камфоры Fig. 4. The proportion of correct choices when differentiating a container with a solution of LCA from a container with a solution of camphor
При проведении контрольных испытаний все тюлени достоверно отличали контейнер с раствором ДМС от контейнера с раствором камфоры, в среднем совершая две-три ошибки за тренировку.
Заключение
Результаты проведенных исследований демонстрируют возможности тюленей двух видов вырабатывать двигательный условный рефлекс на обонятельные раздражители, а также их способности отличать один запах от другого. В процессе дифференцировки контейнера с запахом серые тюлени обучались быстрее гренландских тюленей, при дифференцировке двух запахов гренландские тюлени обучались на порядок медленнее. Схожие динамики обучения данных видов и результаты контрольных испытаний отмечались и при проведении исследований, касающихся выработки условных рефлексов на раздражители других модальностей [27]. Данное отличие в скорости обучения, вероятно, связано с видовыми особенностями исследуемых тюленей и свидетельствует о более высокой пластичности нервной деятельности серых тюленей, обитающих в условиях побережья, где информационная среда более насыщена, в отличие от гренландских тюленей, которые значительную часть жизни проводят либо в открытых водах, совершая сезонные миграции, либо вблизи паковых льдов, где редко встречаются с большими наборами запахов.
Список литературы Исследование обоняния серых и гренландских тюленей с помощью метода оперантного обучения
- Lowell W. R., Flanigan Jr W. F. Marine mammal chemoreception//Mammal review. 1980. V. 10, Iss. 1. P. 53-59. DOI: https://doi.org/10.1111/j.1365-2907.1980.tb00233.x.
- Brown R. E. The marine mammals: orders Cetacea, Pinnipedia, and Sirenia//Social odours in mammals/eds R. E. Brown, D. W. Macdonald. Oxford University Press, 1985. V. 2. P. 723-731.
- Thewissen J. G. M., George J., Rosa C., Kishida T. Olfaction and brain size in the bowhead whale (Balaena mysticetus)//Marine Mammals science, 2011. V. 27, Iss. 2. P. 282-294. j.1748-7692.2010.00406.x DOI: https://doi.org/10.1111/
- Feng P., Zheng J., Rossiter S. J., Wang D., Zhao H. Massive losses of taste receptor genes in toothed and baleen whales//Genome Biology and Evolution. 2014. V. 6, Iss. 6. P. 1254-1265. 10.1093/gbe/evu095 DOI: https://doi.org/
- Shusterman J. R. Behavioral capabilities of seals and sea lions: a review of their hearing, visual, learning and diving skills//The Psychological Record. 1981. V. 31, Iss. 2. P. 125-143. 10.1007/BF03394729 DOI: https://doi.org/
- Laska M., Svelander M., Amundin M. Successful acquisition of an olfactory discrimination paradigm by South African fur seals, Arctocephalus pusillus//Physiology & Behavior. 2008. V. 93, Iss. 4-5. P. 1033-1038.
- Ross G. J. Nuzzling behaviour in captive cape fur seals//International Zoo Yearbook. 1972. V. 12, Iss. 1. P. 183-184. DOI: https://doi.org/10.1111/j.1748-1090.1972.tb02321.x.
- Kovacs K. M. Maternal behaviour and early behavioural ontogeny of harp seals, Phoca groenlandica//Animal Behaviour. 1987. V. 35, Iss. 3. P. 844-855. DOI: https://doi.org/10.1016/S0003-3472(87)80120-3.
- Kovacs K. M. Mother-pup reunions in harp seals, Phoca groenlandica: cues for the relocation of pups//Canadian Journal of Zoology. 1995. V. 73, N 5. P. 843-849 DOI: https://doi.org/10.1139/z95-099
- Bartholomew G. A. Mother-young relations and the maturation of pup behavior in the Alaska fur seal//Animal Behaviour. 1959. V. 7, Iss. 3-4. P. 163-171. DOI: https://doi.org/10.1016/0003-3472(59)90005-3.
- Phillips A. V. Behavioral cues used in reunions between mother and pup South American fur seals (Arctocephalus australis)//Journal of Mammalogy. 2003. V. 84, Iss. 2. P. 524-535. 10.1644/1545-1542(2003)0842.0.CO;2 DOI: https://doi.org/
- Dobson F. S., Jouventin P. How mothers find their pups in a colony of Antarctic fur seals//Behavioural processes. 2003. V. 61, Iss.1-2. P. 77-85. DOI: https://doi.org/10.1016/S0376-6357(02)00164-X.
- Pitcher B. J., Harcourt R. G., Schaal B., Charrier I. Social olfaction in marine mammals: wild female Australian sea lions can identify their pup's scent//Biology Letters. 2011. V. 7. P. 60-62. URL: http://rsbl.royalsocietypublishing.org/content/roybiolett/7/1/60.full.pdf.
- Чечина О. Н. Видотипичное поведение сивучей (этологический атлас). Севастополь: Паритет-Информ, 2004. 120 c.
- Miller E. H. Social behaviour between adult male and female New Zealand fur seals, Arctocephalus forsteri (Lesson) during the breeding season//Australian Journal of Zoology. 1974. V. 22, N 2. P. 155-173 DOI: https://doi.org/10.1071/ZO9740155
- Белонович О. А., Рожнов В. В., Мамаев Е. Г., Бурканов В. Н. Обонятельные контакты сивучей (Eumetopias jubatus)//Морские млекопитающие Голарктики: сб. науч. тр. по материалам четвертой междунар. конф., Санкт-Петербург, Россия, 10-14 сент. 2006 г. Санкт-Петербург: Совет по морским млекопитающим, 2006. С. 64-67.
- Hardy M. H., Roff E., Smith T. G., Ryg M. Facial skin glands of ringed and grey seals, and their possible function as odoriferous organs//Canadian Journal of Zoology. 1991. V. 69, N 1. P. 189-200 DOI: https://doi.org/10.1139/z91-029
- Ryg M., Solberg Y., Lydersen C., Smith T. G. The scent of rutting male ringed seals (Phoca hispida)//Journal of Zoology. 1992. V. 226, Iss. 4. P. 681-689. DOI: https://doi.org/10.1111/j.1469-7998.1992.tb07509.x.
- Kiene R. P., Linne L. J., Bruton J. A. New and important roles for DMSP in marine microbial communities//Journal of Sea Research. 2000. V. 43, Iss. 3-4. P. 209-224. DOI: https://doi.org/10.1016/S1385-1101(00)00023-X.
- Nevitt G. A., Haberman K. Behavioral attraction of Leach's storm-petrels (Oceanodroma leucorhoa) to dimethyl sulfide//The Journal of Experimental Biology. 2003. V. 206, Iss. 9. P. 1497-1501. URL: http://jeb.biologists.org/content/jexbio/206/9/1497.full.pdf.
- Nevitt G. A., Losekoot M., Weimerskirch H. Evidence for olfactory search in wandering albatross, Diomedea exulans//Proceedings of the National Academy of Sciences. 2008. V. 105, Iss. 12. P. 4576-4581 DOI: https://doi.org/10.1073/pnas.0709047105
- Bonadonna F., Caro S., Jouventin P., Nevitt G. A. Evidence that blue petrel, Halobaena caerulea, fledglings can detect and orient to dimethyl sulfide//The Journal of Experimental Biology. 2006. V. 209, Iss. 11. P. 2165-2169. URL: http://jeb.biologists.org/content/jexbio/209/11/2165.full.pdf.
- Culik B. Finding food in the open ocean: foraging strategies in Humboldt penguins//Zoology. 2001. V. 104, Iss. 3-4. P. 327-338 DOI: https://doi.org/10.1078/0944-2006-00038
- Sims D. W., Quayle V. A. Selective foraging behaviour of basking sharks on zooplankton in a small-scale front//Nature. 1998. V. 393. P. 460-464 DOI: https://doi.org/10.1038/30959
- DeBose J. L., Lema S. C., Nevitt G. A. Dimethylsulfoniopropionate as a foraging cue for reef fishes//Science. 2008. V. 319, Iss. 5868. P. 1356 DOI: 10.1126/science.1151109
- Kowalewsky S., Dambach M., Mauck B., Dehnhardt G. High olfactory sensitivity for dimethyl sulphide in harbour seals//Biology Letters. 2006. V. 2. P. 106-109. DOI: http://dx.doi.org/10.1098/rsbl.2005.0380.
- Ишкулов Д. Г., Михайлюк А. Л., Пахомов М. В. Особенности цветовосприятия у серых тюленей//Вестник Кольского научного центра РАН. 2013. № 4 (15). С. 84-90.


