Исследование плодов образцов томата Solanum lycopersicum L., происходящих из разных климато-географических зон, и идентификация метаболитов методом тандемной масс-спектрометрии
Автор: Чунихина Ольга Александровна, Разгонова Майя Петровна, Захаренко Александр Михайлович, Голохваст Кирилл Сергеевич
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 4 (60), 2021 года.
Бесплатный доступ
Актуальность. Целый ряд научных исследований подтверждает, что потребление фруктов и овощей может снизить риск некоторых хронических заболеваний, таких как рак и сердечнососудистые заболевания, например, потребление свежих помидоров и продуктов из томатов обратно пропорционально развитию некоторых видов рака. Плоды томата Solanum lycopersicum L. содержат большое количество полифенольных комплексов, являющихся биологически активными соединениями. В данной статье авторы впервые попытались представить полный метаболомный состав экстрактов плодов Solanum lycopersicum. Материалы и методы: В качестве объекта исследования были использованы плоды томатов Solanum lycopersicum L. из коллекции Всероссийского института генетических ресурсов им. Н.И. Вавилова, выращенные и собранные на Дальневосточной опытной станции Филиале ВИР в сентябре 2020 года (сорта: к-5351 Ont77 13, Канада; к-3149 Rehovoth, Израиль; 2698 Украина). Для идентификации целевых аналитов в экстрактах, полученных мацерационным методом, использована высокоэффективная жидкостная хроматография (ВЭЖХ) в комплексе с ионной ловушкой BRUKER DALTONIKS (тандемная масс-спектрометрия). Результаты: Результаты начальных исследований выявили присутствие 36 полифенольных соединений и соединений других классов, из них 22 идентифицировано впервые в Solanum lycopersicum L. Это апигенин, лютеолин, кампферол, таксифолин, мирицетин, кутаровая кислота, кофеилмалевая кислота, кафтаровая кислота, дикаффеоилхиновая кислота, кумарины фраксетин и глюкоронид фраксетина, антоцианин пеларгонидин, сальвианоловая кислота D, розманол, колнеленовая кислота, этил розмаринат, лигнан медиоресинол, сквален и др. Полученные данные помогут интенсифицировать будущие исследования по разработке и производству различных продуктов функционального питания, содержащих целевые экстракты Solanum lycopersicum L.
Томат, вэжх- мс/мс, тандемная масс-спектрометрия, полифенольные соединения
Короткий адрес: https://sciup.org/140257617
IDR: 140257617 | УДК: 635.64:581.1.045:581.13 | DOI: 10.18619/2072-9146-2021-4-99-104
Текст научной статьи Исследование плодов образцов томата Solanum lycopersicum L., происходящих из разных климато-географических зон, и идентификация метаболитов методом тандемной масс-спектрометрии
Оригинальные статьи / Originalarticles УД-9К9 6-13054.64:581.1.045:581.13
Настоящая работа рассматривает детальный метаболомный анализ томатов Solanum lycopersicum L., из коллекции Всероссийского института генетических исследований им. Н.И. Вавилова, выращенных и собранных на Дальневосточной опытной станции Филиале ВИР в сентябре 2020 года. В выборке представлен мета-боломный анализ мацерационных экстрактов плодов томатов к-5351 Ont77 13 (Канада), к-3149 Rehovoth (Израиль) и 2698 (Украина).
2. Материалы и методы2.1 Материалы
В качестве объекта исследования были использованы плоды томатов Solanum lycopersicum L., из коллекции Всероссийского института генетиче- ских исследований им. Н.И. Вавилова, выращенные и собранные на Дальневосточной опытной станции Филиале ВИР в сентябре 2020 года (сорта: к-5351 Ont77 13, Канада; к-3149 Rehovoth, Израиль; 2698 Украина).
2.2 Методы 2.1 Дробная мацерация. Для получения высококонцентрированных экстрактов была применена дробная мацерация. При этом общее количество экстрагента (метилового спирта х.ч.) разделено на 3 части и последовательно настояно на плодах Solanum lycopersicum L., с первой частью, затем со второй и третьей. Время настойки каждой части экстрагента составляло 7 дней. 2.2 Высокоэффективная жидкостная хромато-графия.Для выполнения разделения многокомпонентных смесей использовался жидкостный хроматограф высокого давления Shim adzu LC –20 Prominence HPLC (Shimadzu, Япония), оборудованный U V-детектором и обратнофазной колонкой Shodex ODP-40 4E. Программа элюции градиента следующая: 0,0 – 4 мин, 100% CH3CN; 4 – 60 мин, 100% – 25% CH3CN; 60 – 75 мин, 25% – 0 % CH3CN; контрольная промывка 75-120 мин 0% CH3CN. Весь ВЭЖХ-анализ сделан с UV-VIS-детектором SPD-20A (Kanda-Nishikicho 1-chrome, Shimadzu, Chiyoda-ku, Токио, Япония) при длинах волн 230 ηм и 330 ηм; температура 17°С. Объем впрыска составлял 1 мл. 2.3 Тандемная масс-спектрометрия. Масс-спектрометрические данные получены с помощью ионной ловушки a m aZ on SL (производство фирмы «BRU KER D ALTON IKS», Германия), оснащенной источником ионизации электрораспылением ESIв режимах отрицательных и положительных ионов. Оптимизированные параметры получены следующим образом:температура источника ионизации: 70°С, поток газа: 4 л/мин, газ-небилайзер (распылитель): 7,3 psi, капиллярное напряжение: 4500 V, напряжение на изгибе торцевой пластины: 1500 V, фрагментатор: 28 0 V, энергия столкновения: 60 eV.Масс-спектрометр использовался в диапазоне сканирования m /z 100 – 1.700 для M С и МС/МС. Произведена фрагментация 4 порядка.
3. Результаты исследований
Уточнение метаболомного состава – чрезвычайно важный результат в системе биохимического анализа. В данной работе был использован метод ВЭЖХ-MС/MС с дополнительной ионизацией и анализом фрагментированных ионов. Высокоточные масс-спектрометрические данные регистрировались на ионной ловушке AMAZON SL BRUKER DALTONIKS, оснащенной источником ESIв режиме отрицатель-
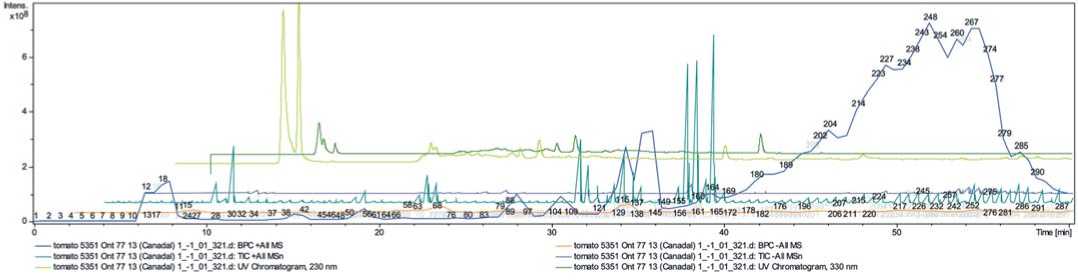
Рис.1.Распределенный график тандемной масс-спектрометрии анализируемых целевых аналитов экстракта Solanum lycopersicum (к-5351 Ont77 13, Канада), представленный ионной хроматограммой
Fig 1.Chemicalprofilesofthe Solanum lycopersicum (variety к-5351 Ont77 13, Canada)
sample represented totalion chromatogram from MeOH-extract
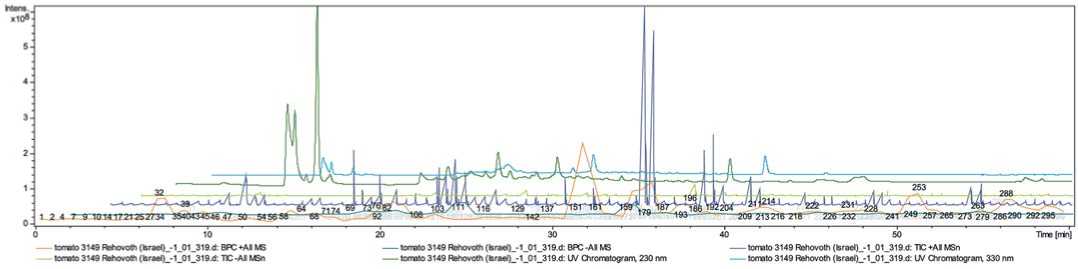
Рис.2.Распределенный график тандемной масс-спектрометрии анализируемых целевых аналитов экстракта
Solanum lycopersicum (к-3149 Rehovoth, Израиль), представленный ионной хроматограммой
Fig 2.Chemicalprofilesofthe Solanum lycopersicum (variety к-3149 Rehovoth, Israel) sample represented totalion chromatogram from MeOH-extract
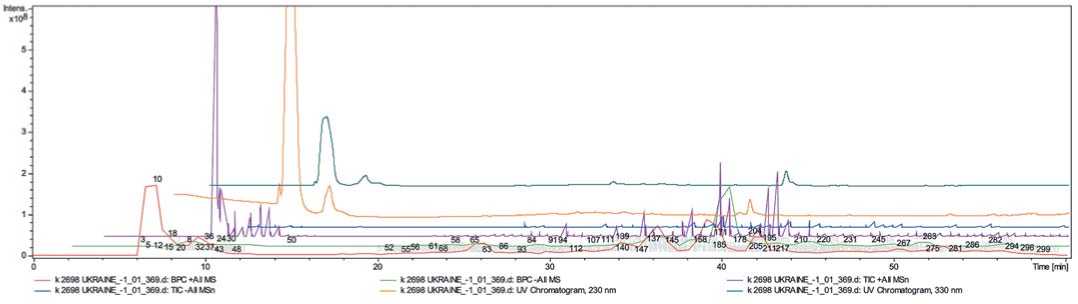
Рис.3.Распределенный график тандемной масс-спектрометрии анализируемых целевых аналитов экстракта Solanum lycopersicum (2698 Украина), представленный ионной хроматограммой
Fig 3.Chemicalprofilesofthe Solanum lycopersicum (variety 2698, Ukraine)
sample represented totalion chromatogram from MeOH-extract
ных/положительных ионов. Использовалось четырехступенчатое фрагментирование ионов.
Ниже представлены распределенные графики тандемной масс-спектрометрии анализируемых целевых аналитов экстрактов Solanum lycopersicum (рис.1, 2, 3). Всего на ионных хроматограммах было обнаружено 300 пиков выделенных целевых аналитов.
Для простоты идентификации составлена унифицированная системная таблица молекулярных масс целевых аналитов,выделенных из экстрактов плодов Solanum lycopersicum (табл. 1). В результате масс-спектрометрического исследования выделено 36 метаболомных соединений, из них 22 комплекса идентифицированы в Solanum lycopersicum впервые. Идентификация соединений (значения
Таблица 1. Соединения, идентифицированные в экстракте плодов Solanum lycopersicum Table 1. Identified target analytes in MeOH extracts of Solanium lycopersicum
|
Группа соединений |
Идентификация соединения |
Химическа я формула |
Молярная масса |
Ион-аддукт [M-H]- |
Ион-аддукт [M+H]+ |
MS/MS фрагментация 1 порядка |
MS/MS фрагментация 2 порядка |
MS/MS фрагментация 3 порядка |
||
|
Коллекционные номера ВИР |
Полифенолы |
|||||||||
|
1 |
2698 Ukraine |
Флавон |
Apigenin [5,7-Dixydroxy-2-(40Hydroxyphenyl)-4H-Chromen-4-One] |
C15H10O5 |
270.2369 |
269 |
179; 119 |
161; 143; 113 |
||
|
2 |
2698 Ukraine |
Флавон |
Luteolin |
C15H10O6 |
286.2363 |
287 |
227; 269; 153; 114 |
153; 130 |
||
|
3 |
2698 Ukraine |
Флавон |
5,6-Dihydroxy-7,8,3',4'-tetram-ethoxyflavone |
C19H18O8 |
374.3414 |
373 |
341 |
297; 269; 241; 176; 134 |
239; 152 |
|
|
4 |
к-3149 Rehovoth (Israel) |
Флавон |
Chrysoeriol O-hexoside |
C22H22O11 |
462.4036 |
463 |
454; 416; 391; 347; 327; 307 |
445; 407; 398; 391; 380; 347; 329 |
||
|
5 |
2698 Ukraine |
Флавон |
Apigenin-C-hexoside-C-pentoside |
C26H28O14 |
564.4921 |
565 |
536; 505;457; 353; 321 |
457; 430; 329; 273 |
442; 381 |
|
|
6 |
2698 Ukraine |
Флаванол |
Kaempferol |
C15H10O6 |
286.2363 |
287 |
185; 268; 215; 154 |
275 |
||
|
7 |
2698 Ukraine |
Флаванол |
Quercetin |
C15H10O7 |
302.2357 |
|||||
|
8 |
к-3149 Rehovoth (Israel) |
Флаванол |
Dihydroquercetin (Taxifolin; Taxifoliol) |
C15H12O7 |
304.2516 |
305 |
303; 285; 260; 231; 212 |
274; 260; 217; 174 |
||
|
9 |
2698 Ukraine |
Флаванол |
Myricetin |
C15H10O8 |
318.2351 |
319 |
272; 247; 192; 151 |
133 |
||
|
10 |
к-3149 Rehovoth (Israel) |
Флаванол |
Rutin (Quercetin 3-O-Rutinoside) |
C27H30O16 |
610.5175 |
609 |
300; 170 |
271; 178; 121 |
270; 199; 163 |
|
|
11 |
к-3149 Rehovoth (Israel); к-5351 Ont 77 13 (Canada) |
Флаванол |
Rutin-O-pentoside |
C32H38O20 |
742.6321 |
741.11 |
300; 723; 651; 609; 506; 385; 255 |
271; 151 |
||
|
12 |
к-3149 Rehovoth (Israel) |
Флаванон |
Naringenin [Naringetol; Naringenine] |
C15H12O5 |
272.5228 |
271 |
179 |
163; 119 |
||
|
13 |
к-3149 Rehovoth (Israel) |
Флаванон |
Naringenin-O-hexoside |
C21H22O10 |
434.3934 |
433 |
271 |
151; 177; 119.11 |
||
|
14 |
к-3149 Rehovoth (Israel); к-5351 Ont 77 13 (Canada) |
Фенилпропаноид (производное коричной кислоты) |
p-Coumaric acid |
C9H8O3 |
164.16 |
165 |
120; 149 |
120 |
||
|
15 |
к-3149 Rehovoth (Israel); 2698 Ukraine |
Гидроксикоричная кислота |
Coutaric acid [Trans-P-Coumaroyltartaric acid] |
C13H12O8 |
296.2296 |
297.18 |
147; 204; 237 |
119 |
||
|
16 |
к-5351 Ont 77 13 (Canada); 2698 Ukraine |
Гидроксикоричная кислота |
Caffeoylmalic acid |
C13H12O8 |
296.2296 |
297.2 |
279; 266; 239; 218; 195; 167 |
205.17; 182 |
||
|
17 |
к-3149 Rehovoth (Israel) |
Гидроксикоричная кислота |
Caftaric acid [Cis-Caftaric acid; 2-Caffeoyl-L-Tartaric acid; Caffeoyl Tartaric acid] |
C13H12O9 |
312.23 |
313 |
120; 177; 283 |
|||
|
18 |
к-3149 Rehovoth (Israel); 2698 Ukraine |
Гидроксикоричная кислота |
Caffeic acid-O-hexoside [Caffeoyl-O-hexoside] |
C15H18O9 |
342.298 |
341 |
281; 251; 179; 135 |
179; 221 |
||
|
19 |
к-3149 Rehovoth (Israel) |
Фенилпропаноид (производное коричной кислоты) |
Chlorogenic acid [3-O-Caffeoylquinic acid] |
C16H18O9 |
354.3087 |
353 |
191; 255; 316 |
173; 127 |
||
|
20 |
к-3149 Rehovoth (Israel); к-5351 Ont 77 13 (Canada) |
Фенилпропаноид (производное коричной кислоты) |
Cryptochlorogenic acid [4-O-Caffeoylquinic acid; Quinic acid 4-O-Caffeate] |
C16H18O9 |
354.3087 |
353 |
191 |
111; 172 |
||
|
21 |
к-3149 Rehovoth (Israel) |
Фенилпропаноид (производное коричной кислоты) |
4,5-O-dicaffeoylquinic acid [Isochlorogenic acid C] |
C25H24O12 |
516.4509 |
517 |
477; 471; 458; 409; 359; 349; 323; 265; 217; 183; 167 |
|||
|
22 |
к-3149 Rehovoth (Israel); к-5351 Ont 77 13 (Canada) |
Производное гидроксибензойной кислоты |
Vanillic acid-O-hexoside |
C14H18O9 |
330.2889 |
329 |
229; 212; 183; 171; 153; 247; 273; 293; 311 |
211; 183; 167; 155 |
211; 193; 183; 175; 151 |
|
|
23 |
к-3149 Rehovoth (Israel); к-5351 Ont 77 13 (Canada);. |
Гидроксибензойная кислота |
Salvianolic acid D |
C20H18O10 |
418.3509 |
417 |
373; 347 |
347; 329; 303 |
347; 329; 303 |
|
|
24 |
2698 Ukraine |
Антоцианин |
Pelargonidin [Pelargonidol chloride] |
C15H11O5+ |
271.2493 |
271 |
253; 197; 169; 135 |
233; 208; 181; 145 |
||
|
25 |
к-5351 Ont 77 13 (Canada); 2698 Ukraine |
Кумарин |
Fraxetin |
C10H8O5 |
208.1675 |
207 |
179; 161; 136 |
135 |
||
|
26 |
к-5351 Ont 77 13 (Canada) |
Кумарин |
Fraxetin-7-O-beta-glucuronide |
C16H16O11 |
384.2916 |
385 |
342; 317; 293; 235; 227; 209; 177 |
|||
|
27 |
2698 Ukraine |
Другие соединения Циклогексанкарбоновая кислота |
Perillic acid |
C10H14O2 |
166.217 |
165 |
147 |
119 |
||
|
28 |
к-5351 Ont 77 13 (Canada); 2698 Ukraine |
Трикарбоновая кислота |
Citric acid [Anhydrous; Citrate] |
C6H8O7 |
192.1235 |
191 |
111; 173; 129 |
111 |
||
|
29 |
2698 Ukraine |
Омега-3 жирная кислота |
Linolenic acid (Alpha-Linolenic acid; Linolenate) |
C18H30O2 |
278.4296 |
279 |
260; 233; 207; 166; 120 |
120 |
||
|
30 |
к-3149 Rehovoth (Israel) |
Оксилипин |
Colnelenic acid |
C18H28O9 |
292.4131 |
293.03 |
275; 230; 147 |
257; 229; 147 |
||
|
31 |
к-3149 Rehovoth (Israel); 2698 Ukraine |
Оксилипин |
11-Hydroperoxy-octadecatrienoic acid |
C18H30O4 |
310.4284 |
309 |
291; 265; 247; 209; 193; 183; 171 |
273; 223; 211; 193; 178; 167; 151; 137 |
||
|
32 |
2698 Ukraine |
Дитерпеноид |
Rosmanol |
C20H26O5 |
346.4174 |
345 |
299; 271; 239; 209; 179 |
271; 226; 179; 125 |
243; 227; 1 99; 156 |
|
|
33 |
2698 Ukraine |
Бензолпропановая кислота |
Ethyl rosmarinate |
C20H20O8 |
388.3680 |
387 |
163; 207; 245; 287 |
164 |
||
|
34 |
к-5351 Ont 77 13 (Canada) |
Тритерпеноид |
Squalene (Trans-Squalene; Spinacene; Supraene) |
C30H50 |
410.718 |
411 |
203; 393; 351; 338; 291; 249; 231; 185; 166 |
143 |
||
|
35 |
к-3149 Rehovoth (Israel) |
Тритерпеноид |
1-Hydroxy-3-oxours-12-en-28-oic acid |
C30H46O4 |
470.6838 |
471 |
461.58; 380.58; 255; 162 |
453; 347; 309.9; 203; 162 |
||
|
36 |
к-5351 Ont 77 13 (Canada); 2698 Ukraine |
Лигнан |
Medioresinol-O-hexoside |
C27H34O12 |
550.6 |
549 |
387; 369; 161 |
163.09; 343.27; 250; 225; 209; 149 |
147 |
Список литературы Исследование плодов образцов томата Solanum lycopersicum L., происходящих из разных климато-географических зон, и идентификация метаболитов методом тандемной масс-спектрометрии
- Carrillo-Lopez A., Yahia E. HPLC–DAD–ESI–MS Analysis of Phenolic Compounds During Ripening in Exocarp and Mesocarp of Tomato Fruit. J. Food Sci. 2013;78(12):1839-1844.
- Chen X., Zhang S., Xuan Z., Ge D., Chen X., Zhang J., Wang Q., Wu Y., Liu B. The Phenolic Fraction of Mentha haplocalyx and Its Constituent Linarin Ameliorate Inflammatory Response through Inactivation of NF-kB and MAPKs in Lipopolysaccharide-Induced RAW264.7 Cells. Molecules. 2017;(22):811.
- Cirlini M., Mena P., Tassotti M., Herrlinger K. A., Nieman K. M. Dall’Asta C., Del Rio D. Phenolic and volatile composition of a dry spearmint (Mentha spicata L.). Molecules. 2016;(21):1007.
- Dinelli G., Segura-Carretero A., Di Silvestro R., Marotti I., Arraez-Roman D., Benedettelli S., Ghiselli L., Fernandez-Gutierrez A. Profiles of phenolic compounds in modern and old common wheat varieties determined by liquid chromatography coupled with time-of-flight mass spectrometry. J. Chromatogr. A. 2011;(1218):7670–7681.
- Farah A., Donangelo C.M. Phenolic compounds in coffee. Braz. J. Plant Physiol. 2006;(18):23–36.
- Giovannucci E. Tomatoes, tomato-based products, lycopene, and cancer: review of the epidemiological literature. J. Nat. Cancer Inst. 1999;(91):317–331.
- Goufo P., Singh R.K., Cortez I. A Reference List of Phenolic Compounds (Including Stilbenes) in Grapevine (Vitis vinifera L.) Roots, Woods, Canes, Stems, and Leaves. Antioxidants. 2020;(9):398.
- Jaiswal R., Muller H., Muller A., Karar M.G.E., Kuhnert N. Identification and characterization of chlorogenic acids, chlorogenic acid glycosides and flavonoids from Lonicera henryi L. (Caprifoliaceae) leaves by LC–MSn. Phytochem. 2014;(108):252-263.
- Jiang R.-W., Lau K.-M., Hon P.-M., Mak T.C.W., Woo K.-S., Fung K.-P. Chemistry and Biological Activities of Caffeic Acid Derivatives from Salvia miltiorrhiza. Current Med. Chem. 2005;(12):237-246.
- Manach C., Scalbert A., Morand C., Remesy C., Jimenez L. Polyphenols: food sources and bioavailability. Am. J. Clin. Nutr. 2004;(79):727–47.
- Marzouk M.M., Hussein S.R., Elkhateeb A., El-shabrawy M., Abdel-Hameed E.-S. S., Kawashty S.A. Comparative study of Mentha species growing wild inEgypt: LC-ESI-MS analysis and chemosystematic significance. J. Applied Pharm. Sci. 2018;8(08):116–122.
- Minoggio M., Bramati L., Simonetti P., Gardana C., Lemoli L., Santangelo E., Mauri P.L., Spigno P, Soressi G.P., Pietta P.G. Polyphenol pattern and antioxidant activity of different tomato lines and cultivars. Ann. Nutr. Metab. 2003;(47):64–9.
- Pandey R., Kumar B. HPLC–QTOF–MS/MS-based rapid screening of phenolics and triterpenic acids in leaf extracts of Ocimum species and their interspecies variation. J. Liquid Chromatogr. & Related. 2016;(39):225-238.
- Robards K, Antolovich M. Analytical chemistry of fruits bioflavonoids: a review. Analyst. 1997;122(2):11R–34R.
- Rodriguez-Perez C., Gomez-Caravaca A.M., Guerre-Hernandez E., Cerretani L., Garcia-Villanova B., Verardo V. Comprehensive metabolite profiling of Solanum tuberosum L. (potato) leaves T by HPLC-ESI-QTOF-MS. Food Res. Int. 2018;(112):390-399.
- Ruiz A., Hermosin-Gutierrez I., Vergara C., von Baer D., Zapata M., Hitschfild A., Obando L., Mardones C. Anthocyanin profiles in south Patagonian wild berries by HPLC-DAD-ESI-MS/MSю=. Food Res. Int. 2013;(51):706-713.
- Temple N.J. Antioxidants and disease: more questions than answers. Nutr. Res. 2000;20(3):449–59.
- Vallverdu-Queralt A., Jauregui O., Medina-Remon A., Lamuela-Raventos R.M. Evaluation of a Method To Characterize the Phenolic Profile of Organic and Conventional Tomatoes. Agricult. Food Chem. 2012;(60):3373-3380.
- Wojakowska A., Perkowski J., Goral T., Stobiecki M. Structural characterization of flavonoid glycosides from leaves of wheat (Triticum aestivum L.) using LC/MS/MS profiling of the target compounds. J. Mass. Spectrom. 2013;(48):329-339.
- Willett W.C. Diet and health: what should we eat? Science. 1994;(264):532–537.
- Zanotti I., Jia P., Dall Asta M., Mena P., Mele L., Ray S., Del Rio D. Atheroprotective effects of (poly)phenols: a focus on cell cholesterol metabolism. Food & Function. 2015;(6):13-31.
- Zhang, Y.; Yan, G.; Sun, C.; Li, H.; Fu, Y.; Xu, W. Apoptosis Effects of Dihydrokaempferol Isolated from Bauhinia championii on Synoviocytes. Hindawi. Evid. -Based Complementary and Alternative Medicine. 2018. Article ID 9806160.


