Исследование поведения моногидрата пероксипентафторотанталата калия при нагревании
Автор: Маслобоева С.М., Макаров Д.В., Нестеров Д.П., Тихомирова Е.Л.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 1 т.12, 2009 года.
Бесплатный доступ
Исследовано поведение моногидрата пероксипентафторотанталата калия при нагревании в атмосфере воздуха. Рассчитаны тепловые эффекты процессов обезвоживания и разложения. Изучена кинетика обезвоживания моногидрата пероксипентафторотанталата калия. Показано, что процесс протекает в диффузионно-кинетической области. В интервале температур 140-170°С рассчитаны кажущиеся константы скорости.
Короткий адрес: https://sciup.org/14294012
IDR: 14294012 | УДК: 546.883.05
Текст научной статьи Исследование поведения моногидрата пероксипентафторотанталата калия при нагревании
Тантал и его соединения, благодаря своим уникальным свойствам, находят применение в различных областях – электронике, твердых сплавах и суперсплавах, химическом оборудовании и др. Танталовые порошки широко используются для изготовления конденсаторов небольших размеров с большой емкостью ( Колосов и др ., 2003).
Одним из распространенных способов получения металлического тантала является его натриетермическое восстановление из гептафторотанталата калия К 2 TaF 7 ( Колосов и др. , 2003). Вместе с тем, остается актуальной задача получения конденсаторных порошков со стабильными параметрами из других высокочистых соединений тантала, например, из моногидрата пероксипентафторотанталата калия К 2 ТаO 2 F 5 ⋅ H 2 O.
Целью настоящей работы являлось исследование термических свойств К 2 ТаO 2 F 5 ⋅ H 2 O.
Синтез К 2 ТаO 2 F 5 ⋅ H 2 O осуществляли из высокочистых фторидных танталсодержащих растворов (реэкстрактов), полученных при экстракционной переработке танталового сырья. Растворы содержали, г/л: Ta 2 O 5 – 119, HF – 110. При проведении укрупненных опытов брали 5 л исходного раствора, который нагревали до 70ºС и вводили 500 мл 30 %-ного Н2О2. Отдельно нагревали до 70ºС раствор KCl (300 г/л) и добавляли его в исходный раствор в количестве, соответствующем 120 % от стехиометрии. Охлаждение вели со скоростью 10-15 град/ч. Полученную смесь отфильтровывали. Осадок К 2 ТаO 2 F 5 ⋅ H 2 O сушили на воздухе в течение 6-8 часов.
Дифференциально-термические (ДТА) и термогравиметрические исследования (ТГА) выполнены на дериватографе Q-1500D (Венгрия) в воздушной атмосфере. Применяли динамический и квазиизотермический режимы.
Рентгенофазовый анализ (РФА) продуктов реакции проводили на дифрактометре ДРОН-2, излучение Cuk α .
ИК спектроскопические исследования выполнены на спектрометре Specord M 80.
Микрографический анализ продуктов синтеза проведен с помощью цифровой сканирующей электронной микроскопии (СЭМ) на микроскопе SEM LEO-420 (Германия).
3. Результаты и их обсуждение
Микрографическое представление кристаллов К2ТаO2F5 ⋅ H2O показано на рис. 1. Кристаллы крупные, имеют пластинчатый облик. По данным кристаллооптических исследований, продукт однофазен, анизотропен, характеризуется показателем преломления N ср = 1.450.
Маслобоева С.М. и др. Исследование поведения моногидрата…

Рис. 1. Пластинчатые кристаллы К 2 ТаO 2 F 5 ⋅ H 2 O. Снимок на СЭМ
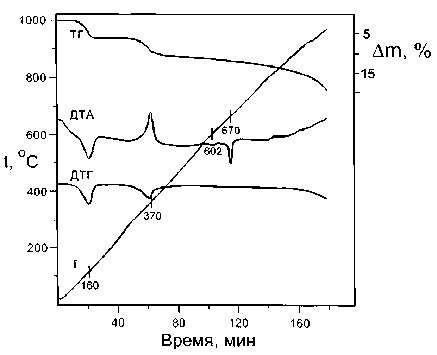
Рис. 2. Дериватограмма соединения К2ТаO2F5 ⋅ H2O. Динамический режим, воздушная атмосфера, скорость нагрева 5 град. ⋅ мин 1
Проведен комплексный термический анализ К2ТаO2F5 ⋅ H2O. На рис. 2 представлена типичная дериватограмма соединения. На кривой ДТА зафиксированы три эндотермических эффекта при температурах 160, 602 и 670ºС и один экзотермический эффект при 370ºС.
Съемка в квазиизотермическом режиме позволила уточнить температуры эффектов, сопровождающиеся потерей массы образца. Установлено, что в интервале 140-200ºС происходит удаление воды с образованием безводного соединения K2TaO2F5, которое остается устойчивым до ~370ºС. Это подтверждено данными РФА, а также ИК спектроскопии.
Потеря воды К2ТаO2F5 ⋅ H2O происходит по схеме:
К 2 ТаO 2 F 5 ⋅ H 2 O = K 2 TaO 2 F 5 + H 2 O.
При 370ºС наблюдается экзотермический эффект (рис. 2), сопровождаемый разложением K 2 TaO 2 F 5 с образованием двух фаз: K 3 TaOF 6 и K 2 Ta 2 O 3 F 6 , последнее из которых – соль Мариньяка. ИК спектр образцов (рис. 3), выдержанных при температурах 370-650ºС, свидетельствует об образовании соли Мариньяка. Фаза K 3 TaOF 6 диагностируется неуверенно из-за наложения полос.
Аналогичные фазы получены при прокаливании исходного соединения при 450ºС в вакууме.
Кристаллооптические исследования подтвердили наличие двух фаз, при этом облик исходных кристаллов сохранен, но кристаллы теряют прозрачность и становятся матовыми.
Можно предположить, что разложение K2TaO2F5 происходит по реакции:
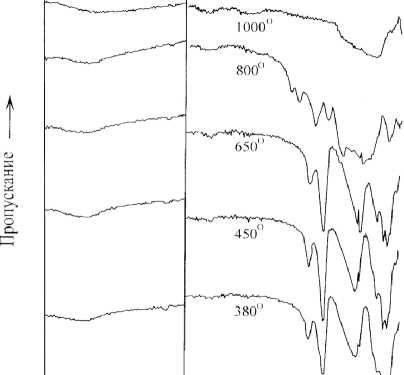
3600 3200 1600 1200 800 400
V, см"1
Рис. 3. ИК спектры продуктов нагревания К 2 ТаO 2 F 5 ⋅ H 2 O
4K 2 TaО 2 F 5 = 2K 3 TaOF 6 + K 2 Ta 2 O 3 F 6 + F 2 O + O 2 . (2)
По данным РФА выдержка образца К 2 ТаO 2 F 5 ⋅ H 2 O при температуре 800ºС в течение двух часов в воздушной атмосфере приводит к образованию смеси фаз K 3 TaO 2 F 4 , K 6 Ta 6,5 O 14,5 F 9,5 и KTaO 3 , а при температуре 1000ºС формируется фаза KTaO 3 (рис. 3). Последняя диагностируется по ИК спектру (широкая полоса поглощения в области 600 см-1).
Наблюдаемые по данным ТГА экспериментальные потери массы близки к расчетным (для процессов (1) и (2) 4.5 и 5.6 % соответственно).
По кривым ДТА были рассчитаны тепловые эффекты процессов потери воды (1) и разложения К 2 ТаO 2 F 5 (2). В качестве реперного вещества для построения калибровочной кривой использовали КСl квалификации о.с.ч. Тепловые эффекты составили для процесса (1) 12.8 кДж/моль, для процесса (2) – 16.2 кДж/моль.
Нами также проведено изучение кинетики обезвоживания моногидрата пероксипентафторотанталата калия, как наиболее важной с прикладной точки зрения стадии.
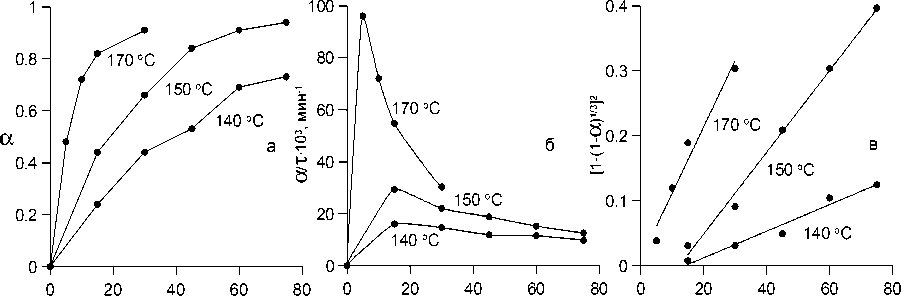
τ , мин. τ , мин τ , мин
Рис. 4. Зависимость степени (а) и скорости (б) потери воды К 2 ТаO 2 F 5 ⋅ H 2 O от времени и кинетические кривые процесса в координатах [1 – (1 – α )1/3]2 – τ (в)
Рис. 4а иллюстрирует степень потери воды К 2 ТаO 2 F 5 ⋅ H 2 O α от времени в интервале температур 140-170ºС. Вид кривых свидетельствует о том, что продолжительность автокаталитического периода исчезающе мала для всех исследованных температур. При 140ºС за 60 мин образец потерял 69 % воды. При повышении температуры на 30ºС за 30 мин степень обезвоживания составила 91 %.
На рис. 4б представлены зависимости α / τ от времени изотермической выдержки τ для исследованных температур. При 140ºС процесс идет практически с постоянной скоростью. При 170ºС кривая скорости обезвоживания проходит максимум через 5 мин взаимодействия (рис. 4б), что свидетельствует о протекании реакции по всей поверхности вещества. Процесс протекает в диффузионно-кинетической области.
Для расчета кажущейся энергии активации Е акт процесса потери воды К 2 ТаO 2 F 5 ⋅ H 2 O нами выбрано параболическое уравнение сжимающейся сферы [1 – (1 – α )1/3]2 = k . τ , используемое в кинетике для описания топохимических реакций, протекающих одновременно по всей поверхности ( Раков, Тесленко , 1982). По тангенсу угла наклона находили значения кажущихся констант скорости k (рис. 4в), расчет Е акт выполнен по уравнению Аррениуса.
Рассчитанные кинетические параметры процесса обезвоживания К 2 ТаO 2 F 5 ⋅ H 2 O:
-
t, ºC 140 150 170
-
k, мин-1 0.0020 0.0063 0.0102
4. Заключение
Е акт = 77 кДж/моль.
Исследовано поведение моногидрата пероксипентафторотанталата калия К 2 ТаO 2 F 5 ⋅ H 2 O при нагревании в атмосфере воздуха. Показано, что на первой стадии в интервале температур происходит удаление воды с образованием безводного соединения K2TaO2F5, которое при нагреве выше 370ºС разлагается с образованием двух фаз: K3TaOF6 и K2Ta2O3F6.
Рассчитаны тепловые эффекты процессов обезвоживания и разложения К 2 ТаO 2 F 5 , составившие 12.8 и 16.2 кДж/моль соответственно.
Изучена кинетика обезвоживания моногидрата пероксипентафторотанталата калия. Показано, что процесс протекает в диффузионно-кинетической области. В интервале температур 140-170ºС рассчитаны кажущиеся константы скорости. Величина кажущейся энергии активации Е акт процесса потери воды составила 77 кДж/моль.
Авторы признательны В.Я. Кузнецову за рентгенографические, О.А. Залкинду за ИК спектроскопические исследования и А.Т. Беляевскому за СЭМ диагностику синтезированного соединения.


