Исследование предшественника препарата, нацеленного на рецептор бомбезина, для пептид-рецепторной радионуклидной терапии
Автор: Белобородов Е.А., Юрова Е.В., Сугак Д.Е., Погодина Е.С., Расторгуева Е.В., Саенко Ю.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 3, 2024 года.
Бесплатный доступ
Онкозаболевания - одна из основных причин смерти от болезней во всем мире. Перспективным методом терапии онкопатологии является пептид-рецепторная радионуклидная терапия, в которой доставка терапевтического радионуклида осуществляется с помощью пептидных векторов, способных связываться со специфическими рецепторами на поверхности раковых клеток. Одними из характерных для многих типов рака рецепторов, на которые могут быть нацелены пептидные векторы, являются рецепторы бомбезина. Пептиды, обладая рядом преимуществ, имеют один серьезный недостаток - низкую стабильность в среде организма. Вариантом решения данной проблемы является включение терапевтического пептида в структуру высокостабильного пептида кноттина.
Онкология, пептид, кноттин, рецептор бомбезина
Короткий адрес: https://sciup.org/14131087
IDR: 14131087 | УДК: 615.277.3 | DOI: 10.34014/2227-1848-2024-3-126-138
Текст научной статьи Исследование предшественника препарата, нацеленного на рецептор бомбезина, для пептид-рецепторной радионуклидной терапии
Введение. Рак является одной из основных причин смерти от болезней во всем мире. Согласно оценкам Глобальной онкологической обсерватории (GLOBOCAN) в 2020 г. во всем мире было зарегистрировано около 19,3 млн новых случаев рака и почти 10,0 млн смертей от него. Ожидается, что бремя, связанное с раком, составит 28,4 млн случаев в 2040 г., что на 47 % больше по сравнению с 2020 г. [1].
Долгое время основными методами терапии онкозаболеваний были хирургический, химио- и радиотерапевтический. Однако данные методы, несмотря на широкое распространение, имеют серьезные недостатки: хирургия малоэффективна при метастазирующих типах рака, радио- и химиотерапия не обладают тканеспецифичностью, что приводит к проявлению токсичности по отношению к здоровым тканям и тяжелым побочным эффектам [2].
Прорывом в лечении онкопатологии стала разработка таргетной терапии, которая позволяет оказывать терапевтическое воздействие непосредственно на раковые клетки, не затрагивая здоровые [3]. Частным случаем данной методики является пептид-рецепторная радионуклидная терапия, в которой доставка терапевтической нагрузки (радионуклида) осуществляется с помощью пептидных векторов, способных связываться со специфическими рецепторами на поверхности раковых клеток [4].
Самым крупным классом рецепторов, сверхэкспрессирующих на поверхности раковых клеток, являются рецепторы, связанные с G-белком (GPCR). Этот класс включает более 800 рецепторов, имеющих общую структуру из семи трансмембранных спиралей, которые связаны тремя внутри- и внеклеточными петлевыми областями, внеклеточным N-концом и внутриклеточным карбоксил-концевым доменом [5]. К классу GPCR-рецепторов также относят и семейство бомбе-зиновых рецепторов [6].
Семейство бомбезиновых рецепторов задействовано в самых разнообразных физиологических реакциях, таких как рост тканей, сокращение гладких мышц, пищевое поведение, секреция желез, а также многих эффектах центральной нервной системы, включая регуляцию циркадного ритма [7, 8].
Однако рецепторы бомбезина могут играть важную роль и в развитии онкопатологии [9]. Сверхэкспрессия рецепторов бомбе-зина обнаруживается при таких заболеваниях, как рак молочной железы, рак предстательной железы, рак толстой кишки, рак легких, нейробластомы и др. [10–13]. Рецепторы бомбезина при их сверхэкспрессии оказывают аутокринное действие на рост опухолевой ткани, а также стимулируют ангиогенез [14, 15].
Особенностью, объединяющей семейство рецепторов бомбезина, является их способность взаимодействовать с пептидом под названием бомбезин [16]. Бомбезин был выделен из кожи лягушки Bombina bombina в 1971 г. В. Эрспамером и его коллегами и представляет собой амидированный тетрадекапептид [17]. Именно пептид бомбезин стал основой перспективных пептидных препаратов, использующихся для лечения опухолей, клетки которых экспрессируют рецепторы бомбезина [6].
Перспективность пептидных препаратов обусловлена преимуществами, которыми обладают пептиды. К таковым относят отсутствие иммуногенности, относительно простой и бюджетный синтез, а также относительно простая модификация [18]. Однако пептиды обладают серьезным ограничением – низкая стабильность как in vitro , так и in vivo , особенно пептиды подвержены деградации под действием протеаз крови [19].
Решить проблему стабильности пытаются различными способами: применяя ненатуральные аминокислоты, циклизацию, конъюгацию с различными биополимерами [20]. Одним из перспективных направлений повышения стабильности пептидов стало включение терапевтического пептида в каркас более стабильной пептидной молекулы [21].
Мы разработали новую синтетическую пептидную конструкцию на основе высокостабильного пептида кноттина U5-scytotoxin-Sth1a (UniProt: U51A_SCYTH), выделенного из яда паука Scytodes thoracica , в структуру которого был встроен короткий пептид бомбе-зин (BBN), полученный из кожи лягушки Bombina bombina . Пептид бомбезин был встроен между первым и вторым цистеиновым остатком, что дало структуре название BBN/C1-C2.
Цель исследования . Изучить стабильность структуры BBN/C1-C2, созданной на основе кноттина U5-scytotoxin-Sth1a и пептида бомбезина, тропного бомбезиновыму рецептору, и ее способность связываться с целевыми рецепторами на поверхности раковых клеток.
Материалы и методы . Синтез BBN/C1-C2 осуществляли на пептидном синтезаторе ResPep SL (Intavis, Германия) твердофазным методом с использованием Fmoc-защищенных аминокислот (Intavis, Германия) [22].
В качестве специфического ингибитора использовали тропный бомбезиновому рецептору пептид GRP, синтез которого проводился также твердофазным методом [23].
Контроль результатов синтеза осуществлялся методом обращенно-фазовой хроматографии с использованием системы высокоэффективной жидкостной хроматографии Shimadzu LC-20AD (Shimadzu, Япония) с применением колонки Dr. Maisch Luna C18(2) по стандартному протоколу градиентного элюирования [24]. По протоколу элюирование осуществлялось парой вода (А) и ацетонитрил (Б), где профиль градиента был: 5 минут 95 % А и 5 % Б, затем в течении 40 мин концентрация элюента А увеличивалась с 5 % до 100 %, в конце анализа происходила регенерация колонки 100 % Б в течение 5 мин. Скорость потока составляла 1 мл/мин, детектирование осуществлялось на длине волны 215 нм.
Также для контроля синтеза использовался масс-спектрометрический анализ с применением комплекса MALDI-TOF MS серии FLEX (Bruker Daltonics, Германия).
По результатам синтеза проводилась очистка пептидов методом обращенно-фазовой хроматографии с использованием системы AutoPure25-M604 (Inscinstech) и колонки Galaksil EF-C18H (Galak) по стандартному протоколу градиентного элюирования парой «вода-ацетонитрил» [24]. По протоколу элюирование осуществлялось парой вода (А) и ацетонитрил (Б), где профиль градиента был: 20 мин 95 % А и 5 % Б, затем в течении 80 мин концентрация элюента А увеличивалась с 5 % до 100 %, в конце анализа происходила регенерация колонки 100 % Б в течении 40 мин. Скорость потока составляла 5 мл/мин, детектирование осуществлялось на длине волны 215 нм.
Фолдинг пептида проводили в буфере, содержащем 10 мМ восстановленного глутатиона и 1 мМ окисленного глутатиона в 0,1 М трис-HCl, pH 8,0, при 4 °С при осторожном покачивании в течение 24 ч [25].
В качестве флуоресцентной метки для BBN/C1-C2 использовали FAM(6)-NHS («Лю-мипроб», Россия), мечение проводили по стандартному протоколу производителя [26].
Стабильность исследуемого пептида BBN/C1-C2 сравнивали с коммерческим препаратом PSMA-617. PSMA-617 является наи- более современным и перспективным пептидным препаратом, одобренным для таргетной радионуклидной терапии рака предстательной железы, что и обусловило выбор данного препарата для сравнения [27].
Анализ стабильности пептида BBN/C1-C2 и PSMA-617 проводили в физиологическом растворе при 4 °С в течение 96 ч с использованием хроматографической системы Shimadzu LC-20AD XR по принципу обращенно-фазовой хроматографии. Данные обрабатывали в программе Clarity (Clarity Software, Великобритания).
Для анализа прикрепления и интернализации использовали две клеточные культуры: PC-3, экспрессирующую на поверхности бом-безиновый рецептор, и CHO-K1, не экспрессирующую бомбезиновый рецептор [28].
Клетки высеивали в 24-луночные планшеты в концентрации 100 000 на лунку в 1 мл среды. Через 24 ч при достижении экспоненциальной стадии роста вместе со свежей питательной средой добавляли BBN/C1-C2 в 1-, 10-, 100-кратном избытке по массе к GRP и культуру инкубировали 30 мин при 37 °С и 5 % CO2 для ингибирования рецептора бомбе-зина. Затем к культуре добавляли 1 мл среды с GRP и культуру инкубировали 3 ч при 37 °С и 5 % CO2. Через 3 ч среду собирали, а клетки трижды промывали холодным фосфатным буфером для удаления несвязавшихся молекул, добавляли 1 мл глицинового буфера (50 мМ в HCl, pH 2,8) и инкубировали в течение 5 мин. Буфер собирали, ячейки промывали холодным фосфатным буфером. Клетки лизировали в 1 мл 0,3 М NaOH в течение 20 мин и собирали лизат [25]. После этого среду убирали, ячейки промывали холодным фосфатным буфером и делали съемку клеток с использованием оптической системы, включающей микроскоп Nikon Ti-S (Nikon, Япония), камеру DS-Qi1MC, объектив Nikon S Plan Fluor ELWD 20×0.45, соответствующие фильтры и ПК с пакетом NIS-elements 4.0. Количественный анализ изображений выполняли с использованием программного обеспечения Image J. Интенсивность флуоресценции вычисляли по формуле: общая флуоресценция клеток = ин- тегрированная плотность – (площадь выделенной ячейки × средняя флуоресценция фоновых показателей). В качестве контроля фиксировали сигнал флуоресценции без добавления пептидов [29].
Каждый эксперимент проводили в 3 повторах, данные представляли в виде M±SD. Статистическую обработку осуществляли в программе Excel с использованием критерия
Стьюдента, отличия считали достоверными при p<0,05.
Результаты и обсуждение. В результате синтеза и хроматографической очистки был получен пептид BBN/C1-C2 с химической чистотой более 90 % (рис. 1А). Также был проведен синтез и хроматографическая очистка пептида GRP, выбранного в качестве специфического ингибитора бомбезинового рецептора (рис. 1Б).
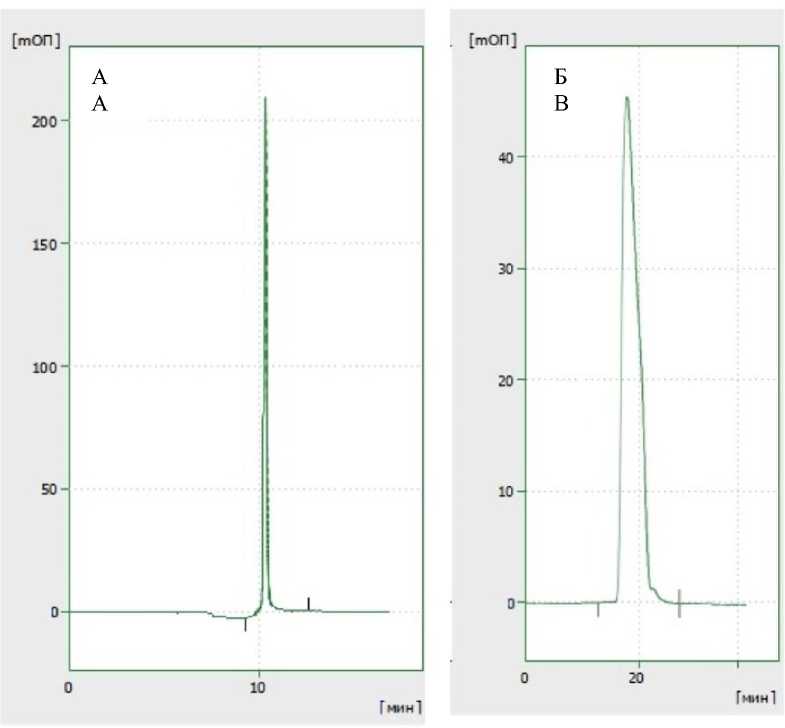
Рис. 1. Хроматограмма пептида BBN/C1-C2 (А) и GRP (Б)
Fig. 1. Chromatogram of BBN/C1-C2 (A) peptide and GRP (B)
В качестве основы для синтетического пептида нами был взят пептид бомбезин, показывающий способность связываться с рецепторами семейства бомбезина, которые экспрессируются на поверхности клеток человека [6]. Такая особенность дает возможность использовать данный пептид как препарат для пептид-рецепторной радионуклидной терапии опухолей, клетки которых сверхэкспрес-сируют рецепторы бомбезина. Однако использование нативного бомбезина ограничивает упомянутая ранее низкая стабильность пептидов in vivo [30]. Работы, ведущиеся в этом направлении, нацелены на модификацию нативной последовательности пептида с сохранением его основного свойства [31].
Нами же был использован иной подход к повышению стабильности пептида бомбе-зина, а именно молекулярная имплантация терапевтического пептида в структуру другого, более стабильного пептида [21]. В качестве такого каркаса был использован пептид кноттин U5-scytotoxin-Sth1a (UniProt: U51A_SCYTH), выделенный из яда паука-птицееда, не проявляющего токсичность в отношении млекопитающих [32].
Кноттины представляют собой особый класс пептидов, особенностью которых является наличие цистиновых (дисульфидных) связей, образующих узловую структуру. Именно это придает кноттинам высокую стабильность в широком диапазоне pH, температур и иных внешних факторов [32]. Различные работы показывают перспективность применения кноттинов в качестве каркаса для терапевтических пептидов. В одном из последних исследований Лей Цзян и соав. разработали и синтезировали гибридный пептид на основе агути-родственного пептида, встроенного в каркас кноттина, – ингибитор трипсина Ecballium elaterium (EETI-II). Разработанный пептид показал высокую аффинность к рецепторам интегрина и высокоспецифичное поглощение целевой опухолью [33].
Пептид бомбезин был встроен между первым и вторым остатком цистеина, что дало получившейся гибридной молекуле название BBN/C1-C2.
Сравнение BBN/C1-C2 и коммерческого препарата PSMA-617 в среде физиологического раствора при температуре 4°С показало, что синтезированный нами пептид BBN/C1-C2 обладает более высокой стабильностью. Так, BBN/C1-C2 и PSMA-617 в течении первых 24 ч сохраняют высокую стабильность, химическая чистота молекул меняется незначительно: химическая чистота PSMA-617 снижается на 5,7 %, тогда как чистота BBN/C1-C2 снижается всего на 0,7 %. Через 96 ч химическая чистота PSMA-617 снижается с 99,7 % до 79,4 %, в то время как чистота BBN/C1-C2 снижается с 96 % до 93,2 % (рис. 2).
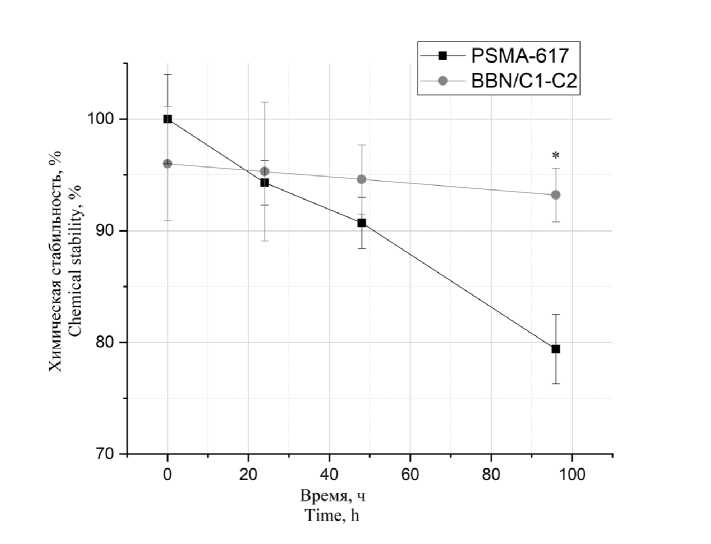
Рис. 2. Стабильность пептидов PSMA-617 и BBN/C1-C2 в физиологическом растворе при температуре +4 °С в течении 96 ч (* – достоверное отличие от PSMA-617)
Fig. 2. Stability of PSMA-617 and BBN/C1-C2 peptides in physiological solution, +4°C, 96 hours (* – the difference is significant compared with PSMA-617)
Было проведено исследование конкурентного ингибирования на клеточной культуре, экспрессирующей бомбезиновый рецептор, при совместной инкубации GRP и BBN/C1-C2.
Пептид GRP является аналогом пептида бомбезина, экспрессируется клетками млекопитающих и способен связываться с рецептором GRP, который является членом семейства бомбезиновых рецепторов [34]. Особенностью рецепторов бомбезина также является их минимальная экспрессия на поверхности здоровых клеток млекопитающих (за исключением некоторых органов, например поджелудочной железы) при сверхэкспрессии клетками многих типов рака [35–37].
Для проведения исследования пептиды были помечены флуоресцентной меткой 6-FAM, концентрация BBN/C1-C2 превышала концентрацию GRP в 1, 10 и 100 раз. Результаты исследования показали отсутствие различий GRP и BBN/C1-C2 в соотношении 1:1 в течении 3 ч (рис. 3). При 10-кратном избытке BBN/C1-C2 наблюдалось достоверное снижение сигнала GRP на 30 %. При 100-кратном избытке BBN/C1-C2 не наблюдалось дозозависимого снижения сигнала GRP. Также исследование показало, что избыток BBN/C1-C2 не влияет на интернализацию GRP (рис. 4).
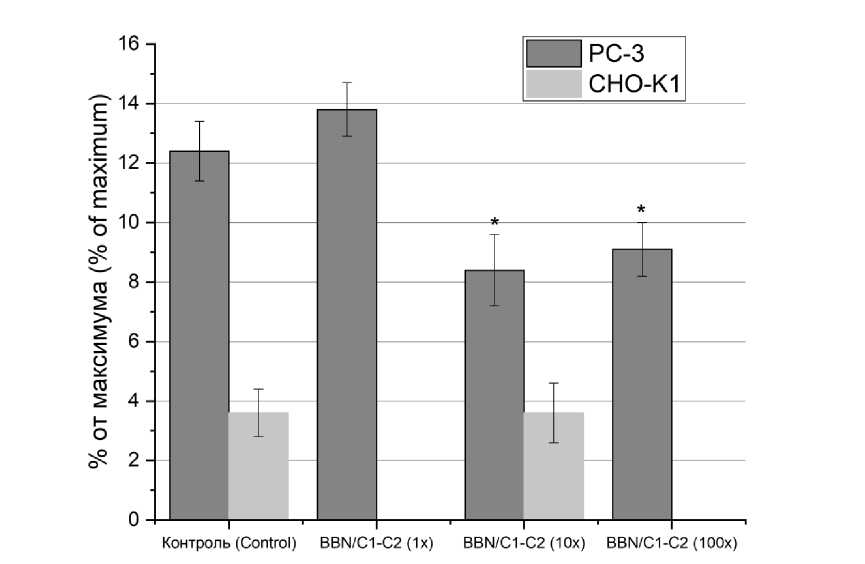
Рис. 3. Доля прикрепленного к мембране GRP при избытке BBN/C1-C2 (* – отличие от контроля)
Fig. 3. Proportion of GRP attached to the membrane with excess BBN/C1-C2 (* – the difference is significant compared with the control)
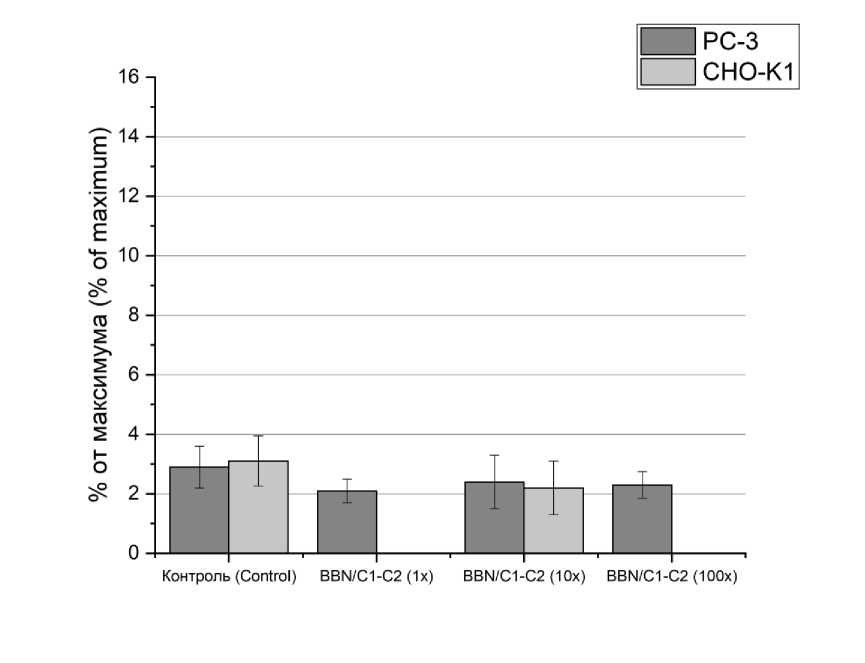
Рис. 4. Доля интернализованного в клетки GRP при избытке BBN/C1-C2 (* – отличие от контроля)
Fig. 4. Proportion of GRP internalized into cells with excess BBN/C1-C2 (* – the difference is significant compared with the control)
Проведенное исследование показало, что прикрепление и интернализация пептидов GRP и BBN/C1-C2 к клеткам культуры CHO-K1 не превышает значения статистической погрешности (рис. 3 и 4).
Заключение. Таким образом, структура, созданная на основе токсина U5-scytotoxin-
Sth1a с помещенным в положение С1-С2 коротким пептидом, тропным к рецептору бом-безина, сохраняет повышенную стабильность без потери способности связываться с целевым рецептором на поверхности клеток и не затрагивает клетки, не экспрессирующие целевой рецептор.
Данное исследование было профинансировано Министерством науки и высшего образования Российской Федерации, грант № 123020700216-4 (FEUF-2023-0004).
Список литературы Исследование предшественника препарата, нацеленного на рецептор бомбезина, для пептид-рецепторной радионуклидной терапии
- Sung H., Ferlay J., Siegel R.L. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71 (3): 209-249.
- Saini K.S., Twelves C. Determining lines of therapy in patients with solid cancers: a proposed new systematic and comprehensive framework. Br J Cancer. 2021; 125 (2): 155-163.
- Choi H.Y., Chang J.E. Targeted Therapy for Cancers: From Ongoing Clinical Trials to FDA-Approved Drugs. Int J Mol Sci. 2023; 24 (17): 13618.
- MerolaE., Grana C.M. Peptide Receptor Radionuclide Therapy (PRRT): Innovations and Improvements. Cancers (Basel). 2023; 15 (11): 2975.
- Sriram K., Insel P.A. G Protein-Coupled Receptors as Targets for Approved Drugs: How Many Targets and How Many Drugs? Mol Pharmacol. 2018; 93 (4): 251-258.
- Jensen R.T., Battey J.F., Spindel E.R., Benya R. V. International Union of Pharmacology. LXVIII. Mammalian bombesin receptors: nomenclature, distribution, pharmacology, signaling, and functions in normal and disease states. Pharmacol Rev. 2008; 60 (1): 1-42.
- Moody T.W., Merali Z. Bombesin-like peptides and associated receptors within the brain: distribution and behavioral implications. Peptides. 2004; 25 (3): 511-520.
- Ramos-Alvarez I., Moreno P., Mantey S.A. Insights into bombesin receptors and ligands: Highlighting recent advances. Peptides. 2015; 72: 128-144.
- Gonzalez N., Moody T.W., Igarashi H., Ito T., Jensen R. T. Bombesin-related peptides and their receptors: recent advances in their role in physiology and disease states. Curr Opin Endocrinol Diabetes Obes. 2008; 15 (1): 58-64.
- Liolios C., Buchmuller B., Bauder-Wust U. Monomelic and Dimeric 68Ga-Labeled Bombesin Analogues for Positron Emission Tomography (PET) Imaging of Tumors Expressing Gastrin-Releasing Peptide Receptors (GRPrs). J Med Chem. 2018; 61 (5): 2062-2074.
- EngelJ.B., Keller G., SchallyA.V., HalmosG., HammannB., NagyA. Effective inhibition of experimental human ovarian cancers with a targeted cytotoxic bombesin analogue AN-215. Clin Cancer Res. 2005; 11 (6): 2408-2415.
- Judmann B., Braun D., Wangler B., Schirrmacher R., Fricker G., Wangler C. Current State of Radiolabeled Heterobivalent Peptidic Ligands in Tumor Imaging and Therapy. Pharmaceuticals (Basel). 2020; 13 (8): 173.
- Faviana P., Boldrini L., Erba P.A. Gastrin-Releasing Peptide Receptor in Low Grade Prostate Cancer: Can It Be a Better Predictor Than Prostate-Specific Membrane Antigen? Front Oncol. 2021; 11: 650249.
- Patel O., Shulkes A., Baldwin G.S. Gastrin-releasing peptide and cancer. Biochim Biophys Acta. 2006; 1766 (1): 23-41.
- Kanashiro C.A., Schally A. V., Nagy A., Halmos G. Inhibition of experimental U-118MG glioblastoma by targeted cytotoxic analogs of bombesin and somatostatin is associated with a suppression of angiogenic and antiapoptotic mechanisms. Int J Oncol. 2005; 27 (1): 169-174.
- Moody T.W., Lee L., Ramos-Alvarez I., Iordanskaia T., Mantey S.A., Jensen R.T. Bombesin Receptor Family Activation and CNS/Neural Tumors: Review of Evidence Supporting Possible Role for Novel Targeted Therapy. Front Endocrinol (Lausanne). 2021; 1 (12): 728088.
- Lin Y., Chen T., Zhou M., Wang L., Su S., Shaw C. Ranatensin-HL: A Bombesin-Related Tridecapeptide from the Skin Secretion of the Broad-Folded Frog, Hylarana latouchii. Molecules. 2017; 22 (7): 1110.
- Vadevoo S.M.P., Gurung S., Lee H.S. Peptides as multifunctional players in cancer therapy. Exp Mol Med. 2023; 55 (6): 1099-1109.
- Pernot M., Vanderesse R., Frochot C., Guillemin F., Barberi-Heyob M. Stability of peptides and therapeutic success in cancer. Expert Opin Drug Metab Toxicol. 2011; 7 (7): 793-802.
- Erak M., Bellmann-Sickert K., Els-Heindl S., Beck-Sickinger A.G. Peptide chemistry toolbox - Transforming natural peptides into peptide therapeutics. Bioorg Med Chem. 2018; 26 (10): 2759-2765.
- Attah F.A., LawalB.A., YusufA.B. Nutritional and Pharmaceutical Applications of Under-Explored Knottin Peptide-Rich Phytomedicines. Plants (Basel). 2022; 11 (23): 3271.
- Coin I., Beyermann M., Bienert M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nature Protocols, 2007; 2 (12): 3247-3256.
- Zhang H., Qi L., Cai Y., Gao X. Gastrin-releasing peptide receptor (GRPR) as a novel biomarker and therapeutic target in prostate cancer. Ann Med. 2024; 56 (1): 2320301.
- Mant C.T., Chen Y., Yan Z., Popa T.V., Kovacs J.M., Mills J.B., Tripet B.P., Hodges R.S. HPLC analysis and purification of peptides. Methods Mol Biol. 2007; 386: 3-55.
- Moore S.J., Leung C.L., Norton H.K., Cochran J.R. Engineering agatoxin, a cystine-knot peptide from spider venom, as a molecular probe for in vivo tumor imaging. PLoS One. 2013; 8 (4): 60498.
- Lumiprobe.com. URL: https://ru.lumiprobe.com/protocols/nhs-ester-labeling (дата обращения: 11.02.2024).
- Bradley C.A. [177Lu]PSMA-617 radionuclide therapy shows promise. Nat Rev Urol. 2018; 15 (8): 468.
- Ferguson S., Wuest M., Richter S., Bergman C., Dufour J., Krys D., Simone J., Jans H.S., Riauka T., Wuest F. A comparative PET imaging study of 44gSc- and 68Ga-labeled bombesin antagonist BBN2 derivatives in breast and prostate cancer models. Nucl Med Biol. 2020: 90-91: 74-83.
- D'Huyvetter M., Xavier C., Caveliers V., Lahoutte T., Muyldermans S., DevoogdtN. Radiolabeled nano-bodies as theranostic tools in targeted radionuclide therapy of cancer. Expert Opin Drug Deliv. 2014; 11 (12): 1939-1954.
- Pernot M., Vanderesse R., Frochot C., Guillemin F., Barberi-Heyob M. Stability of peptides and therapeutic success in cancer. Expert Opin Drug Metab Toxicol. 2011; 7 (7): 793-802.
- Li X., Cai H., Wu X., Li L., Wu H., Tian R. New Frontiers in Molecular Imaging Using Peptide-Based Radiopharmaceuticals for Prostate Cancer. Front Chem. 2020; 1 (8): 583309.
- Ariki N.K., Muñoz L.E., Armitage E.L., Goodstein F.R., George K.G., Smith V.L., Vetter I., Herzig V., King G.F., Loening N.M. Characterization of Three Venom Peptides from the Spitting Spider Scytodes thoracica. PLoS One. 2016; 11 (5): 0156291.
- Jiang L., Kimura R.H., Miao Z. Evaluation of a (64)Cu-labeled cystine-knot peptide based on agouti-related protein for PET of tumors expressing alphavbeta3 integrin. J Nucl Med. 2010; 51 (2): 251-258.
- Ischia J., Patel O., Bolton D., Shulkes A., Baldwin G.S. Expression and function of gastrin-releasing peptide (GRP) in normal and cancerous urological tissues. BJU Int. 2014; 113 (2): 40-47.
- Chave H.S., Gough A.C., Palmer K., Preston S.R., Primrose J.N. Bombesin family receptor and ligand gene expression in human colorectal cancer and normal mucosa. Br J Cancer. 2000; 82 (1): 124-130.
- Pooja D., Gunukula A., Gupta N., Adams D.J., Kulhari H. Bombesin receptors as potential targets for anticancer drug delivery and imaging. Int J Biochem Cell Biol. 2019; 114: 105567.
- Rurarz B.P., UrbanekK.A., Karczmarczyk U., Raczkowska J., Habrowska-Górczynska D.E., KozieiM.J., Kowalska K., Kadiubowski S., Sawicka A., Maurin M., Piastowska-Ciesielska A.W., Ulanski P. Towards Cancer Nanoradiopharmaceuticals-Radioisotope Nanocarrier System for Prostate Cancer Theranostics Based on Radiation-Synthesized Polymer Nanogels. Cancers (Basel). 2023; 15 (23): 5646.


