Исследование предшественника радиофармпрепарата, нацеленного на простат-специфический мембранный антиген
Автор: Белобородов Е.А., Юрова Е.В., Сугак Д.Е., Расторгуева Е.В., Фомин А.Н., Саенко Ю.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
Рак предстательной железы одно из наиболее часто диагностируемых онкологических заболеваний во всем мире. Одной из стратегий лечения является таргетная терапия с использованием коротких пептидов, нацеленных на простат-специфический мембранный антиген (ПСМА). Однако короткие пептиды обладают рядом недостатков, к которым относится низкая стабильность in vivo. Решить данную проблему можно с использованием токсинов с ингибиторным цистиновым узлом, в структуру которого встраивается короткий пептид. Цель исследования. Изучить стабильность и способность пептида PSMA/C1-C2, созданного на основе кноттина U5-scytotoxin-Sth1a и короткого пептида, тропного к ПСМА, связываться с рецепторами на поверхности клеток рака предстательной железы в сравнении с коммерческим препаратом PSMA I&T и специфическим ингибитором ПСМА.
Простатспецифический мембранный антиген, таргетная терапия, пептид, кноттин
Короткий адрес: https://sciup.org/14129933
IDR: 14129933 | УДК: 615.849 | DOI: 10.34014/2227-1848-2024-1-162-171
Текст научной статьи Исследование предшественника радиофармпрепарата, нацеленного на простат-специфический мембранный антиген
Введение. Рак предстательной железы является одним из наиболее часто диагностируемых онкологических заболеваний во всем мире. Существует несколько основных методов лечения данного заболевания. При первом появлении используются лучевые и хирургические процедуры. Несмотря на значительное увеличение продолжительности жизни после первой хирургической или лучевой терапии, болезнь рецидивирует более чем у 30 % пациентов [1]. Андрогенная депривация чаще всего является альтернативной стратегией лечения рака предстательной железы, поскольку для прогрессирования опухоли необходимы мужские гормоны. Однако, несмотря на отличный первоначальный ответ, у большинства пациентов в течение 2–3 лет возникает рецидив [2]. Химиотерапевтические препараты, такие как доцетаксел, доксорубицин, обеспечивают несколько месяцев выживаемости без прогрессирования, но с высокотоксичными эффектами [3, 4].
Для преодоления ограничений современных методов лечения необходимо разработать такую стратегию лечения, которая позволит избирательно воздействовать на раковые клетки и избегать неблагоприятного влияния на нормальные ткани. Одной из таких стратегий является таргетная терапия с использованием коротких пептидов, нацеленных на специфические рецепторы. Подобные пептиды, меченные радиоизотопами, способны избирательно прикрепляться к рецепторам на поверхности раковых клеток, в т.ч. простат-специфи-ческому мембранному антигену (ПСМА), который в значительной степени экспрессируется на поверхности клеток рака простаты, тем самым оказывая терапевтическое воздействие. К основным преимуществам такого подхода относятся высокая специфичность и сниженная токсичность [5]. Однако здесь также имеется ряд нюансов, в частности низкая стабильность терапевтической молекулы in vivo, что, соответственно, снижает биодоступность [6]. Решить данную проблему можно с использованием пептидов с ингибиторным цистиновым узлом. К данной группе в первую очередь относятся токсины членистоногих, обладающие природной термической и протеолитической стабильностью [7].
В нашей работе мы использовали токсин U5-scytotoxin-Sth1a (UniProt: U51A_SCYTH) паука Scytodes thoracica в качестве стабилизующей молекулы для короткого пептида, тропного к простат-специфическому мембранному антигену. На этой основе был создан пептид PSMA/C1-C2, поскольку короткий пептид помещался между первым и вторым остатками цистеина.
Цель исследования. Изучить стабильность и способность пептида PSMA/C1-C2, созданного на основе кноттина U5-scytotoxin-Sth1a и короткого пептида, тропного к про-стат-специфическому мембранному антигену, связываться с рецепторами на поверхности клеток рака предстательной железы в сравнении с коммерческим препаратом PSMA I&T и специфическим ингибитором.
Материалы и методы.
Синтез PSMA/C1-C2 осуществляли на пептидном синтезаторе ResPep SL (Intavis, Германия) с использованием Fmoc-защищенных аминокислот (Intavis, Германия). Очистку пептида проводили с использованием хроматографической системы NGC Quest™ 10 (Bio-
Rad, США) и сорбента Bio-Gel P-4 на колонке Econo-Column 1×30 cm (Bio-Rad, США). Контроль качества осуществляли с помощью хроматографа Shimadzu LC-20AD XR (Shimadzu, Япония), оснащенного спектрофотометрическим детектором SPD-20A, по принципу обращенно-фазовой хроматографии. Анализ радиохимической чистоты производили на хроматографе Shimadzu (Shimadzu, Япония) с детектором GABI (Elysia-Raytest, Германия). Масс-спектрометрический анализ проводили на основе масс-спектрометрии MALDI-TOF на MALDI-TOF MS серии FLEX (Bruker Daltonics, Германия). Фолдинг пептида проводили в буфере, содержащем 10 мМ восстановленного глутатиона и 1 мМ окисленного глутатиона в 0,1 М трис-HCl, pH 8,0, при 4 °С при осторожном покачивании в течение 24 ч [8].
В качестве питательной среды для клеточных культур применяли RPMI-1640 с добавлением 10 % фетальной бычьей сыворотки (Biosera, Франция), витаминов для RPMI-1640, пирувата натрия и пенициллина/стрептомицина. Все компоненты – от «Панэко» (Россия), если не указано иное. Клеточные культуры инкубировали в CO 2 -инкубаторе (Sanyo, Япония) при 37 °С и 5 % CO 2 .
Для анализа прикрепления и интернализации использовали две клеточные культуры: 22Rv1, экспрессирующую на поверхности ПСМА рецепторы, и PC-3, не экспрессирующую ПСМА [10, 11].
Клетки высеивали в 24-луночные планшеты в концентрации 100 000 на лунку в 1 мл среды. Через 24 ч при достижении экспоненциальной стадии роста вместе со свежей питательной средой добавляли PSMA/C1-C2 в 1-, 10-, 100-кратном избытке по массе к PSMA I&T и культуру инкубировали 30 мин при 37 °С и 5 % CO 2 для ингибирования ПСМА. Затем к культуре добавляли 1 мл среды с Lu-PSMA I&T с активностью 2МБк и культуру инкубировали 3 ч при 37 °С и 5 % CO 2 . Через 3 ч среду собирали, а клетки трижды промывали холодным фосфатным буфером для удаления несвязавшихся молекул, добавляли 1 мл глицинового буфера (50 мМ в HCl, pH 2,8) и инкубировали в течение 5 мин. Буфер собирали, ячейки промывали холодным фосфатным буфером. Наконец, клетки лизировали в 1 мл 0,3 М NaOH в течение 20 мин и собирали лизат [12]. После этого активность в среде, глициновом буфере и клеточном лизате измеряли с использованием гамма-счетчика ISOMED 2010 (PTW, Германия).
Для анализа конкурентного ингибирования использовали 2-PMPA. Клетки высеивали в 24-луночный планшет в концентрации 100 000 на лунку и оставляли на 24 ч. После этого к культуре добавляли свежую среду, содержащую 500 мкМ 2-PMPA, и инкубировали 30 мин. Затем среду меняли на свежую с добавлением 1 мкМ FAM-PSMA/C1-C2 и инкубировали еще 3 ч. После этого среду убирали, ячейки промывали холодным фосфатным буфером и делали съемку клеток с использованием оптической системы, включающей микроскоп Nikon Ti-S (Nikon, Япония), камеру
DS-Qi1MC, объектив Nikon S Plan Fluor ELWD 20×0.45, соответствующие фильтры и ПК с пакетом NIS-elements 4.0. Количественный анализ изображений выполняли с использованием программного обеспечения Image J. Интенсивность флуоресценции вычисляли по формуле: общая флуоресценция клеток = интегрированная плотность – (площадь выделенной ячейки × средняя флуоресценция фоновых показателей). В качестве контроля фиксировали сигнал флуоресценции без добавления пептидов [13].
Каждый эксперимент проводили в трех повторах, данные представляли в виде M±SD. Статистическую обработку данных осуществляли в программе Excel с использованием критерия Стьюдента, отличия считали достоверными при p<0,05.
Результаты. В результате твердофазного синтеза был получен пептид PSMA/C1-C2 с чистотой более 90 % (рис. 1Б). Поскольку в основе молекулярной структуры лежит токсин, который формирует три дисульфидных мостика, то в результате фолдинга масса молекулы уменьшилась на 6 дальтон (рис. 1А).
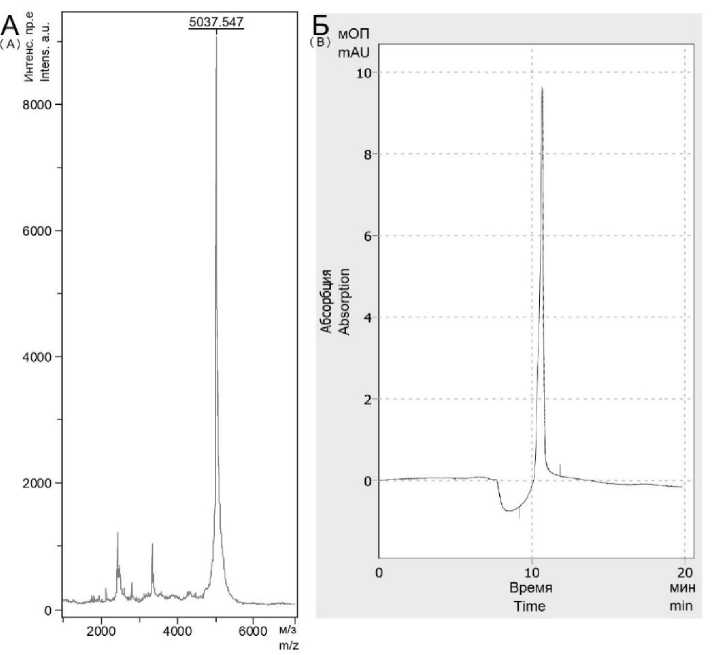
Рис. 1. Масс-спектрограмма (А) и хроматограмма (Б) пептида PSMA/C1-C2
Fig. 1. Mass spectrogram (A) and chromatogram (B) of the PSMA/C1-C2 peptide
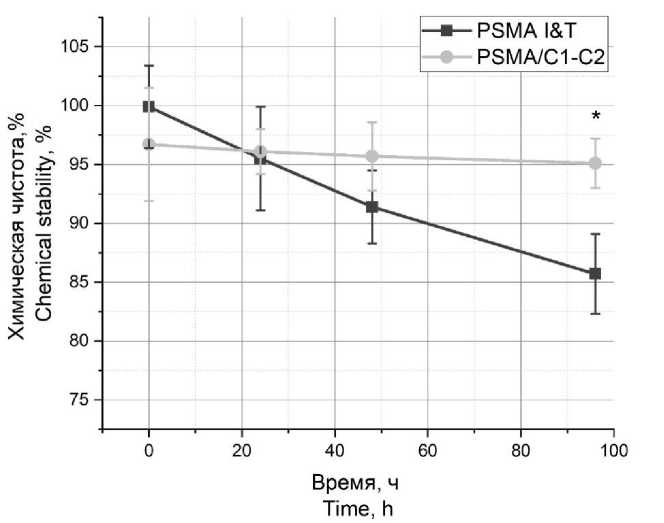
Рис. 2. Стабильность пептидов PSMA I&T и PSMA/C1-C2 в физиологическом растворе при температуре 4 °С в течение 96 ч (* – достоверное отличие от группы PSMA I&T)
Fig. 2. Stability of PSMA I&T and PSMA/C1-C2 peptides in saline solution at 4 °С for 96 hours (* – the difference is significant compared with the PSMA I&T group)
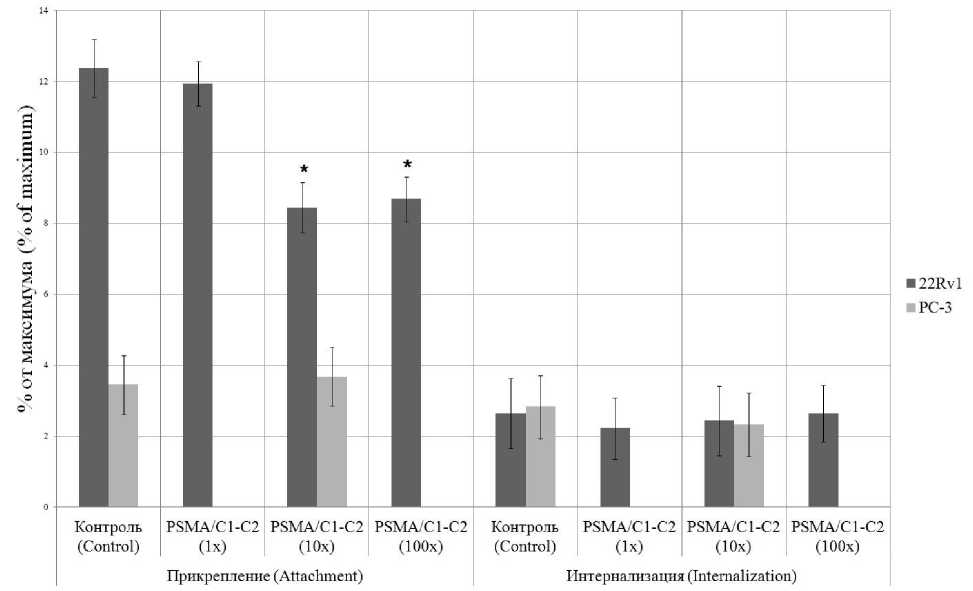
Рис. 3. Доля прикрепленного к мембранам и интернализованного в клетки PSMA I&T при избытке PSMA/C1-C2 (* – отличие от контроля)
Fig. 3. Proportion of PSMA I&T attached to membranes and internalized into cells with an excess of PSMA/C1-C2 (* – difference from control)
Аналогичным методом конкурентного ингибирования анализировалось связывание FAM-меченного PSMA/C1-C2 с рецепторами на поверхности раковых клеток 22Rv1 в присутствии в питательной среде специфического ингибитора ПСМА 2-PMPA. Видно, что пептид PSMA/C1-C2 крепится к мембране ПСМА-положительных клеток 22Rv1 (рис. 4), однако при совместной инкубации с 2-PMPA сигнал флуоресценции статистически неотличим от контроля, что говорит о конкурентном связывании PSMA/C1-C2 и 2-PMPA с ПСМА.
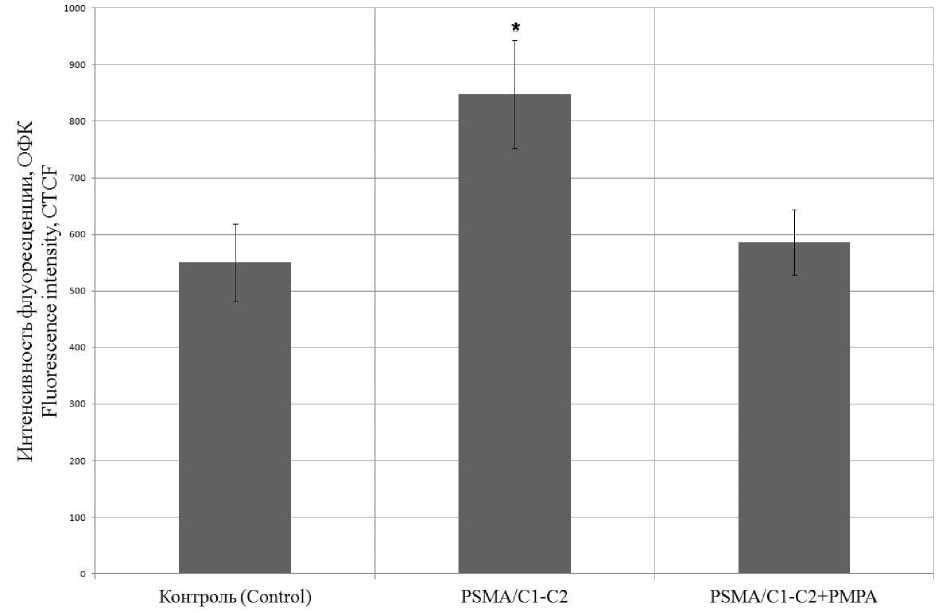
Рис. 4. Степень прикрепления PSMA/C1-C2 при наличии и отсутствии специфического ингибитора ПСМА (ОФК – общая флуоресценция клеток; * – отличие от контроля)
Fig. 4. Degree of PSMA/C1-C2 attachment with and without a specific PSMA inhibitor (CTCF – Corrected Total Cell Fluorescence; * – difference from control)
Заключение. Таким образом, структура, созданная на основе токсина U5-scytotoxin-Sth1a с помещенным в положение С1-С2 коротким пептидом, тропным к ПСМА, сохраняет повышенную стабильность без потери способности связываться с целевым рецептором на поверхности клеток и не затрагивает клетки, не экспрессирующие ПСМА.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (проект № 123020700216 (FEUF-2023-0004)).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Концепция и дизайн исследования: Белобородов Е.А., Юрова Е.В., Фомин А.Н., Саенко Ю.В.
Литературный поиск, участие в исследовании, обработка материала: Белобородов Е.А.,
Юрова Е.В., Сугак Д.Е.
Статистическая обработка данных: Расторгуева Е.В.
Анализ и интерпретация данных: Белобородов Е.А., Юрова Е.В., Саенко Ю.В.
Написание и редактирование текста: Белобородов Е.А., Юрова Е.В.
Список литературы Исследование предшественника радиофармпрепарата, нацеленного на простат-специфический мембранный антиген
- Azab S., Zakaria M., Raafat M., Seief H. The combination of urinary IL-6 and renal biometry as useful diagnostic tools to differentiate acute pyelonephritis from lower urinary tract infection. Int Braz J Urol. 2016; 42 (4): 810-816.
- Perlmutter M.A., Lepor H. Androgen deprivation therapy in the treatment of advanced prostate cancer. Rev Urol. 2007; 9 (1): 3-8.
- Rebello R.J., Oing C., Knudsen K.E., Loeb S., Johnson D.C., Reiter R.E., Gillessen S., Van der Kwast T., BristowR.G. Prostate cancer. Nat Rev Dis Primers. 2021; 7 (1): 9.
- Beer T.M., Bubalo J.S. Complications of chemotherapy for prostate cancer. Semin Urol Oncol. 2001; 19 (3): 222-230.
- Nhan N.T.T., Yamada T., Yamada K.H. Peptide-Based Agents for Cancer Treatment: Current Applications and Future Directions. Int J Mol Sci. 2023; 24 (16): 12931.
- Pernot M., Vanderesse R., Frochot C., Guillemin F., Barberi-Heyob M. Stability of peptides and therapeutic success in cancer. Expert Opinion on Drug Metabolism & Toxicology. 2011; 7 (7): 793-802.
- Kolmar H. Natural and engineered cystine knot miniproteins for diagnostic and therapeutic applications. Curr Pharm Des. 2011; 17 (38): 4329-4336.
- Moore S.J., Leung C.L., Norton H.K., Cochran J.R. Engineering agatoxin, a cystine-knot peptide from spider venom, as a molecular probe for in vivo tumor imaging. PLoS One. 2013; 8 (4): 60498.
- Lumiprobe RUS Ltd, Labeling of biomolecules with activated esters. Lumiprobe.com. URL: https://ru.lu-miprobe.com/protocols/nhs-ester-labeling (дата обращения: 12.07.2023).
- Gorges T.M., Riethdorf S., von Ahsen O., Nastat Y.P., Röck K., Boede M., Peine S., Kuske A., Schmid E., Kneip C., König F., Rudolph M., Pantel K. Heterogeneous PSMA expression on circulating tumor cells: a potential basis for stratification and monitoring of PSMA-directed therapies in prostate cancer. Onco-target. 2016; 7 (23): 34930-34941.
- Xia L., Wen L., MengX., Zhou N., Guo X., Liu T., Xu X., Wang F., Zhu H., Yang Z. Application Analysis of 124I-PPMN for Enhanced Retention in Tumors of Prostate Cancer Xenograft Mice. Int J Nanomedi-cine. 2021; 16: 7685-7695.
- Dos Santos J.C., Schäfer M., Bauder-Wüst U., Beijer B., Eder M., Leotta K., Kleist C., Meyer J.P., Dil-ling T.R., Lewis J.S., Kratochwil C., Kopka K., Haberkorn U., Mier W. Refined Chelator Spacer Moieties Ameliorate the Pharmacokinetics of PSMA-617. Front Chem. 2022; 10: 898692.
- Khokhlova A., Zolotovskii I., Pogodina E., Saenko Y., Stoliarov D., Vorsina S., Fotiadi A., Liamina D., Sokolovski S., Rafailov E. Effects of high and low level 1265 nm laser irradiation on HCT116 cancer cells. Proceedings of the SPIE. 2019; 10861.
- Hennrich U., Eder M. [68Ga]Ga-PSMA-11: The First FDA-Approved 68Ga-Radiopharmaceutical for PET Imaging of Prostate Cancer. Pharmaceuticals (Basel). 2021; 14 (8): 713.
- Hennrich U., Eder M. [177Lu]Lu-PSMA-617 (PluvictoTM): The First FDA-Approved Radiotherapeuti-cal for Treatment of Prostate Cancer. Pharmaceuticals (Basel). 2022; 15 (10): 1292.
- Karimzadeh A., HeckM., Tauber R., Knorr K., Haller B., D'Alessandria C., Weber W.A., Eiber M., Rauscher I. 177Lu-PSMA-I&T for Treatment of Metastatic Castration-Resistant Prostate Cancer: Prognostic Value of Scintigraphic and Clinical Biomarkers. J Nucl Med. 2023; 64 (3): 402-409.


