Исследование процесса L-трансформации в популяции сальмонелл методами электронной и лазерной интерференционной микроскопии
Автор: Арсенюк А.Ю., Павлова И.Б., Игнатьев П.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология, микробиология
Статья в выпуске: 6 т.48, 2013 года.
Бесплатный доступ
Существование бактерий в отсутствие клеточной стенки — весьма своеобразное и широко распространенное явление, к которому неприменимы принципы классической микробиологии. L-трансформация бактерий с образованием L-форм затрудняет обнаружение патогенов и служит причиной многочисленных ложноотрицательных заключений по результатам биопроб, так как L-формы находятся в некультивируемом состоянии. Процесс L-трансформации при воздействии абиотического (тетрациклин) и биотического (биологически активные вещества Bacillus subtilis ) факторов, а также реверсию нестабильных L-форм исследовали в популяции Salmonella enterica serovar typhimurium методами просвечивающей и сканирующей электронной (ПЭМ и СЭМ), а также лазерной модуляционной интерференционной (МИМ) микроскопии. Выявлены закономерные морфологические признаки L-форм, способных реверсировать в исходное состояние. С появлением методов оптической микроскопии, обладающих сверхразрешением, стало доступно изучение процесса L-трансформации в режиме реального времени на живых бактериях (без фиксации и окрашивания). Полученные на лазерном интерференционном микроскопе МИМ-321 (Россия) трехмерные фазовые портреты позволили не только однозначно идентифицировать L-формы бактерий, но и с высокой точностью определить их основные морфологические параметры (диаметр, периметр, высота, площадь, объем). С применением современных алгоритмов обработки этих данных внутри нестабильных L-форм зарегистрированы кольцевые структуры, идентифицированные нами как ДНК. Гетероморфизм со всеми проявлениями L-трансформации характерен для патогенных и условно патогенных бактерии (как в норме, так и при действии любых абиотических и биотических факторов), что способствует выживанию вида. Изучение биологических особенностей L-трансформации имеет важное значение для понимания процессов существования потенциальных резервуаров возбудителей в природе, а также в патогенезе рецидивов хронических заболеваний.
Медоносная пчела, паразиты, вирусы, пцр, пестициды
Короткий адрес: https://sciup.org/142133460
IDR: 142133460 | УДК: 579.6:579.842.14:57.012:57.086
Текст научной статьи Исследование процесса L-трансформации в популяции сальмонелл методами электронной и лазерной интерференционной микроскопии
Изучение теоретических аспектов биологической изменчивости патогенных микроорганизмов и их выживаемости при воздействии Е-транс-формирующих агентов до сих пор остается актуальным. Как известно, под влиянием неблагоприятных факторов популяции патогенных бактерий способны переходить в состояние гетероморфизма с различными проявлениями Е-трансформации, включая образование клеток сферопластного или протопластного типа разного размера и конфигурации, а также мелких Е-форм, лишенных клеточных стенок (1-4).
Нестабильные Е-формы представляют собой клетки, изменившие морфологические, физиологические и биохимические характеристики и утратившие типичный бактериальный характер, но сохранившие геном и при благоприятных условиях (питательный субстрат, температура, рН) способные к реверсии за счет саморегулирующейся системы, необходимой для построения новой клеточной стенки. Стабильные Е-формы — это клетки, потерявшие способность к реверсии в исходное состояние. До настоящего времени нет единого мнения об их роли в биологических процессах как в окружающей среде, так и в организме хозяина.
Целью настоящей работы было изыскание новых способов выявления
L-форм, а также объективной оценки их стабильности, поскольку до недавнего времени реверсия оставалась основным критерием при идентификации нестабильных L-форм.
Методика . В качестве модельного объекта использовали Salmonella enterica serovar typhimurium (штамм 1951 из коллекции музея Всероссийского НИИ ветеринарной санитарии, гигиены и экологии).
Для изучения ультраструктуры сальмонелл препараты фиксировали 4 % глутаровым альдегидом в фосфатном буфере (рН 6,9-7,0), образцы обезвоживали и заливали в эпоксидные смолы. Ультратонкие срезы контрастировали уранилацетатом и изучали с использованием просвечивающего электронного микроскопа (ПЭМ) со сканирующей приставкой Hitachi-800 (Япония).
При исследовании популяций в колониях и микроколониях с сохранением естественной архитектоники был использован метод, основанный на способности биологически активных веществ (БАВ), продуцируемых Bacillus subtilis , диффундировать через поры мембранных фильтров в плотную питательную среду. Культуру бактерий-антагонистов В. subtilis (ТНП-3, получен из коллекции музея Якутского НИИ сельского хозяйства) (50 мкл, плотность суспензии 109 кл/мл) наносили в виде капли в центр мембранного фильтра Владипор (ООО «Владипор», Россия) с диаметром пор 0,22 мкм, помещенного на поверхность плотной питательной среды МПА, и культивировали при 37 ° C. Через 48 ч выявлялся обильный рост колоний. Такие фильтры удаляли и вместо них помещали новые, на поверхность которых наносили взвесь исследуемых сальмонелл (105 кл/мл). Контролем служили варианты, в которых сальмонеллы росли без воздействия БАВ В . subtilis . Для установления стабильности L-форм и выявления процесса реверсии клеток в исходную форму часть фильтров с отсутствием видимого роста бактерий помещали для подращивания на поверхность свежей питательной среды (МПА) и культивировали в течение 5 сут при 37 ° C. Выросшие на поверхности мембранных фильтров колонии фиксировали парами 25 % глутарового альдегида, 2-кратно обезвоживали парами пропи-леноксида, монтировали на медные подложки и напыляли золотом на установке Hitachi-E-102 (Япония). Морфологию популяций сальмонелл исследовали на электронном микроскопе Hitachi-800 со сканирующей приставкой Hitachi-8010 (Япония) при ускоряющем напряжении 75 кВ и инструментальном увеличении от х1 до х30 000.
Для сравнения морфологии выявленных стабильных и нестабильных L-форм бактерий использовали модуляционный интерференционный микроскоп (МИМ, модель МИМ-321) производства ООО «Лаборатории АМФОРА» (Россия). Препараты готовили следующим образом: на зеркальную подложку, предварительно покрытую тонким слоем парафина, наносили 10 мкл культуры сальмонелл (105 кл/мл), которую, как при приготовлении мазка крови, с помощью специального стекла равномерно тонким слоем распределяли по поверхности. Для исследования процесса L-трансформации на поверхность бактерий помещали каплю глицерина с растворенным в нем тетрациклином (25 мкг).
Данные обрабатывали статистически с использованием програм-мых пакетов MIM-Visualizer производства ООО «Лаборатории АМФОРА» (Россия) и Microcal ORIGN
Результаты. Ульраструктурный анализ (ПЭМ) выявил у сальмонелл характерное для грамотрицательных бактерий строение клеточной стенки. Она состояла из наружного липопротеидного и внутреннего муко-пептидного (пептидогиликан) слоя в виде одноконтурной структуры, оп-56
ределяющей ригидность клеточной стенки. За ней располагался жизненно важный органоид — цитоплазматическая мембрана, представленная характерной трехслойной липопротеидной структурой (мембрана Робертсона). Основной генетический компонент бактерии — молекула ДНК (нуклеоид, не имеющий оболочки) была свободно распределена среди рибосом и полирибосом цитоплазмы (5).
В то время как ультраструктурный анализ (ПЭМ) позволяет выявлять только статическое состояние органоидов, МИМ дает возможность без трудоемкой предварительной пробоподготовки изучать в режиме реального времени нативную структуру бактериальной клетки и естественное состояние ее органоидов.
Принцип действия использованного нами микроскопа МИМ основан на измерении разности фаз Аф при прохождении лазерного излучения через микрообъект (6, 7). На рисунке 1 (цветная вклейка после стр. 56) схематично показано возникновение локальных задержек фазы в случае модельного объекта — эритроцита человека. Для нахождения искомой функции Аф объект освещают плоским волновым фронтом. При прохождении через объект фронт приобретает локальные задержки фазы, которые зависят от плотности и геометрии объекта. Для определения величины задержки используется интерферометр, в котором световая волна, прошедшая через объект, складывается с плоской опорной волной. Возникающая таким образом интерференционная картина позволяет вычислить искомую задержку фазы Аф .
Трехмерное представление функции Аф ( x, у, z ) называется фазовым портретом, который относят к классу функциональных изображений, где информация представлена в виде распределения количественного параметра — разности фаз Аф ( x, у ) световой волны, связанной с оптической плотностью исследуемого микрообъекта. Для простоты восприятия и интерпретации фазовых портретов разность фаз, измеряемая в градусах, может быть выражена в нанометрах. Для визуализации внутренних структур клетки использовался метод градиентной фильтрации изображения, который позволяет визуализировать области с максимальной крутизной рельефа. У МИМ-321 разрешение превосходит таковое у классических оптических микроскопов и достигает от 150 до 15 нм в зависимости от оптических свойств измеряемого объекта и техники исследования.
На изображениях сальмонелл в контроле, полученных методами ПЭМ (рис. 2, А, см. цветную вклейку после стр. 56) и МИМ (см. рис. 2, Б), видна многослойная клеточная стенка, цитоплазма и нуклеоид. Разница в размерах сальмонелл была обусловлена неодинаковыми способами пробоподготовки: для изучения ультраструктуры проводили фиксацию, обезвоживание и заливку в эпоксидные смолы, что уменьшает объем и размеры структурных элементов бактериальной клетки, в то время как прижизненное исследование на МИМ-321 дает реальный фазовый портрет поверхностных и внутренних структур.
Поскольку при сканирующей электронной микроскопии применялись щадящие методы фиксации и обезвоживания, не нарушающие естественную архитектонику в микробном сообществе, удалось получить объективную информацию о нативном состоянии бактерий в популяциях (810). Было установлено, что бактерии формируют колонии и микроколонии, где тесно связаны между собой благодаря наличию экзопродуктов различной природы, продуцируемых клеточной стенкой и образующих межклеточный матрикс, от степени развития которого зависит образование покровов — биопленок (см. рис. 2, Б, слева).
Как известно, неблагоприятное воздействие на бактерии приводит к нарушению нормального бинарного деления. Использование МИМ-321 по зволило на ранних стадиях в реальном времени регистрировать влияние L-трансформирующего фактора. Так, при воздействии тетрациклина зафиксировали нарушения целостности клеточной стенки, что свидетельствует о начальной стадии проявления гетероморфизма (рис. 3, б, в; см. цветную вклейку после стр. 56).
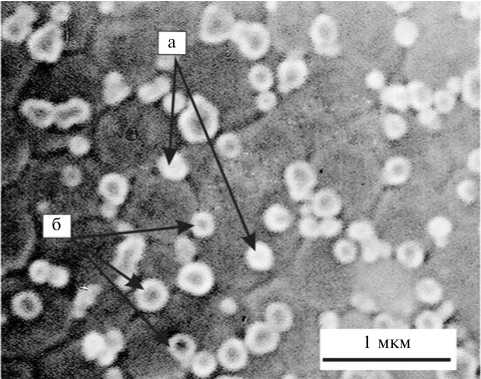
Рис. 4. Нестабильные (а) и стабильные (б) Ь-формы Salmonella enterica serovar typhimurium после воздействия биологически активных веществ, продуцируемых Bacillus subtilis . Электронный микроскоп Hitachi-800 (Япония) со сканирующей приставкой Hitachi-8010.
При исследовании L-трансформирующего действия БАВ, продуцируемых B . subtilis , на популяции сальмонелл с использованием СЭМ мы наблюдали образование мелких L-форм разного размера (0,20,5 мкм) (рис. 4).
Было установлено, что по морфологическим критериям L-формы различались между собой. Часть мелких клеток имели вид выпуклого однородного шара (см. рис. 4, а; рис. 5, е), в то время как другие представляли собой уплощенную сферу с выраженным темным центром (см.
рис. 4, б; 5, ж).
Для изучении закономерностей процессов L-трансформации исследовали воздействие биотических (биологически активные вещества, продуцируемые B. subtilis) и абиотических (антибиотик тетрациклин) фак торов на популяции сальмонелл.
На фазовых портретах содержащей и лишенной ДНК L-формы (см. рис. 5, цветная вклейка после стр. 56) четко видно, что нестабильные L-формы (см. рис. 5, а, г, е), в которых присутствует ДНК, представляли собой сферу с выпуклой вершиной, в то время как стабильные L-формы (см. рис. 5, б, д, ж) были уплощенными, с пустым центром, что отражено на профилях фазовых портретов (см. рис. 5, в).
При сравнении градиентных фазовых портретов, полученных на МИМ-321, у части L-форм в центре выявлялись плотные кольцевидные структуры, предположительно идентифицированные нами как ДНК (см. рис. 5, г), которые, однако, обнаруживались не всегда (см. рис. 5, д).
После воздействия тетрациклина число нестабильных L-форм, содержащих ДНК и потенциально способных к реверсии, в популяциях не превышало 25 % исследуемых клеток. Полученное нами в результате статистической обработки процентное соотношение стабильных и нестабильных L-форм — величина непостоянная, которая зависела в первую очередь от L-трансформирующего агента, а также от ряда других факторов, требующих дальнейшего изучения.
Следует отметить, что процесс реверсии клеток в исходное состояние занимал больше времени, чем нормальное развитие бактериальной популяции (5 сут). После подращивания на мембранных фильтрах наблю- дался трудноразличимый неконтрастный рост культуры в виде уплощенных мелких колоний (рис. 6, а).
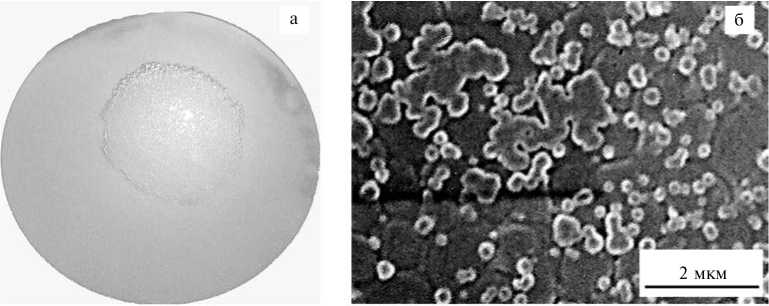
Рис. 6. Реверсия нестабильных L-форм в популяции Salmonella enterica serovar typhimurium : а — рост на мембранных фильтрах Владипор (ООО «Владипор», Россия) на МПА, б — изображение микроколонии, полученное методом сканирующей электронной микроскопии (СЭМ). Электронный микроскоп Hitachi-800 (Япония) со сканирующей приставкой Hitachi-8010.
Исследование методом СЭМ продемонстрировало, что в центральной части популяции имеются клетки, способные к реверсии в исходное состояние, на что указывало формирование на поверхностях покровов, которые могут образовываться только при полной репарации клеточных стенок. Процесс реверсии свидетельствовал о том, что эти нестабильные L-формы содержали полноценный геном и полностью сохраняли морфологические, биохимические и патогенные свойства. В то же время по периферии колонии обнаруживались единичные разрозненные уплощенные клетки с темным центром — стабильные L-формы (см. рис. 6, б), не способные к реверсии вследствие неполноценности ДНК, что позволяет рассматривать их как морфологических мутантов, фенотип которых генетически детерминирован (3).
Таким образом, исследование процесса L-трансформации в популяции Salmonella enterica serovar typhimurium методами сканирующей, просвечивающей электронной (СЭМ, ПЭМ) и лазерной модуляционной интерференционной микроскопии (МИМ) дало возможность выявить закономерные морфологические признаки L-форм, способных реверсировать в исходное состояние. С появлением методов оптической микроскопии, обладающих сверхразрешением, стало доступно изучение L-трансформации в режиме реального времени на живых бактериях (без фиксации и окрашивания). Полученные с помощью МИМ трехмерные фазовые портреты позволили не только однозначно идентифицировать L-формы бактерий, но и с высокой точностью определить основные морфологические параметры клеток (диаметр, периметр, высота, площадь, объем). С применением современных алгоритмов обработки этих данных внутри нестабильных L-форм зарегистрированы кольцевые структуры (предположительно ДНК). Следует отметить, что гетероморфизм со всеми проявлениями L-трансформации характерен для популяций патогенных и условно патогенных бактерий и способствует выживанию вида как в норме, так и при воздействии любых абиотических и биотических факторов. Изучение биологических особенностей L-трансформации имеет важное значение для понимания процессов существования потенциальных резервуаров возбудителей в природе, а также в патогенезе рецидивов хронических заболеваний.


