Исследование радиокаталитической активности гадолиний-содержащих наночастиц оксида церия и их сенсибилизирующих свойств на 3D-клеточных опухолевых сфероидах
Автор: Колманович Д.Д., Чукавин Н.Н., Попов А.Л.
Рубрика: Научные статьи
Статья в выпуске: 4 т.34, 2025 года.
Бесплатный доступ
Комплексы на основе гадолиния повсеместно применяются при магнитнорезонансной томографии (МРТ), однако безопасность их использования вызывает вопросы. Ключевым фактором риска является накопление ионов гадолиния в здоровых тканях при многократном введении соответствующих препаратов. Таким образом, существует острая потребность в разработке новых безопасных подходов для МРТ визуализации. К их числу относится использование формуляций на основе наночастиц, которые позволяют ограничить высвобождение ионов гадолиния за счёт их удержания в кристаллической решётке. В данной работе нами были разработаны наночастицы оксида церия, допированные 10% и 20% (мол.) гадолинием (Ce0,9Gd0,1O2х и Ce0,8Gd0,2O2х соответственно). Был проведён анализ их радиосенсибилизирующих свойств в бесклеточной системе и на 3Dклеточных опухолевых сфероидах. Показано, что наночастицы, содержащие 10% гадолиния, обладают выраженной радиокаталитической активностью, в то время как повышение доли гадолиния до 20% приводит к значительному снижению их радиосенсибилизирующих свойств. Продемонстрирована pHзависимость радиационноиндуцированной активности наночастиц. Наиболее выраженные эффекты генерации активных форм кислорода (АФК) были выявлены при рН 6,5, в то время как при рН 7,4 было показано снижение уровня генерации АФК. Сочетанное действие Ce0,8Gd0,2O2х и рентгеновского излучения привело к подавлению миграционной активности опухолевых клеток линий 4Т1 и EMT6/P в 3Dклеточных сфероидах. Этот эффект может обеспечиваться усиленной генерацией АФК в присутствии наночастиц. Разработанные гадолинийсодержащие наночастицы оксида церия представляют собой многообещающий агент для тераностики опухолевых заболеваний.
Наночастицы оксида церия, гадолиний, радиосенсибилизаторы, радиокатализ, клетки рака протоков молочной железы мыши линий 4Т1, клетки рака молочной железы мыши EMT6/P, 3D-опухолевые сфероиды, онкология, лучевая терапия
Короткий адрес: https://sciup.org/170211339
IDR: 170211339 | УДК: 616-073.756.8:546.655 | DOI: 10.21870/0131-3878-2025-34-4-57-66
Текст научной статьи Исследование радиокаталитической активности гадолиний-содержащих наночастиц оксида церия и их сенсибилизирующих свойств на 3D-клеточных опухолевых сфероидах
Лучевая терапия (ЛТ) является одним из ключевых методов лечения онкологических патологий и применяется более чем в 50% случаев заболеваний. ЛТ также является важным компонентом комбинированного лечения рака [1]. Между тем, использование ЛТ сопряжено с высокими рисками развития побочных эффектов, обусловленных повреждением здоровых тканей, расположенных на пути радиационного трека и вблизи опухоли. Подобные радиационно-индуцированные повреждения могут быть острыми или хроническими и способны ухудшить прогноз выживания и выздоровления пациентов. Это создаёт существенные ограничения для эффективного использования ЛТ [2]. В связи с этим, существует необходимость разработки и внедрения новых стратегий и технологий, направленных на снижение лучевой нагрузки на здоровые ткани и органы.
Одним из наиболее перспективных подходов к снижению побочного действия ЛТ является использование радиосенсибилизаторов, способных усиливать воздействие ионизирующего излучения на опухолевые ткани при меньшей дозе. В качестве таких радиосенсибилизаторов могут
Колманович Д.Д. - мл. науч. сотр.; Чукавин Н.Н. - мл. науч. сотр.; Попов А.Л.* - вед. науч. сотр., к.б.н. ИТЭБ РАН.
выступать наноформуляции на основе оксидов редкоземельных металлов, например, гадолиния (Gd) [3]. Использование гадолиния придаёт таким наноформуляциям не только способность эффективно поглощать и переизлучать энергию ионизирующего излучения, но и обеспечивать визуальный контроль над их локализацией за счёт их способности к контрастированию при магнитно-резонансной томографии (МРТ). Более того, гадолиний-содержащие наночастицы обладают преимуществом над традиционно используемыми хелатными комплексами гадолиния. Они демонстрируют значительно более высокую релаксивность, что связано с повышенным количеством ионов Gd3+, локализованных в кристаллической решётке, отдельно взятой наночастицы [4]. Кроме того, гадолиний-содержащие наночастицы обладают высокой стабильностью в биологических средах, что снижает риск высвобождения свободных ионов Gd3+, которые в свободном виде могут обуславливать токсичность. Важным преимуществом подобных наночастиц является их многофункциональность: они могут быть функционализированы для адресной доставки в опухолевые клетки, что делает их перспективными для диагностики и терапии онкологических заболеваний [5].
Среди различных типов гадолиний-содержащих наночастиц наиболее изученными являются наночастицы на основе оксида гадолиния (Gd 2 O 3 ), мезопористые наночастицы кремния, до-пированные гадолинием, а также липосомы, содержащие хелатные комплексы гадолиния [6, 7]. Каждый из этих типов наночастиц обладает уникальными свойствами, которые могут быть использованы для решения конкретных биомедицинских задач. Например, наночастицы Gd 2 O 3 демонстрируют выраженную релаксивность и стабильность, что делает их чрезвычайно эффективными для МРТ-визуализации опухолей. В свою очередь, липосомы с комплексами гадолиния обладают высокой биосовместимостью и могут быть гибко модифицированы для адресной доставки тераностических агентов к целевым тканям [8].
Наночастицы на основе церия, также известные как наноцерий, представляют собой один из наиболее перспективных наноматериалов для биомедицинских целей, что обусловлено его уникальными физико-химическими свойствами и высокой степенью биосовместимости. Например, уникальные свойства наночастиц оксида церия (CeO 2 ) основаны на высокой кислородной нестехиометрии поверхности наночастицы и способности к самовозобновляемым окислительновосстановительным реакциям за счёт перехода ионов Ce3+ ↔ Ce4+, происходящих на поверхности наночастиц [9]. Они также обуславливают их энзимоподобную каталитическую активность, в связи с чем наночастицы оксида церия относят к неорганическим нанозимам [10]. В то же время, наночастицы фторида церия (CeF 3 ) обладают селективной радиосенсибилизирующей активностью [11]. Благодаря вышеописанным особенностям наноцерий находит широкое применение в различных областях, таких как катализ, энергетика, медицина, сенсорика и защита окружающей среды [12].
Сочетание в одной наноформуляции двух и более функциональных элементов с различными свойствами может усилить активность её компонентов и придать ей новые уникальные характеристики. Вместе с тем, наночастицы оксида церия беспрепятственно могут быть функционализированы различными химическими элементами и молекулярными лигандами [13]. В частности, допирование кристаллической решётки наночастиц СеО2 элементарным гадолинием оказывает влияние на магнитные, электрические и фотокаталитические свойства [14]. Более того, данный способ модификации представляет особый интерес, поскольку ионы Gd3+ имеют ионный радиус, близкий к Ce3+, что минимизирует процессы деформации кристаллической решётки и способствует стабилизации структуры наночастиц [15]. Допирование CeO2 гадолинием также приводит к значительному улучшению ионной проводимости данного наноматериала. Это связано с тем, что введение Gd3+ обеспечивает образование кислородных вакансий – дефектов в кристаллической решётке CeO2, способствующих более эффективному процессу катализа [16]. Вместе с тем, гадолиний в составе данных наночастиц сохраняет свои МРТ-контрастирующие свойства [17].
В данной работе, используя ранее разработанные наночастицы оксида церия, допирован-ные 10% и 20% (мол.) гадолинием (Ce 0,9 Gd 0,1 O 2 и Ce 0,8 Gd 0,2 O 2 соответственно), были исследованы их радиосенсибилизирующие свойства в бесклеточной системе и на 3D-клеточных сфероидах при воздействии рентгеновского излучения. Полученный наноматериал представляет собой перспективный, с точки зрения биомедицинских применений, тераностический агент.
Материалы и методы
Объект исследования. Наночастицы оксида церия, содержащие 0, 10 и 20% (мол.) гадолиния (CeO 2 , Ce 0,9 Gd 0,1 O 2-x и Ce 0,8 Gd 0,2 O 2-x соответственно), были синтезированы одностадийным способом, описанным ранее [18].
Параметры облучения. Облучение образцов (суспензии наночастиц в MQ H 2 O, сфероиды в культуральной среде) проводили в пробирках типа Eppendorf (GenFollower, Шаосин, Китай) на рентгеновском терапевтическом аппарате РУТ-250-15-1 (РУМ-13, «Мосэнерго», СССР) (ЦКП ИБК РАН, Пущино) в дозах 1, 3, 5 и 6 Гр при мощности дозы 1 Гр/мин, фокусное расстояние 17 см, при напряжении 200 кВ и токе 15 мА. Дозиметрия проводилась непосредственно перед проведением эксперимента с использованием дозиметра клинического ДКДа-01-«ИФТП». Облучение осуществлялось по заданному времени. Таким образом, дозы 1, 3, 5 и 6 Гр подавались на объекты в течение 1, 3, 5 и 6 мин соответственно.
Оценка генерации активных форм кислорода в бесклеточной системе. Определение генерации активных форм кислорода (АФК) в бесклеточной системе производилось с использованием флуоресцентного красителя 2′,7′-дихлородигидрофлуоресцеина диацетата (H 2 DCF-DA). Были подготовлены 10-кратные стоковые растворы наночастиц в 0,1 М растворе Tris-HCl (pH=7,4). Затем стоковые растворы были разбавлены соответствующим количеством Tris-HCl с доведением итогового объёма до 200 мкл. После этого было произведено деацетилирование красителя путём инкубации 1,5 mM раствора H 2 DCF-DA с NaOH (10 µМ) в течение 30 мин, затем раствор красителя доводили до рабочей концентрации 8 µМ в Tris-HCl. Далее добавляли по 800 мкл к ранее подготовленным растворам наночастиц. Суспензии наночастиц облучали рентгеновским излучением в различных дозах (1, 3 и 5 Гр). Облучённые суспензии наночастиц переносили в 96-луночный планшет (SPL Life Sciences, Корея) и производили анализ интенсивности флуоресценции на планшетном ридере Synergy H1 (BioTek Instruments Inc., США) при длине волны возбуждения 485 нм и эмиссии 535 нм.
Полученные значения интенсивности флуоресценции DCF (окисленной АФК формы H 2 DCF) в растворах были представлены как фактор изменения дозы (DEF ROS или ФИД АФК ), высчитанный по формуле, представленной ниже:
DEF ros =
^ F xGy with NP^ ^ F OGy with NP^
^FxGy without NP$ ^FoGy without NP$ где IFxGy with NPs – интенсивность флуоресценции DCF в группе с наночастицами и облучением рентгеном; IF0Gy with NPs – интенсивность флуоресценции DCF в группе с наночастицами, но без облучения; IFxGy without NPs – интенсивность флуоресценции DCF в облучённой группе без наночастиц; IF0gy without nps – интенсивность флуоресценции DCF в группе без наночастиц и без облучения.
Культуры клеток. В работе были использованы опухолевые клетки линий 4Т1 (клетки рака протоков молочной железы мыши) и EMT6/P (клетки рака молочной железы мыши). Клетки линии 4Т1 культивировали в питательной среде RPMI с 10%-м добавлением фетальной бычьей сыворотки (ФБС), клетки линии EMT6/P культивировали в питательной среде DMEM/F12 (1:1), также с 10%-м добавлением ФБС. Обе среды также содержали 50 мкг/мл пенициллина, 50 мкг/мл стрептомицина и 2 мМ L-глутамина. Клетки культивировали в СО 2 -инкубаторе при температуре 37 оС, 5%-м содержанием СО 2 и 95%-ой влажности.
Формирование 3D-клеточных сфероидов. 3D-клеточные сфероиды готовили методом «висячей капли». Клетки снимали с подложки с помощью трипсина-ЭДТА (0,05%), а затем трижды промывали центрифугированием на медицинской центрифуге ELMI CM-6M при 1000 об/мин в течение 5 мин в фосфатно-солевом буфере (ПанЭко, Россия). Затем к клеткам добавляли питательную среду с ФБС и редиспергировали их. К полученной суспензии клеток добавляли метил-целлюлозу (1% в среде без сыворотки), общая концентрация метилцеллюлозы не превышала 0,1% масс. Концентрация используемых клеток линий 4T1 и EMT6/P составляла 150000 кле-ток/мл. Для формирования сфероидов клетки были высеяны на крышку 60-мм пластиковой чашки Петри каплями объёмом 20 мкл. Для того, чтобы предотвратить высыхание капель, на дно чашки помещали 10 мл фосфатно-солевого буфера. После этого крышку чашки аккуратно помещали сверху. Клетки инкубировали в течение 72 ч.
Анализ миграционной активности в условиях облучения. Сфероиды по достижении среднего размера 400-450 мкм инкубировали с наночастицами в течение 16-18 ч, после чего была произведена замена среды с наночастицами на свежую питательную среду без добавления сыворотки. Затем осуществляли облучение сфероидов рентгеновским излучением в дозе 6 Гр. Далее был произведён перенос сфероидов на адгезионный пластик, к сфероидам были аккуратно добавлены соответствующие питательные среды с сывороткой. После чего производился ежедневный мониторинг зоны миграции клеток из облучённого сфероида с использованием планшетного ридера CloneSelect Imager (Molecular Devices, США). Данные представлены как площадь формирующегося монослоя клеток за вычетом исходной площади сфероида.
Статистический анализ. Полученные данные были обработаны с использование программы GraphPad Prism 8. Статистический анализ был проведён с использованием t-теста Стьюдента.
Результаты и обсуждение
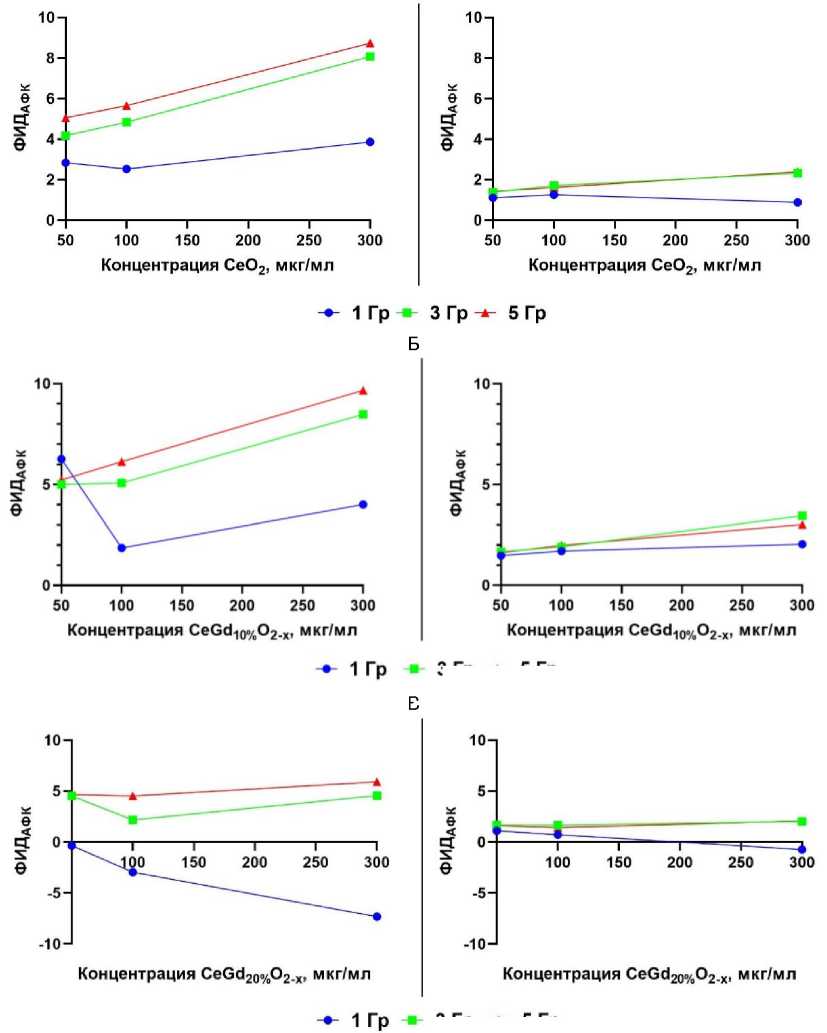
Редокс-активность церий-содержащих наночастиц сильно зависит от рН микроокружения [19]. Нами был проведён анализ радиокаталитической активности наночастиц путём оценки уровня образовавшихся АФК в буферных растворах с различным значением рН (рис. 1), который для удобства презентации результатов рассчитан как ФИДафк и выражен в условных единицах. Была выявлена тенденция к увеличению ФИДафк наночастиц при значении рН=6,5. В то же время при рН=7,4 было выявлено снижение ФИДафк наночастиц. Это подтверждает зависимость каталитических свойств наночастиц от pH микроокружения. Стоит отметить, что наночастицы оксида церия, не содержащие атомов гадолиния, продемонстрировали ярко выраженное увеличение значения ФИДафк при рН 6,5 при дозе облучения 5 Гр, зависящую от концентрации наночастиц: увеличение значения ФИДафк в 5, 6 и 8 раз при концентрации 50, 100 и 300 мкг/мл соответственно.
pH 6,5
А pH 7,4
В
3 Гр -*- 5 Гр
Рис. 1. Фактор изменения дозы (ФИД АФК ) после облучения наночастиц оксида церия (CeO 2 , А), наночастиц оксида церия, допированных гадолинием на 10% (мол.) (Ce 0,9 Gd 0,1 O 2-х , Б) и на 20% (мол.) (Ce 0,8 Gd 0,2 O 2-х , В). Показатель ФИДафк отображает направление и величину отклонения уровня АФК от контрольного значения. Если отклонение больше 1, то при данной концентрации наночастицы оказывают прооксидантный эффект, в то время как при значениях меньше 1 – антиоксидантный эффект.
3 Гр -*• 5 Гр
Наночастицы, допированные гадолинием на 10%, обеспечивают 10-кратное увеличение значения ФИДафк при облучении в дозе 5 Гр и концентрации наночастиц 300 мкг/мл, что значительно превышает значение, полученное при облучении не допированных наночастиц. Между тем, при концентрациях 50 и 100 мкг/мл подобных различий не было выявлено. Использование наночастиц с 20% допированием продемонстрировало снижение значения ФИДафк в зависимости от концентрации наночастиц по сравнению с 10% наночастицами и наночастицами, вовсе не содержащими атомов гадолиния. Для наночастиц Ce0,8Gd0,2O2 было показано 5-кратное увеличение значения ФИДафк при концентрации наночастиц 300 мкг/мл и дозе облучения 5 Гр при рН 6,5. Важно отметить, что при pH 7,4 все типы наночастиц продемонстрировали снижение радиационно-индуцированной каталитической активности. Практически во всех случаях было показано увеличение значения ФИДафк всего в 2 раза вне зависимости от дозы и концентрации наночастиц. Таким образом, допирование наночастиц оксида церия гадолинием обуславливает усиление их радиока-талитических свойств до определённого предела содержания гадолиния. Более того, pH среды, в которой находятся наночастицы при облучении, также напрямую влияет на данные свойства.
Хорошо известно, что опухолевая экспансия, т.е. распространение опухоли по всему орга- низму, связана с высокой пролиферативной и миграционной активностью соответствующих опу- холевых клеток [20]. Одним из ключевых принципов радиотерапии опухолевых заболеваний является частичная или полная блокировка миграционной активности клеток опухоли, что обеспечивает её локализацию для последующего удаления хирургическим путём. Для исследования радиосенсибилизирующих свойств наночастиц оксида церия, допированного гадолинием, на 3D-клеточных опухолевых сфероидах были выбраны наночастицы с 20% содержанием гадолиния (Ce0,8Gd0,2O2-х). Показано снижение миграционной активности опухолевых клеток из сферои- дов в присутствии наночастиц Ce0,8Gd0,2O2-х без облучения (рис. 2).
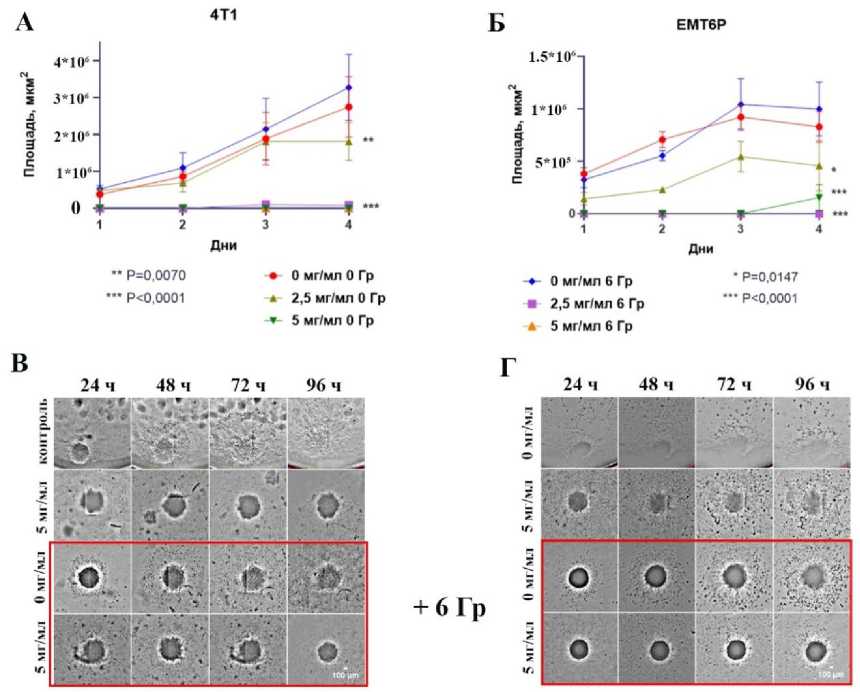
Рис. 2. Динамика миграционной активности клеток из сфероидов 4Т1 и EMT6/P в течение 4-х сут после облучения в дозе 6 Гр в присутствии наночастиц Ce 0,8 Gd 0,2 O 2-х . Данные представлены как среднее арифметическое ± стандартное отклонение площади миграции клеток из сфероида в мкм2. Статистическая значимость различий между контрольной и экспериментальными группами подтверждена с использованием t-теста Стьюдента, где * – при p<0,05; ** – при p<0,01 и *** – при p<0,001, N=6.
В частности, при концентрации наночастиц 2,5 мг/мл наблюдается частичное торможение миграции опухолевых клеток линии 4T1 к 4-м сут эксперимента. При этой же концентрации наночастиц было выявлено снижение миграционной активности клеток EMT6/P уже с первых суток. Более того, в присутствии наночастиц в концентрации 5 мг/мл было выявлено полное подавление миграционной активности обеих клеточных линий.
Темпы миграции опухолевых клеток линии 4T1 из сфероидов после облучения в дозе 6 Гр без наночастиц были на уровне контрольных групп, статистически достоверной разницы обнаружено не было. Подобная картина была выявлена у клеток из сфероидов линии EMT6/P, когда облучение рентгеновским излучением практически никак не повлияло на уровень их миграционной активности. Вместе с тем, при инкубации сфероидов обоих типов с наночастицами Ce 0,8 Gd 0,2 O 2 в концентрации 2,5 мг/мл в условиях облучения в дозе 6 Гр наблюдалось полное подавление миграции опухолевых клеток из сфероидов.
Заключение
Допирование наночастиц оксида церия гадолинием в 10% (мол.) обеспечивает усиление их радиокаталитической активности. При этом увеличении содержания допанта до 20%, наоборот, снижает способность наночастиц генерировать АФК в условиях облучения рентгеновским излучением. Радиационно-индуцированная редокс-активность наночастиц зависит от значения рН микроокружения. Наиболее выраженные эффекты генерации АФК были выявлены при рН 6,5, в то время как при рН 7,4 показано снижение соответствующей активности. Наночастицы Ce 0,8 Gd 0,2 O 2 оказывают радиосенсибилизирующее воздействие на клетки линий 4T1 и EMT6/P, снижая их способность к миграции из 3D-опухолевых сфероидов в условиях облучения рентгеновским излучением. Данный эффект может быть обусловлен усиленной генерацией АФК в присутствии наночастиц, что согласуется с результатами, полученными на бесклеточной системе. Как следствие, наночастицы оксида церия, допированные гадолинием, могут рассматриваться в качестве перспективного агента для тераностики опухолевых заболеваний. Представляется целесообразным в дальнейшем провести исследование МРТ-контрастирующих свойств данных наночастиц и их радиосенсибилизирующей активности на животных моделях солидных опухолей.
Статья подготовлена при поддержке гранта РНФ № 22-73-10231,


