Исследование различий ИК-спектров дождевых червей как возможный способ их таксономической идентификации
Автор: Князев С.Ю., Бабий К.А., Голованова Е.В., Соломатин Д.В., Сарф Е.А., Бельская Л.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Зоология
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Цель данного исследования - оценка принципиальной возможности таксономической идентификации дождевых червей на основании изучения функционально-группового состава их тел методом ИК-Фурье спектроскопии. Объектами исследования послужили дождевые черви 7 видов из 5 родов: Aporrectodea caliginosa, Eisenia fetida, E. nordenskioldi, E. ventripapillata, Lumbricus rubellus, Rhiphaeodrilus diplotetrathecus, Octolasion lacteum. ИК-спектры поглощения регистрировали на ИК-Фурье-спектрометре «ФТ-801» в диапазоне 500-4 000 см-1. На всех спектрах определены положение, интенсивность и площадь полос поглощения, установлены максимальные различия между отдельными видами по интенсивности и положению полос поглощения белков и нуклеиновых кислот. Метод главных компонент показал, что в основе классификации лежат характеристики полос поглощения валентных и деформационных колебаний метильных и метиленовых групп, а также амидных групп в структуре червей. При этом разделение дождевых червей на подгруппы с близкими спектральными характеристиками может быть объяснено несколькими причинами: их происхождением, родством и влиянием среды. Полученные в ходе исследования данные подтверждают возможность использования ИК спектрометрии для идентификации дождевых червей.
Дождевые черви, таксономическая идентификация, ик-фурье спектроскопия
Короткий адрес: https://sciup.org/147241916
IDR: 147241916 | УДК: 595.142.34:57.06:543.424 | DOI: 10.17072/1994-9952-2023-2-147-157
Текст научной статьи Исследование различий ИК-спектров дождевых червей как возможный способ их таксономической идентификации
Дождевые черви являются ключевыми “инженерами”, управляющими рядом экосистемных функций почвы, такими как круговорот питательных веществ [Lavelle et al., 2016], разложение опада [Blouin et al., 2013] и эмиссия парниковых газов [Lubbers et al., 2013]. Чтобы оценить влияние дождевых червей на обеспечение этих функций, необходима их таксономическая идентификация, которая традиционно основана на морфологических особенностях, однако она трудоемка и требует определенной квалификации. А определение неполовозрелых и поврежденных особей часто невозможно, из-за чего они не используются в исследованиях [Richard et al., 2010]. Поэтому молекулярные подходы, такие, как анализ ДНК, стали использоваться как альтернативный инструмент для идентификации дождевых червей [Shekhovtsov et al., 2017] или разделения морфологически схожих видов [Shekhovtsov et al., 2016]. Несмотря на технологическое развитие и снижение стоимости оборудования и реактивов для проведения секвенирования [Gautier et al., 2018; Srivathsan et al., 2019], анализ ДНК редко применяется в исследованиях из-за высокой стоимости, поэтому существует необходимость использовать недорогие и доступные методы идентификации таксонов (видов) дождевых червей с помощью более дешевых альтернативных молекулярных подходов [Vaupel, Hommel, Beule, 2022] или метаболомики, которая основана на методах аналитической химии, анализирующей глобальный метаболический профиль объекта [Rodríguez-Fernández et al., 2010]. Одним из самых дешевых, надежных и почти мгновенных методов является инфракрасная (ИК) спектрометрия [Raupach et al., 2016].
Возможности использования ИК-спектрометрии для таксономической идентификации установлены в различных областях [Rodríguez-Fernández et al., 2010; Vance et al., 2016], в том числе для бабочек [Tao et al., 2018], мух дрозофил [Aw, Dowell, Ballard, 2012], прямокрылых [Da Silva, Gutjahr, De Morais, 2018], комаров [Sikulu, 2014], долгоносиков [Johnson, 2022] и термитов [Jouquet et al., 2018]. Поэтому целью данного исследования являлось изучение химического состава тел дождевых червей разных родов и видов методом инфракрасной спектрометрии для установления возможности его использования в таксономической идентификации дождевых червей.
Материал и методы исследования
Сбор дождевых червей
Объектами исследования послужили дождевые черви 7 видов из 5 родов: Aporrectodea caliginosa (Savigny, 1826), Eisenia fetida (Savigny, 1826), Eisenia nordenskioldi (Eisen, 1879), Eisenia ventripapillata Perel, 1985, Lumbricus rubellus Hoffmeister, 1843, Rhiphaeodrilus diplotetrathecus (Perel, 1967), Octolasion lacteum (Orley, 1885). Дождевые черви были собраны на 4 участках: в окрестностях с. Чернолучье (Омский р-н, Омская обл., N 55°16'33.6", Е 73°02'35.3"); на исследовательском полевом стационаре Омского государственного педагогического университета (г. Омск, N 55°02'38.9", Е 73°22'52.4"); на территории Парка культуры и отдыха им. 30-летия Победы (г. Омск, N 54 ° 57', Е 73 ° 21'); в окрестностях д. Хомутов-ки (городской округ Первоуральск, Свердловская обл., N 56°51'37.7", E 59°46'02.8").
Инкубационный эксперимент. Подготовка образцов
Для изучения состава тела дождевых червей мы поместили их в 14 двухлитровых пластиковых контейнеров с перфорированными крышками, по два микрокосма на каждый вид. Микрокосмы были заполнены 1.5 л почвы, очищенной от макрофауны с помощью сит с диаметром ячейки 4 мм. Во всех микрокосмах в качестве подстилки использовалась сухая листва Populus tremula L. по 9.00 ± 0.05 г. Таким образом мы нивелировали влияние типа почвы и опада на состав тела червей. Почву в микрокосмах поли- вали одинаковым количеством дистиллированной воды, чтобы поддерживать влажность на уровне 50%. В каждый микрокосм добавляли по 8 особей дождевых червей. В микрокосмах дождевые черви содержались в течение 90 сут., и каждые 30 дней производилась замена почвы. Затем их промывали дистиллированной водой. Для очистки кишечника содержали пять суток в отдельных контейнерах по 2 особи на фильтровальной бумаге, которую меняли по мере загрязнения. После этого их замораживали на 24 ч., заранее удалив последние сегменты тела, так как они часто содержали остатки почвы. Далее червей высушивали при температуре 60°C в течение 48 ч. и потом измельчали в порошок. Всего было подготовлено по 6 образцов каждого вида по 2–3 особи на один образец.
Метод получения и предварительной обработки ИК-спектров
Порошки исследовали в таблетках, спрессованных в смеси с бромистым калием (соотношение 1:100, диаметр 3.5 мм). В качестве опорного использован спектр чистого бромистого калия, предварительного высушенного при температуре ~600°С в течение 6 ч. ИК-спектры поглощения регистрировали на ИК-Фурье-спектрометре «ФТ-801» (СИМЕКС) в диапазоне 500–4000 см–1 (число сканов 32, разрешение 4 см– 1). Коррекция базовой линии и нормализация спектров произведены с использованием программного обеспечения ZaIR 3.5 (СИМЭКС). На всех спектрах определяли положение, интенсивность и площадь полос поглощения (ПП).
Статистический анализ полученных данных выполнен при помощи программ Statistica 10.0 (StatSoft) непараметрическим методом с использованием в зависимых группах критерия Вилкоксона, в независимых группах – U-критерия Манна-Уитни. Описание выборки производили с помощью подсчета медианы (Ме) и интерквартильного размаха в виде 25-го и 75-го процентилей [LQ; UQ]. Различия считали статистически значимыми при p ˂0.05. Для определения видовой близости состава тела дождевых червей использовали метод Уорда для построения кластерной древовидной диаграммы с евклидовой мерой сходства. Анализ методом главных компонент (PCA) был выполнен в программном пакете R (package “FactoMinerR”) [Le, Josse, Husson, 2008].
Результаты и их обсуждение
Типичный ИК-спектр червя приведен на рис. 1. Показано, что в его структуре присутствуют функциональные группы белков (1 315–1 638 см–1), липидов (2 873–2 960 см–1) и нуклеиновых кислот (617–1 233 см–1). Детальная расшифровка ИК-спектров приведена в табл. 1. В целом по функционально-групповому составу исследуемые виды близки, основные отличия наблюдаются для ПП 617 см–1, 1 053–1 080 см–1 и 1 619–1 638 см–1 (рис. 2). ПП 1 053 см–1, которая появляется дополнительно на ИК спектрах червей вида R. diplotetrathecus и E. ventripapillata, соответствует колебаниям νC-O и δC-O углеводов. Некоторая сходность исследуемых видов по функционально-групповому составу может быть объяснена сходством среды обитания, так как червей перед анализом содержали 90 дней в лабораторных условиях в одинаковой почве и на одинаковой подстилке для нивелирования разницы в контрастности условий обитания, так как ранее для термитов [Jouquet et al., 2018] и дождевых червей [Pham et al., 2021] была установлена зависимость функционально-группового состава ИК-спектров от среды обитания и типа почвы. В то же время копролиты дождевого червя Andiodrilus pachoensis (Michaelsen, 1900) существенно различались по характеристикам ИК-спектров в зависимости от расположения участка и состава растительного покрова [Velasquez et al., 2007].
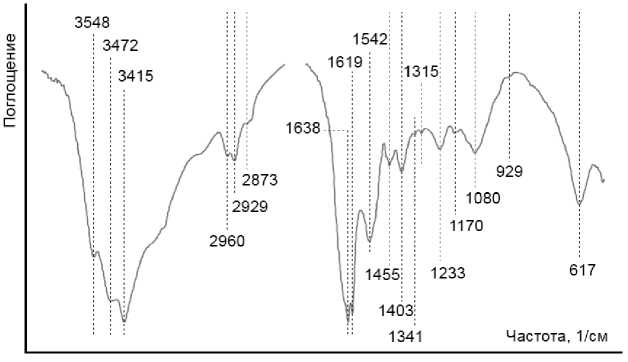
Рис. 1. Типичный ИК-спектр дождевого червя [Typical IR-spectrum of an earthworm]
Таблица 1
Основные ПП на ИК-спектрах дождевых червей [Main absorption bands in the IR spectra of earthworms]
|
ПП, см-1 |
Расшифровка |
ПП, см–1 |
Расшифровка |
|
617 |
Кольцевая деформация фенила |
1 542 |
δN-H, νC-N (Амид II) |
|
929 |
Левосторонняя спираль ДНК (Z-форма) |
1 619 |
νC=O (Амид I) β-pleated sheets |
|
1 080 |
νPO 2 (коллаген и фосфоди-эфирные группы нуклеиновых кислот) |
1 638 |
νC=O (Амид I) α-helical protein |
|
1 170 (1 156) |
νC-O of proteins and carbohydrates |
2 873 |
ν s CH 3 (липиды) |
|
1 233 |
δN-H, νC-N (Амид III) ν as PO 2 (нуклеиновые кислоты) |
2 929 |
ν as CH 2 (липиды) |
|
1 315 |
Амид III (белки, коллаген) |
2 960 |
ν as CH 3 (липиды, ДНК, белки) |
|
1 341 |
CH 2 wagging (коллаген) |
3 415 |
Stretching O-H asymmetric |
|
1 403 |
νC-N, δN-H, δC-H |
3 472 |
Stretching O-H asymmetric |
|
1 455 |
δ as CH 3 , δCH 2 |
3 548 |
Stretching O-H |
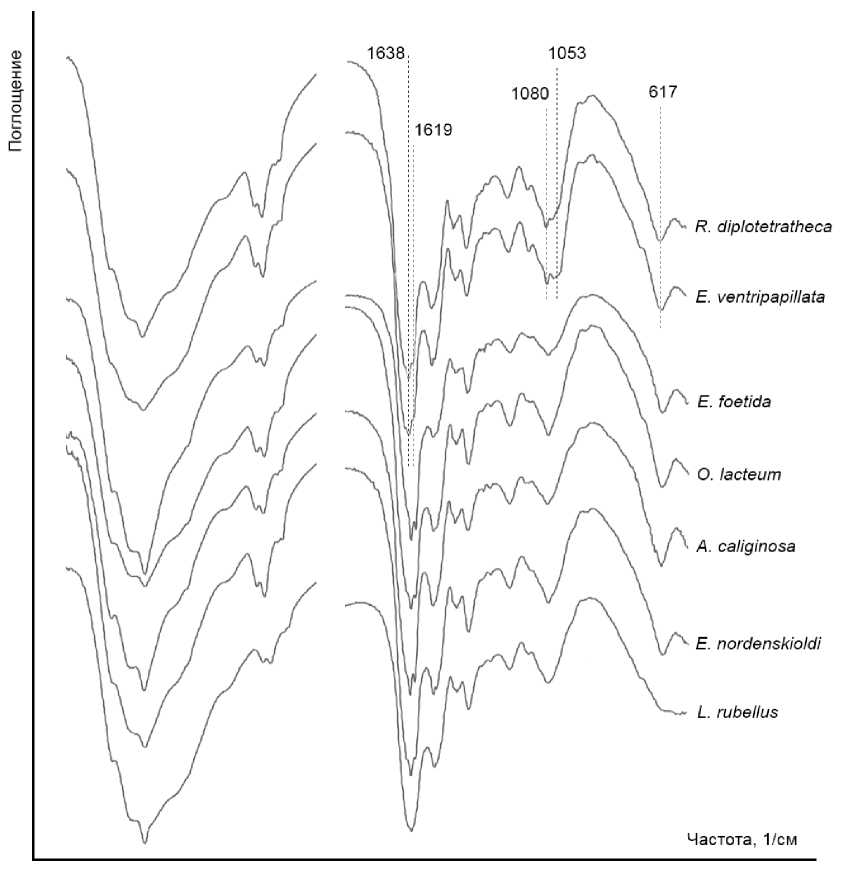
Рис. 2. Примеры ИК-спектров разных видов дождевых червей [Examples of IR spectra of different species of earthworms]
Выявлено, что частота встречаемости ПП на ИК-спектрах червей различных видов неодинакова (табл. 2). Так, ПП 930 и 1338 см–1 не обнаружены для вида L. rubellus , ПП 1355 см–1 для вида E. ventripapillata . ПП 1053 см–1 характерна для видов R. diplotetrathecus и E. ventripapillata и т.д. (табл. 2). В исследовании Фама с соавторами [Pham et al., 2021] виды червей Lumbricus terrestris Linnaeus, 1758, Allolobophora chlorotica (Savigny, 1826), A. caliginosa и Aporrectodea icterica (Savigny, 1826) также различались между собой по полосам поглощения в основном в областях 3 500–3 000 и <1 800 см-1.
Таблица 2
Частота встречаемости ПП на ИК-спектрах дождевых червей различных видов
[Frequency of occurrence of absorption bands in the IR spectra of earthworms of different species]
|
ПП, см-1 |
A. caliginosa |
E. fetida |
E. nordenskioldi |
L. rubellus |
R. diplotetrathecus |
O. lacteum |
E. ventripapillata |
|
614 |
100 |
50 |
33 |
67 |
100 |
100 |
50 |
|
930 |
33 |
100 |
100 |
0 |
100 |
100 |
100 |
|
1053 |
0 |
0 |
0 |
0 |
100 |
0 |
100 |
|
1080 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
1156 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
1236 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
1315 |
100 |
100 |
50 |
100 |
100 |
100 |
100 |
|
1338 |
100 |
100 |
33 |
0 |
67 |
33 |
83 |
|
1355 |
33 |
100 |
83 |
50 |
50 |
67 |
0 |
|
1407 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
1455 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
1547 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
1620 |
33 |
50 |
0 |
0 |
33 |
33 |
0 |
|
1640 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
2874 |
67 |
0 |
0 |
0 |
50 |
67 |
50 |
|
2929 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
2960 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
3418 |
100 |
50 |
33 |
100 |
100 |
100 |
100 |
|
3469 |
33 |
33 |
0 |
0 |
17 |
0 |
0 |
|
3546 |
83 |
17 |
0 |
0 |
17 |
0 |
0 |
Характеристики ПП, которые идентифицированы на ИК-спектрах всех изученных видов дождевых червей, приведены в открытом доступе на Figshare по адресу
С целью выявления сходств и различий между ИК спектрами разных видов червей проведен кластерный анализ (рис. 3).
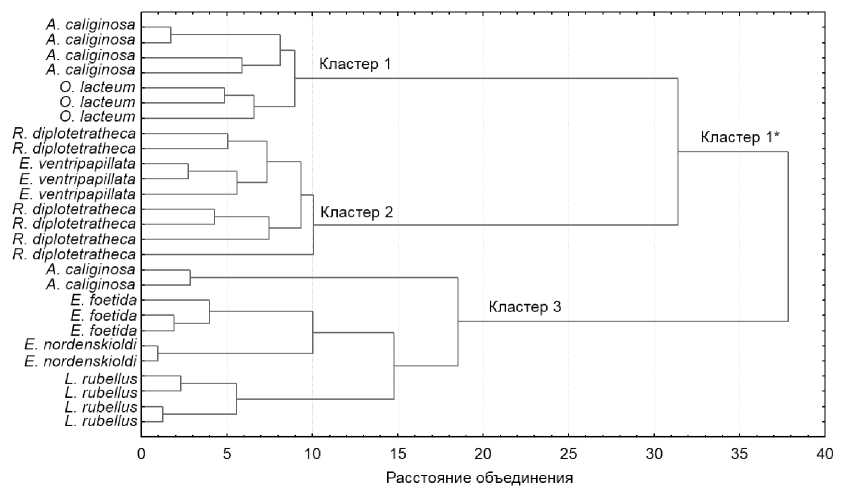
Рис. 3. Результаты кластерного анализа
[Results of cluster analysis]
Только для вида A. caliginosa отмечено попадание в разные кластеры, остальные виды показали четкое разделение: A. caliginosa + O. lacteum (кластер 1), R. diplotetrathecus + E. ventripapillata (кластер 2), E. fetida + E. nordenskioldi + L. rubellus (кластер 3) (рис.3). При укрупненном рассмотрении все виды кластеров 1 и 2 формируют единый кластер (кластер 1*).
Разделение дождевых червей на кластеры (рис. 3 и рис. 4) может быть объяснено несколькими причинами: их происхождением, родством и влиянием среды. A. caliginosa и O. lacteum являются европейскими по происхождению дождевыми червями, которые обитают и питаются непосредственно в почве [Tiunov et al., 2006]. E. fetida и E. nordenskioldi – филогенентически близкие друг к другу виды [Latif, Malek, Csuzdi, 2017], а некоторая их обособленность может быть вызвана разницей в происхождении. Согласно данным C. Csuzdi, J. Koo, Y. Hong [2022] род Eisenia формирует два субклада: один европейский, куда входит E. fetida , другой состоит из азиатских таксонов, включая E. nordenskioldi . Поэтому объединение этих четырех видов в два кластера видится закономерным. Попадание L. rubellus в кластер к E. fetida + E. nordenskioldi можно объяснить активным потреблением опада осины всеми тремя видами.
Объединение двух горных эндемиков R. diplotetrathecus [Перель, 1979; Vorobeichik et al., 2021] и E. ventripapillata [Перель, 1985] в один кластер можно объяснить сходными условиями обитания в горной местности при формировании видовых особенностей.
Попадание A. caliginosa (рис. 3) в два разных кластера может быть обусловлено тем, что некоторые особи могли потреблять больше подстилки, чем другие, так как отмечена его способность переходить к активному потреблению подстилки в лабораторных условиях, подобно подстилочным видам [van Groenigen et al., 2019].
Близкие результаты получены при многомерной оценке полученных данных методом главных компонент (РСА) (рис. 4).
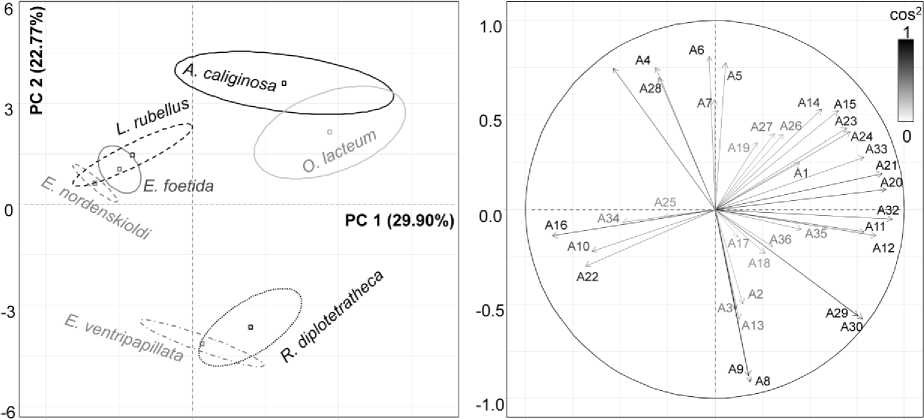
■ 5 0 5 -1.0 -0.5 0.0 0.5 1.0
Рис. 4. Факторные карты образцов (А) и переменных (Б).
A1 – X 617, A2 – H 617, A3 – S 617, A4 – X 1080, A5 – H 1080, A6 – S 1080, A7 – X 1156, A8 – H 1156, A9 – S 1156, A10 – X 1236, A11 – H 1236, A12 – S 1236, A13 – X 1315, A14 – H 1315, A15 – S 1315, A16 – X 1407, A17 – H 1407, A18 – S 1407, A19 – X 1455, A 20 – H 1455, A21 – S 1455, A22 – X 1547, A23 – H 1547, A24 – S 1547, A25 – X 1640, A26 – H 1640, A27 – S 1640, A28 – Х 2929, A29 – H 2929, A30 – S 2929, A31 – X 2960, A32 – H 2960, A33 – S 2960, A34 – X 3418, A35 – H 3418, A36 – S 3418. Х – положение ПП, H – высота ПП, S – площадь ПП
[Factor map of samples (A) and factor map of variables (Б). X is the position of the absorption band, H is the height of the absorption band, S is the area of the absorption band]
Показано, что вся выборка разделяется на 3 подгруппы: A. caliginosa + O. lacteum, R. diplotetrathecus + E. ventripapillata, E. fetida + E. nordenskioldi + L. rubellus (рис. 4а). Первые два компонента выражают 52.66% общей инерции набора данных. Первая главная компонента разделяет группы относительно вертикальной оси, вторая главная компонента – относительно горизонтальной оси. Вклад характеристик ИК-спектров в разделение подгрупп показан в табл. 3. Максимальный вклад в разделение подгрупп A. caliginosa + O. lacteum и R. diplotetrathecus + E. ventripapillata от E. fetida + E. nordenskioldi + L. rubellus вносят ПП 2960, 2929, 1547, 1455, 1407, 1355 и 1236 см–1, при этом положительные коэффициенты кор- реляции отмечены с высотой и площадью соответствующих ПП, тогда как отрицательные – с положением ПП (табл. 3).
Таблица 3
Коэффициенты корреляции характеристик ПП [Correlation coefficients of characteristics of absorption bands]
|
РС1 |
РС2 |
||||
|
Характерис тика ПП |
Коэффициент корреляции |
Характеристика ПП |
Коэффициент корреляции |
||
|
А32 |
H 2960 |
0.9384 |
А6 |
S 1080 |
0.8095 |
|
А20 |
H 1455 |
0.9047 |
А5 |
H 1080 |
0.7742 |
|
А21 |
S 1455 |
0.8819 |
А4 |
X 1080 |
0.7520 |
|
А12 |
S 1236 |
0.8517 |
А31 |
X 2960 |
0.7473 |
|
А33 |
S 2960 |
0.7870 |
А28 |
Х 2929 |
0.6979 |
|
А11 |
H 1236 |
0.7864 |
А7 |
X 1156 |
0.5804 |
|
А30 |
S 2929 |
0.7801 |
А14 |
H 1315 |
0.5294 |
|
А29 |
H 2929 |
0.7552 |
А15 |
S 1315 |
0.5205 |
|
А24 |
S 1547 |
0.7150 |
А3 |
S 617 |
–0.5285 |
|
А23 |
H 1547 |
0.6954 |
А29 |
H 2929 |
–0.5632 |
|
А15 |
S 1315 |
0.6498 |
А30 |
S 2929 |
–0.5786 |
|
А14 |
H 1315 |
0.5625 |
А13 |
X 1315 |
–0.5805 |
|
А31 |
X 2960 |
–0.5385 |
А9 |
S 1156 |
–0.8805 |
|
А10 |
X 1236 |
–0.6526 |
А8 |
H 1156 |
–0.9128 |
|
А22 |
X 1547 |
–0.6858 |
А16 |
X 1407 |
–0.8610 |
Максимальный вклад в разделение вносят характеристики ПП валентных и деформационных колебаний метильных и метиленовых групп в структуре червей (2 960, 2 929 и 1 455 см–1) и амидных групп (1 547, 1 407, 1 315 и 1 236 см–1). Разделение подгрупп A. caliginosa + O. lacteum E. fetida + E. nordenskioldi + L. rubellus и от R. diplotetrathecus + E. ventripapillata определяется ПП 2 960, 2 929, 1 315, 1 156, 1 080 и 617 см–1, причем здесь отмечена противоположная тенденция: положительные коэффициенты корреляции выявлены для положения ПП, отрицательные – для высот и площадей ПП. Помимо ПП валентных и деформационных колебаний метильных и метиленовых групп в разделение вносят вклад ПП коллагена и фосфодиэфирных групп нуклеиновых кислот (1 156, 1 080 и 617 см–1).
Можно было предположить, что дождевые черви могли бы разделиться согласно принадлежности к экологическим группам в соответствии с классификацией экологических категорий Буше [Bouche, 1972], как это произошло в исследовании Фама с соавторами [Pham et al., 2021], когда эпианекический L. terrestris был отделен от двух эндогейных видов ( A. caliginosa и A. icterica ) и промежуточного вида A. chlorotica по первой дискриминантной функции. В нашем исследовании такого разделения закономерно не произошло (см. рис. 4), так как при разработке экологической классификации дождевых червей Буше учитывал морфо-анатомические признаки и экологию [Botinelli et al., 2020] и не учитывал сложный химический состав тела. Таким же образом, экологические категории не отражают влияния дождевых червей на показатели почвы [van Groenigen et al., 2019; Bottinelli, Capowiez, 2021] или же состав производимых ими копролитов [Babiy et al., 2021].
Заключение
В настоящем исследовании показана принципиальная возможность таксономической идентификации дождевых червей на основании изучения функционально-группового состава их тел методом ИК-Фурье спектроскопии. Основные отличия наблюдаются для ПП 617 см–1, 1 053–1 080 см–1 и 1 619–1 638 см–1. ПП 1 053 см–1, которая появляется дополнительно на ИК-спектрах червей видов R. diplotetrathecus и E. ventripapillata, соответствует колебаниям νC-O и δC-O углеводов. При этом для увеличения точности определения видовой принадлежности данным методом необходимо выявить специфические особенности для каждого вида дождевого червя, что планируется сделать на следующем этапе исследования. Для достижения этой цели имеет смысл увеличить размер выборки для получения более точных маркерных характеристик. При этом, возможно, стоит анализировать червей с разных почв и на разных подстилках, чтобы получить надежные маркеры. Другой возможный вариант предполагает выявление специфической части тела дождевого червя, анализ которой даст более четкие видовые признаки и не потребует анализа всего дождевого червя в целом. Например, если функционально-групповой состав кожно-мускульного мешка будет более видоспецифичным, то это позволит улучшить качество таксономической идентификации.
Список литературы Исследование различий ИК-спектров дождевых червей как возможный способ их таксономической идентификации
- Перель Т.С. Распространение и закономерности распределения дождевых червей фауны СССР. М.: Наука, 1979. 272 с.
- Перель Т.С. Особенности фауны дождевых червей (Oligochaeta, Lumbricidae) в Алтайских рефуги-умах неморальной растительности // Доклады Академии наук СССР. 1985. Т. 283, № 3. С. 752-756.
- Aw W.C., Dowell F.E., Ballard J.W. Using near-infrared spectroscopy to resolve the species, gender, age, and the presence of Wolbachia infection in laboratory-reared Drosophila // G3 (Bethesda). 2012. Vol. 2, № 9. P. 1057-1065. DOI: 10.1534/g3.112.003103.
- Babiy K.A. et al. What determines ion content of lumbricid casts: soil type, species, or ecological group? // Polish Journal of Ecology. 2021. Vol. 69, № 2. P. 96-110. DOI: 10.3161/15052249PJE2021.69.2.003.
- Blouin M. et al. A review of earthworm impact on soil function and ecosystem services: earthworm impact on ecosystem services // European Journal of Soil Science. 2013. Vol. 64. P. 161-182. DOI: 10.1111/ejss.12025.
- Bottinelli N. et al. An explicit definition of earthworm ecological categories - Marcel Bouché's triangle revisited // Geoderma. 2020. Vol. 372. DOI: 10.1016/j.geoderma.2020.114361.
- Bottinelli N., Capowiez Y. Earthworm ecological categories are not functional groups // Biology and Fertility of Soils. 2021. Vol. 57. P. 329-331. DOI: 10.1007/s00374-020-01517-1.
- Bouché M. Lombriciens de France. Ecologie et Systématique. Paris: INRA, 1972. 671 p.
- Csuzdi C., Koo J., Hong Y. The complete mitochondrial DNA sequences of two sibling species of lumbricid earthworms, Eisenia fetida (Savigny, 1826) and Eisenia andrei (Bouché, 1972) (Annelida, Crassiclitellata): comparison of mitogenomes and phylogenetic positioning // ZooKeys. 2022. Vol. 1097. P. 167-181. DOI: 10.3897/zookeys. 1097.80216.
- Da Silva R., Gutjahr A., De Morais J. Solving taxonomic Orthoptera problems by near infrared reflectance spectroscopy (NIRS): The case of Aganacris Walker, 1871 (Tettigoniidae: Phaneropterinae; Scudderini) // Zootaxa. 2018. Vol. 4461. P. 445-450. . DOI: 10.11646/ zoota xa.4464.3.10.
- de Azevedo R.A. et al. Discrimination of termite species using near-infrared spectroscopy (NIRS) // European Journal of Soil Biology. 2019. Vol. 93. 103084. DOI: 10.1016/j.ejsobi.2019.04.002.
- Gautier M. et al. The genomic basis of color pattern polymorphism in the harlequin ladybird // Current Biology. 2018. Vol. 28. e3297. DOI: 10.1016/j.cub.2018.08.023.
- Johnson J.B. Discrimination of Gonipterini weevil genera using near infrared spectroscopy // Journal of Near Infrared Spectroscopy. 2022. Vol. 30, № 5. P. 264-269. DOI: 10.1177/09670335221117300.
- Jouquet P. et al. Potential of near infrared reflectance spectroscopy (NIRS) for identifying termite species // European Journal of Soil Biology. 2014. Vol. 60. P. 49-52. DOI: 10.1016/j.ejsobi.2013.11.004.
- Jouquet P. et al. Evidence from mid-infrared spectroscopy (MIRS) that the biochemical fingerprints of Odontotermes obesus colonies change according to their geographical location and age // Insectes Sociaux. 2018. Vol. 65. P. 77-84. DOI: 10.1007/s00040-017-0589-0.
- Latif R., Malek R., Csuzdi C. When morphology and DNA are discordant: Integrated taxonomic studies on the Eisenia fetida/andrei complex from different parts of Iran (Annelida, Clitellata: Megadrili) // European Journal of Soil Biology. 2017. Vol. 81. P. 55-63. DOI: 10.1016/j.ejsobi.2017.06.007.
- Lavelle P. et al. Ecosystem engineers in a self-organized soil: A review of concepts and future research questions // Soil Science. 2016. Vol. 181, № 3-4. P. 91-109. DOI: 10.1097/SS.0000000000000155.
- Lê S., Josse J., Husson F. FactoMineR: An R package for multivariate analysis // Journal of Statistical Software. 2008. Vol. 25, № 1. P. 1-18. DOI: 10.18637/jss.v025.i01.
- Lubbers I.M. et al. Greenhouse-gas emissions from soils increased by earthworms // Nature Climate Change. 2013. Vol. 3. P. 187-194. DOI: 10.1038/nclimate1692.
- Movasaghi Z., Rehman S., ur Rehman I. Fourier transform infrared (FTIR) spectroscopy of biological tissues // Applied Spectroscopy Reviews. 2008. Vol. 43, № 2. P. 134-179. DOI: 10.1080/05704920701829043.
- Pham T. et al. Mid-infrared spectroscopy of earthworm bodies to investigate their species belonging and their relationship with the soil they inhabit // Applied Soil Ecology. 2021. Vol. 162. 103894. DOI: 10.1016/j.apsoil.2021.103894
- Raupach M.J. et al. The application of "-omics" technologies for the classification and identification of animals // Organisms Diversity & Evolution. 2016. Vol. 16. P. 1-12. DOI: 10.1007/s13127-015-0234-6.
- Richard B. et al. Reintegrating earthworm juveniles into soil biodiversity studies: species identification through DNA barcoding // Molecular Ecology Resources. 2010. Vol. 10. P. 606-614. DOI: 10.1111/j.1755 -0998.2009.02822.x.
- Rodríguez-Fernández J.I. et al. Barcoding without DNA? Species identification using near infrared spectroscopy // Zootaxa. 2010. Vol. 2933. P. 46-54. DOI: 10.11646/zootaxa.2933.1.3.
- Shekhovtsov S.V. et al. Cryptic genetic lineages in Eisenia nordenskioldi pallida (Oligochaeta, Lumbri-cidae) // European Journal of Soil Biology. 2016. Vol. 75. P. 151-156. DOI: 10.1016/j.ejsobi.2016.06.004.
- Shekhovtsov S.V. et al. DNA barcoding: how many earthworm species are there in the south of West Siberia? // Russian Journal of Genetics: Applied Research. 2017. Vol. 7, № 1. P. 57-62. DOI: 10.1134/S2079059717010130.
- Sikulu M.T. Non-destructive near infrared spectroscopy for simultaneous prediction of age and species of two major African malaria vectors: An. gambiae and An. Arabiensis // NIR News. 2014. Vol. 25, № 5. P. 4-6. DOI: 10.1255/nirn.1455.
- Srivathsan A. et al. 1D MinlON Sequencing for large-scale species discovery: 7000 scuttle flies (Diptera: Phoridae) from one site in Kibale national park (Uganda) revealed to belong to> 650 species // bioRxiv. 2019. 622365. DOI: 10.1101/622365.
- Tao D. et al. Accurate identification of the sex and species of silkworm pupae using near infrared spectroscopy // Journal of Applied Spectroscopy. 2018. Vol. 85. P. 949-952. DOI: 10.1007/s10812-018-0744-z.
- Tiunov A.V. et al. Invasion patterns of Lumbricidae into the previously earthworm-free areas of northeastern Europe and the western Great Lakes region of North America // Biological Invasions. 2006. Vol. 8. P. 1223-1234. DOI: 10.1007/s10530-006-9018-4.
- van Groenigen J.W. et al. How fertile are earthworm casts? A meta-analysis // Geoderma. 2019. Vol. 338. P. 525-535. DOI: 10.1016/j.geoderma.2018.11.001.
- Vance C.K. et al. Near infrared spectroscopy in wildlife and biodiversity // Journal of near Infrared Spectroscopy. 2016. Vol. 24. P. 1-25. DOI: 10.1255/jnirs.1199.
- Vaupel A., Hommel B., Beule L. High-resolution melting (HRM) curve analysis as a potential tool for the identification of earthworm species and haplotypes // PeerJ. 2022. Vol. 10. e13661. DOI: 10.7717/peerj.13661.
- Velasquez E. et al. This ped is my ped: Visual separation and near infrared spectra allow determination of the origins of soil macroaggregates // Pedobiologia. Vol. 51, № 1. 2007. P. 75-87. DOI: 10.1016/j.pedobi.2007.01.002.
- Vorobeichik E. et al. Long-term dynamics of the abundance of earthworms and enchytraeids (Annelida, Clitellata: Lumbricidae, Enchytraeidae) in forests of the Central Urals, Russia // Biodiversity Data Journal. 2021. Vol. 9. e75466. DOI: 10.3897/BDJ.9.e75466.


