Исследование реакции тканей лабораторных животных на имплантацию новых образцов сосудистых эндопротезов
Автор: Иванов А.В., Липатов В.А., Лазаренко С.В., Жердев Н.Н., Северинов Дмитрий Андреевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Сосудистая хирургия
Статья в выпуске: 2 т.20, 2016 года.
Бесплатный доступ
Актуальность. В статье рассмотрена одна из актуальных проблем ангиохирургии - выбор пластического материала для реконструктивно-восстановительных оперативных вмешательств. Цель. Изучить реакцию биологических тканей на имплантацию сосудистых эндопротезов. Материал и методы. Для исследования использовали основовязаное лавсановое полотно и вязаный двойной велюровый сосудистый эндопротез, изготовленный из волокон полиэстера и пропитанный модифицированным желатином. Исследования проводили на б0 крысах линии Вистар массой 2ОО-25О г (самцы) без внешних признаков заболеваний. Животных разделили на 4 группы соответственно числу фирм-производителей и срокам выведения из эксперимента (15-е и 30-е сут.). В стерильных условиях операционного блока под общим наркозом крысам рассекали кожный и подкожно-жировой слои по паравертебральной линии. Тупым путем формировали два кармана в подкожной клетчатке глубиной 3,5 см, куда помещали образец сосудистой заплаты. Операционную рану ушивали наглухо с захватом мышечного слоя. Гистологические препараты изготавливали по стандартным методикам, окрашивали гематоксилин-эозином и по Маллори. На микрофотографиях оценивали строение перипротезной капсулы, а также состав клеточного слоя капсулы. В каждой из групп мы оценивали клеточный индекс - отношение клеток фибробластического ряда к клеткам воспалительного инфильтрата. Показатель более 1 свидетельствовал о преобладании репаративных тенденций, менее 1 - о превалировании воспалительных изменений. Статистическую обработку полученных данных проводили с применением методик описательной и вариационной статистики. Результаты. Смена фаз воспалительной реакции протекает быстрее в зоне имплантации лавсановых заплат, что проявляется достоверным увеличением количества клеток-резидентов с 62,4 до 8О,5% и уменьшением клеток-нерезидентов в 1,7 раза на тех же сроках соответственно. Реакция тканей более выражена на полиэстеровый имплант, это подтверждается незначительным снижением с 53,5 до 43,7% количества клеток воспалительного инфильтрата, ростом клеток фибробластического ряда с 46,5% (15-е сут.) до 5б,3% (30-е сут.). Заключение. Реакция тканей лабораторных животных менее выражена на основовязаный лавсановый имплант. Эндоваскулярное закрытие может служить альтернативой и позволяет избежать открытой операции у пациентов с выраженной сопутствующей патологией и подходящей анатомией. Однако внутрибольничная летальность остается высокой, даже после успешной имплантации окклюдера.
Имплантация, эндопротез, лавсан, сосудистая хирургия, биосовместимость
Короткий адрес: https://sciup.org/142140747
IDR: 142140747 | DOI: 10.21688-1681-3472-2016-2-87-94
Текст научной статьи Исследование реакции тканей лабораторных животных на имплантацию новых образцов сосудистых эндопротезов
Имплантация • Эндопротез • Лавсан • Сосудистая хирургия • Биосовместимость
В настоящее время в Российской Федерации в структуре общей заболеваемости болезни сердечно-сосудистой системы составляют 14,2%, в структуре смертности населения от наиболее распространенных причин – 53,2%. Такие вы- сокие показатели позволяют прогнозировать в ближайшие годы значительный рост числа пациентов с этой патологией [1]. Категория граждан, страдающих сердечно-сосудистыми заболеваниями и нуждающихся в медицинской, в боль-

Статья доступна по лицензии Creative Commons Attribution 4.0.
шинстве случаев именно хирургической, помощи, требует пристального внимания врачей-специалистов узкого профиля – кардиологов и сердечно-сосудистых хирургов [2]. Стоит отметить, что для каждой отдельно взятой реконструктивно-восстановительной операции выбирают подходящий кондуит в частном порядке – с учетом индивидуальных особенностей организма пациента.
В связи с этим одной из актуальных междисциплинарных проблем является разработка качественного и доступного пластического материала для закрытия поврежденного участка сосудистого русла. В первую очередь это связано с высокой ценой материалов, которую устанавливают фирмы-изготовители. В России такой дефицит также обусловлен тем, что отечественные производители не имеют возможности предоставить необходимое количество сосудистых эндопротезов ангиохирургам [3].
Решение проблемы состоит в разработке и внедрении в хирургическую практику новых образцов сосудистых эндопротезов, способствующих благополучному течению послеоперационного периода и посттравматическому восстановлению сосудистой стенки [4].
Попытки сформулировать характеристики так называемого идеального протеза были предприняты уже во второй половине XX века (период становления сосудистой хирургии) [5]. Такой имплантат должен:
-
• быть доступен для хирурга во всем ассортименте размеров и длин;
-
• подходить для использования в любом участке тела;
-
• выдерживать долговременную имплантацию в организм и не обладать токсическими или аллергическими побочными эффектами [6, 7];
-
• обладать достаточной эластичностью, адаптивностью, гибкостью;
-
• легко прошиваться и при этом не травмироваться;
-
• исключать возможность разволокнения линии отреза протеза и образования жестких складок в местах изгиба [8, 9];
-
• иметь гладкую, атравматичную для форменных элементов крови, атромбогенную и резистентную к инфекции поверхность просвета [10];
-
• обладать возможностью многократной стерилизации [11].
Однако ни один из представленных на сегодняшний день протезов, как синтетического, так и органического происхождения, не имеет всех вышеперечисленных характеристик [12, 13].
Для решения этих проблем ведущие отечественные и зарубежные фирмы-производители медицинских изделий и материалов разрабатывают новые сосудистые имплантаты и заплаты (как правило на основе полимерных волокон), требующие изучения и экспериментальной апробации для определения их безопасности и клинической состоятельности [14].
Цель: исследовать реакцию биологических тканей на имплантацию сосудистых эндопротезов в эксперименте in vivo .
Материал и методы
В качестве материала для исследования использовали имплант фирмы «Линтекс» (Санкт-Петербург, Россия) – основовязаное лавсановое полотно, а также образец фирмы B.Braun (Мелзунген, Германия), представляющий собой вязаный двойной велюровый сосудистый эндопротез, изготовленный из волокон полиэстера и пропитанный модифицированным желатином.
Исследования проводили на 60 крысах линии Вис-тар массой 200–250 г (самцы) без внешних признаков заболеваний, прошедших карантин и содержащихся в условиях экспериментально-биологической клиники Курского государственного медицинского университета. Распределение лабораторных животных по группам исследования представлено ниже.
|
Группа наблюдения Подгруппа наблюдения (образец материала) (срок выведения из эксперимента) Подгруппа 1.1 Группа 1 15-е сут., n = 15 «Линтекс» Подгруппа 1.2 30-е сут., n = 15 Подгруппа 2.1 Группа 2 15-е сут. , n = 15 B.Braun Подгруппа 2.2 30-е сут., n = 15 |
Под общим наркозом с соблюдением международных норм гуманного обращения с животными (Европейская конвенция «О защите позвоночных животных, используемых для экспериментов или в иных научных целях», Страсбург, 1986) в стерильных условиях операционного блока кафедры оперативной хирургии и топографической анатомии им. профессора А.Д. Мясникова Курского государственного медицинского университета крысам по паравертебральной линии рассекали кожный и подкожно-жировой слои. Тупым путем на протяжении всего разреза формировали два кармана в подкожно-жировой клетчатке глубиной 3,5 см. В каждый карман помещали образец сосудистой заплаты размерами 2 х 2 см. Операционную рану ушивали наглухо с захватом мышечного слоя с целью изоляции сформированных карманов, содержащих экспериментальные образцы. Послеоперационную рану обрабатывали антисептиками.
Животных выводили из эксперимента передозировкой наркоза. В каждом случае проводили аутопсию: иссекали участок справа и слева от позвоночника в местах размещения имплантатов с захватом мышечной ткани. Полученный биоматериал фиксировали в 10%-м буферном нейтральном формалине в течение 7 сут. По стандартной методике изготавливали парафиновые блоки и микропрепараты. Гистологические препараты окрашивали гематоксилин-эозином и по Маллори.
Микроскопирование препаратов выполняли посредством световой микроскопии с помощью микроскопа Livenhuk 320 при увеличениях х 100 и 400. Для морфометрической оценки фотографировали препараты с использованием цифровой насадки Livenhuk c310 и программы Scope Tek ScopePhoto (версия х 86, 3.1.268).
На полученных микрофотографиях оценивали строение соединительно-тканной капсулы, выраженность ее слоев и степень зрелости коллагеновых волокон. Также исследовали состав клеточного слоя капсулы, расположенного непосредственно вокруг нитей протеза.
В каждой из групп экспериментального исследования оценивали клеточный индекс (КИ) — отношение клеток фибробластического ряда (резидентов) к клеткам воспалительного инфильтрата (нерезидентам).
Формула, по которой рассчитывали КИ:
клетки - резиденты
Клеточный индекс (КИ) = ________________ , клетки - нерезиденты где: клетки-резиденты – общее количество макрофагов, фибробластов и фиброцитов; клетки-нерезиденты – общее количество лейкоцитов в клеточном слое капсулы.
При КИ <1 делали вывод о преобладании воспалительных изменений, характерных для I фазы течения раневого процесса, при КИ >1 – о преобладании репаративных тенденций, характерных для II фазы согласно М.И. Кузину [15].
Статистическую обработку полученных результатов проводили с применением методик описательной (расчет средних арифметических, стандартных отклонений и средних ошибок средних) и вариационной статистики. Для определения достоверности отличий средних применяли непараметрический критерий Манна – Уитни. Статистически достоверными считали различия средних арифметических, если р<0,05. В качестве программной среды для обработки данных использовали программу Statistica (версия 6.0).
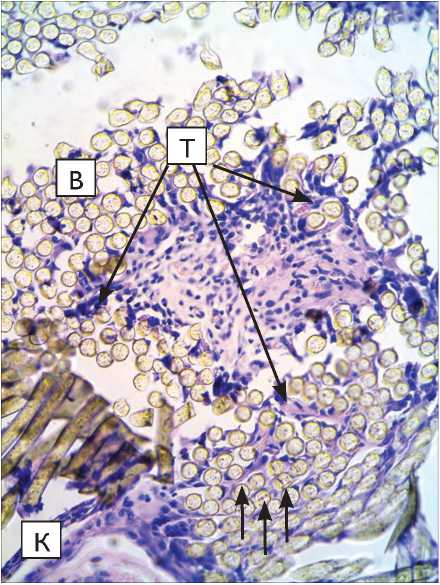
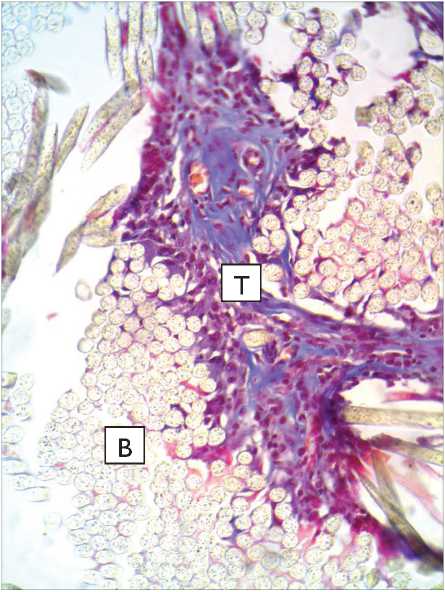
Рис. 1. Капсула вокруг протеза из материала «Линтекс» на 15-е сут. после имплантации в паравертебральную область (микрофото): а – окраска гематоксилин-эозином; б – окраска по Маллори. Микрофото. Ув. х 400. Длинные стрелки указывают на трабекулы, отходящие от капсулы внутрь пучка волокон, короткие – на участок со сниженной оксифилией.
Fig. 1. Capsule around “Lintex”tissue-based prosthesis at 15 days after implantation in the paravertebral site (microphotograph): a – hematoxylin-eosin stain; б – Mallory stain; Microphotograph. Magnification x 400. K – tissue-connective capsule; B – prosthesis fibers. The long arrows point to trabecules outgoing from the capsule into the fiber band, the short ones show the area with decreased oxyphillia
Таблица 1 Соотношение различных типов клеток в клеточном слое перипротезной капсулы на 15-е сут. после имплантации
|
Образец |
Величина |
Фибробласты |
Фиброциты |
Лимфоциты |
Макрофаги |
Нейтрофилы |
Эозинофилы |
Моноциты |
|
М |
32,7 |
29,7 |
10,6 |
5 |
9,3 |
3,8 |
8,9 |
|
|
«Линтекс» |
м |
2,54 |
2,31 |
2,27 |
2,16 |
2,0 |
1,62 |
2,02 |
|
СОС |
0,44 |
0,42 |
0,69 |
0,97 |
0,66 |
0,83 |
0,68 |
|
|
М |
17,1 |
19,4 |
20,8 |
12,1 |
14,1 |
7,1 |
9,4 |
|
|
B.Braun |
м |
2,63 |
2,58 |
3,99 |
2,47 |
2,47 |
2,12 |
2,01 |
|
СОС |
0,68 |
0,62 |
0,74 |
0,78 |
0,78 |
0,7 |
0,66 |
|
|
P_1 |
0,000 |
0,000 |
0,000 |
0,119 |
0,661 |
0,000 |
0,009 |
М – среднее значение; м – стандартное отклонение; СОС – средняя ошибка средней арифметической; P_1 – достоверность отличия средних значений количества различных типов клеток при имплантации материалов фирм «Линтекс» по отношению к B.Braun
Результаты
При исследовании микропрепаратов подгруппы 1.1 установлено, что у всех животных вокруг протеза сформирована мощная капсула, имеющая неодинаковую толщину на всем протяжении и выраженную двухслойную организацию. Наружный слой капсулы представлен плотной волокнистой соединительной тканью (ПВСТ), состоящей из параллельно ориентированных пучков коллагеновых волокон, среди которых ядра механоцитов округло-овальной или вытянутой формы (рис. 1).
Следует отметить, что внутрь протеза от волокнистого слоя капсулы отходят трабекулы, также организованные из ПВСТ, и «разделяющие» пучки волокон протеза, окружаю- щие отдельные нити протеза. Меньшая оксифилия пучков волокон позволяет сделать вывод о меньшей степени зрелости коллагена в трабекулах по сравнению с наружным слоем капсулы. На всех без исключения препаратах не удается определить границу между волокнистым слоем капсулы и фасциями окружающих ее мышц. Это свидетельствует о завершенности интеграции капсулы в соединительно-тканную строму паравертебральной области лабораторных животных.
Клеточный состав капсулы показывает, что более половины (62,4%) общего количества клеток составляют фибробласты и фиброциты соответственно. Общее количество фагоцитирующих клеток и их предшественников достигает 27,6% (табл. 1).
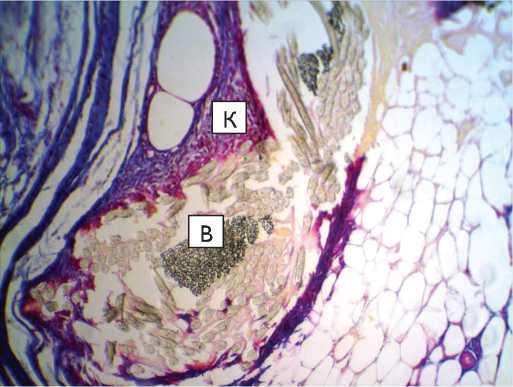
Рис. 2. Капсула вокруг протеза из материала фирмы B.Braun на 15-е сут. после имплантации в паравертебральную область: а – окраска по Маллори; б – окраска гематоксилин-эозином. Микрофото. Ув. х 400. К – перипротезная капсула; В – волокна протеза. Стрелкой указаны «выстоящие» нити импланта, деформирующие капсулу
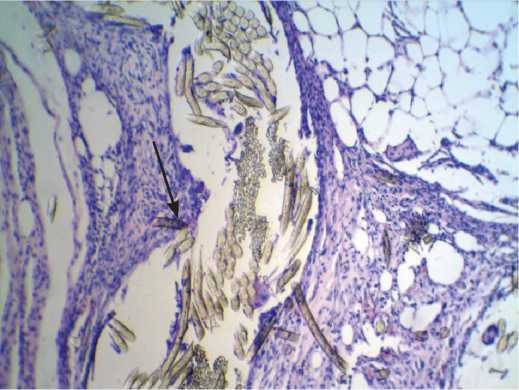
Fig. 2. Capsule around B. Braun Company’s tissue-based prosthesis at 15 days after implantation in the paravertebral site: a – Mallory stain; б – hematoxylin-eosin stain. Microphotograph. Magnification x 400. K – tissue-connective capsule; В – prosthesis fibers. The arrow points to protruding strands of the implant distorting the capsule
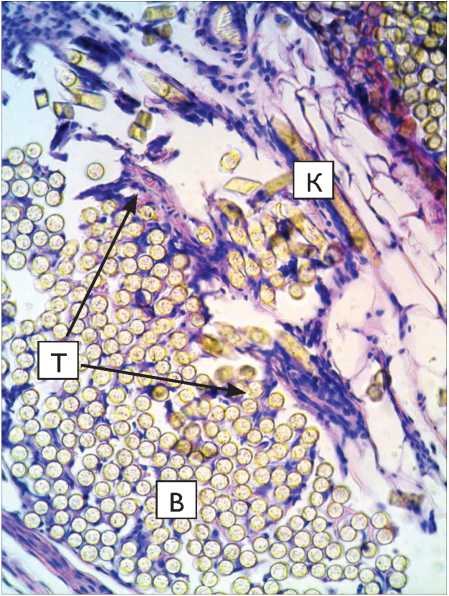
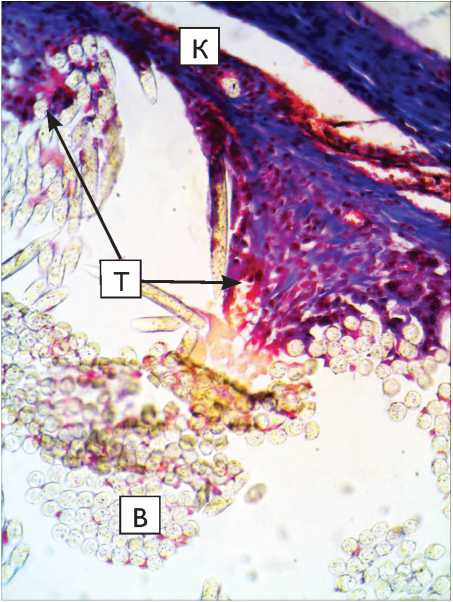
Рис. 3. Капсула вокруг протеза из материала «Линтекс» на 30-е сут. после имплантации в паравертебральную область: а – окраска гематоксилин-эозином; б – окраска по Маллори. Микрофото. Ув. х 400. К – перипротезная капсула; В – волокна протеза. Трабекулы, отходящие от капсулы внутрь пучка волокон, указаны длинными стрелками, участок со сниженной оксифилией – короткими)
Fig. 3. Capsule around “Lintex” tissue-based prosthesis at 30 days after implantation in the paravertebral site (microphotograph): a – hematoxylin-eosin stain; б – Mallory stain; Microphotograph. Magnification x 400. K – tissue-connective capsule; B – prosthesis fibers. The trabecules outgoing from the capsule into the fiber band are indicated with long arrows, while short arrows show the area with decreased oxyphillia
Микроскопирование гистологических препаратов животных, которым в паравертебральную область имплантировали протез фирмы B.Braun (подгруппа 2.1), показало, что материал импланта также покрыт капсулой из ПВСТ, фиксирующей и одновременно отграничивающей его от окружающих структур (рис. 2).
У всех животных этой подгруппы на поверхности капсулы, обращенной к коже, и на противоположной стороне обнаруживаются «выстоящие» нити материала, которые деформируют капсулу в местах контакта. Оказываемое давление настолько велико, что приводит к изменению строения пучков волокон в таких местах: обычно здесь отсутствуют ядра клеток, а пучки коллагеновых волокон окрашиваются неравномерно. В указанных местах отмечается реорганизация волокнистого слоя капсулы, что подтверждается неравномерностью ее окраски (см. рис. 5).
В местах, где отсутствуют «выстоящие» нити импланта и, соответственно, механическая деформация капсулы, также нет очагов экссудации полиморфноядерных лимфоцитов. Относительное количество клеток фибробластического ряда в данном материале составляет 36,5%, доля клеток-нерезидентов – 63,5% (табл. 1).
При исследовании препаратов животных подгруппы 1.2 (материал «Линтекс», срок 30 сут.) установлено, что у всех животных вокруг протеза была сформирована мощная пери- протезная капсула, имеющая неодинаковую толщину на протяжении и выраженную двухслойную организацию (рис. 3).
Следует отметить, что морфологические изменения в подгруппе 1.2 соответствуют таковым в подгруппе 1.1 и имеют ряд особенностей: выраженность и большее число соединительно-тканных трабекул, окрасившихся менее интенсивно, чем на 15-е сут., а также – дифференцированных клеток фибробластического ряда (фиброцитов).
В этой подгруппе эксперимента 80,5% составили клетки-резиденты ряда, общее количество фагоцитирующих клеток и их предшественников – 19,5% соответственно (табл. 2).
Исследование микропрепаратов экспериментальной подгруппы животных, выведенных на 30-е сут. (материал B.Braun), показало, что в данной подгруппе, в отличие от подгруппы 2.1 (срок выведения 15 сут., материал B.Braun), обнаруживается гораздо более плотная соединительнотканная капсула, продолжающая деформироваться, но имеющая более выраженное деление на слои. Волокнистый слой капсулы качественно не отличается от такового на предыдущем сроке исследования (при имплантации аналогичного материала). Показатели подсчета относительного количества клеток: клетки фибробластического ряда – 56,3%, клетки-нерезиденты – 43,7% (табл. 2).
Такое изменение количественного и качественного состава слоев перипротезной капсулы говорит о том,
а
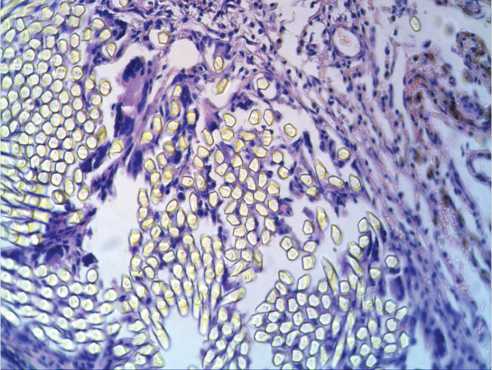
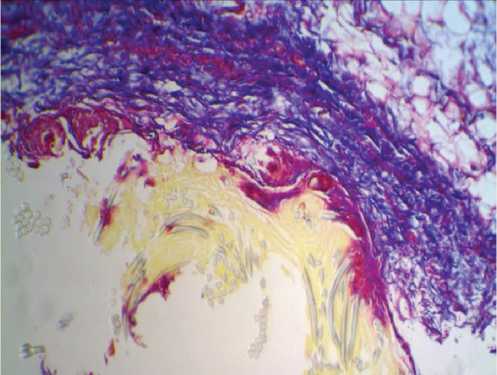
Рис. 4. Капсула вокруг протеза из материала B.Braun на 30-е сут. после имплантации в паравертебральную область: а – окраска гематоксилин-эозином; б – окраска по Маллори. Микрофото. Ув. х 100. К – перипротезная капсула; В – волокна протеза
Fig. 4. Capsule around B. Braun Company’s tissue-based prosthesis at 30 days after implantation in the paravertebral site: a – hematoxylin-eosin stain; б – Mallory stain. Microphotograph. Magnification x 100. K – tissuye-connective capsule; B – prosthesis fibers что на 30-е сут. после имплантации сосудистых протезов в паравертебральную область происходит становление пролиферативной фазы воспалительного процесса, что подтверждает увеличение числа дифференцированных клеток относительно более раннего срока выведения животных из эксперимента (15-е сут.).
Вычисления КИ проводили с целью объективного сравнения реакции тканей лабораторных животных на имплантируемые материалы. Результаты подсчета КИ представлены в табл. 3.
Согласно полученным данным, наибольшее значение КИ отмечается при имплантации протезов фирмы «Лин-текс» на 30-е сут. – 5,54, а КИ фирмы B.Braun имеет практически в 3 раза меньшее значение. Таким образом, при имплантации лавсановых имплантатов более выраженны процессы пролиферации, в случае использования имплантатов из полиэстера преобладают процессы экссудации.
Обсуждение
Ответная реакция соединительной ткани на инородное тело из синтетических материалов достаточно изучена. Установлено, что вокруг синтетического импланта по завершении воспалительного процесса и ремоделирования соединительно-тканных структур капсула должна обладать сравнительно небольшой толщиной [15]. Также такая капсула, как правило, характеризуется преобладанием волокнистых элементов матрикса (зрелых фибробластов) над другими клеточными элементами, выраженной пространственной организацией волокон, небольшим количеством
Таблица 2 Соотношение различных типов клеток в клеточном слое перипротезной капсулы на 30-е сут. после имплантации
|
Образец |
Величина |
Фибробласты |
Фиброциты |
Лимфоциты |
Макрофаги |
Нейтрофилы |
Эозинофилы |
Моноциты |
|
М |
35,7 |
44,8 |
4,9 |
4,2 |
4,7 |
2,4 |
3,3 |
|
|
«Линтекс» |
м |
2,5 |
2,44 |
1,26 |
0,92 |
1,05 |
1,07 |
0,95 |
|
СОС |
0,5 |
0,32 |
0,53 |
0,62 |
0,61 |
0,69 |
0,52 |
|
|
М |
23,9 |
32,4 |
11,5 |
6,8 |
8,3 |
6,3 |
7,8 |
|
|
B.Braun |
м |
1,92 |
3,38 |
2,34 |
0,98 |
1,42 |
1,41 |
2,63 |
|
СОС |
0,36 |
0,52 |
0,80 |
0,95 |
0,68 |
0,71 |
1,06 |
|
|
P_2 |
0,001 |
0,001 |
0,001 |
0,201 |
0,323 |
0,001 |
0,013 |
М – среднее значение; м – стандартное отклонение; СОС – средняя ошибка средней арифметической; P_2 – достоверность отличия средних значений количества различных типов клеток при имплантации материалов фирм «Линтекс» по отношению к B.Braun
Таблица 3 Показатели клеточного индекса при подкожной имплантации образцов сосудистых заплат
|
Образец |
Величина |
15-е сут. |
30-е сут. |
|
М |
2,13 |
5,54 |
|
|
«Линтекс» |
м |
0,89 |
1,35 |
|
СОС |
0,18 |
0,24 |
|
|
М |
0,94 |
1,95 |
|
|
B.Braun |
м |
0,38 |
0,73 |
|
СОС |
0,08 |
0,14 |
|
|
P_2 |
0,000 |
0,000 |
М – среднее значение; м – стандартное отклонение;
СОС – средняя ошибка средней арифметической;
P_3 – достоверность отличия средних значений КИ при имплантации материалов фирм «Линтекс» по отношению к B.Braun сосудов, очень узким макрофагальным барьером на границе капсулы и импланта [14].
Считается, что данная структура при отсутствии воздействия неблагоприятных факторов может существовать неопределенный период времени, находясь в состоянии динамического равновесия, когда скорости синтеза волокнистого каркаса капсулы и его катаболизма уравновешены [6]. Напротив, если имплант состоит из биодеградируемого материала, макрофагальная реакция усиливается, так как макрофаги и гигантские клетки инородных тел фагоцитируют эти материалы [12]. В зависимости от выраженности макрофагальной реакции, скорости рекрутизации моноцитов в очаг воспаления, наличия и степени развития путей эвакуации макрофагов скорость биодеградации сильно варьирует, но всегда заканчивается полным замещением материала импланта соединительной тканью [3]. Результат такой гистотипической регенерации на месте дефекта подвергается инволюции вследствие ремоделирования, или же на его месте полностью или частично регенерирует специализированная ткань [8, 9].
При оценке особенностей клеточного состава слоев пе-рипротезной капсулы во всех экспериментальных группах мы обнаружили, что сравниваемые материалы обладают разной биологической инертностью. Оптимальными показателями биологической инертности обладает материал отечественной фирмы-производителя: вокруг волокон протеза общее количество фагоцитирующих клеток инфильтрата минимально, а его качественные характеристики свидетельствуют об их меньшей активности (низкая степень полиплоидии, размерность, небольшое количество). Сосудистые протезы на основе лавсановых волокон отечественного производства являются конкурентноспособными и могут быть рекомендованы для дальнейшего использования сосудистыми хирургами в качестве пластического материала для проведения реконструктивно-восстановительных оперативных вмешательств.
Выводы
-
1. Смена фаз слабовыраженной воспалительной реакции протекает быстрее в зоне имплантации лавсановых заплат фирмы «Линтекс», что проявляется достоверным (р<0,05) увеличением количества клеток-резидентов с 62,4% (15-е сут.) до 80,5% (30-е сут.) и уменьшением клеток-нерезидентов в 1,7 раза на тех же сроках соответственно.
-
2. Реакция тканей более выраженна на полиэстеровый имплант B.Braun, это подтверждается незначительным снижением – с 53,5% (15-е сут.) до 43,7% (30-е сут.) – количества клеток воспалительного инфильтрата, ростом клеток фибробластического ряда с 46,5% (15-е сут.) до 56,3% (30-е сут.).
-
3. Показатели клеточного индекса в местах размещения имплантов B.Braun в 1,6 раза (30-е сут.) меньше, чем у заплат фирмы «Линтекс», а на 15-е сут. более чем в 2,8 раза.
-
4. Наибольшие показатели клеточного индекса отмечаются на 30-е сут. после имплантации лавсанового протеза в паравертебральную область, что говорит о его высоком качестве и порозности. Это способствует оптимальному течению процессов интеграции заплат в сосудистую стенку и позволяет минимизировать реакцию тканей организма на имплантацию.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Исследование реакции тканей лабораторных животных на имплантацию новых образцов сосудистых эндопротезов
- Розанова И.А., Повещенко О.В., Карпенко А.А., Павлова С.В., Сергеевичев Д.С., Лыков А.П., Бондаренко Н.А., Докучаева А.В. Разработка и изучение in vitro тканеинженерной конструкции на основе политетрафторэтилена и мезенхимальных мультипотентных стромальных клеток (сообщение № 1)//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 4-2. С. 20-27.
- Глянцев С.П., Щелкунов Н.Б., Гекова Т.Ю. Эволюция инноваций в сосудистой хирургии//Верхневолжский медицинский журнал. 2013. Т. 11. № З. С. 4-1О.
- Лызиков А.А. Применение искусственных протезов при реконструкциях сосудов//Новости хирургии. 2010. Т. 18. № 4. С. 1З5-145.
- Герасимов А.А., Жеребятьева С.Р. Проблема выбора пластического материала для реконструктивно-восстановительных операций на магистральных артериях: современное состояние проблемы//Eruditio Juvenium. 2014. № 2. С. 107-116.
- Vu Q., Xie K., Eckert M., Zhao W., Cramer S.C. Meta-analysis of preclinical studies of mesenchymal stromal cells for ischemic stroke//Neurology. 2014. Vol. 82. № 14. P. 1277-1286. DOI: 10.1212/WNL.0000000000000278.
- Фокин А.А, Куватов А.В. Важность выбора материала заплаты для пластики артериотомического отверстия при каротидной эндартерэктомии//Современные проблемы науки и образования. 201З. № 6. С. 1-8.
- Шевченко Е.В., Тыныныка Л.Н., Михайлова И.П., Сандомирский Б.П., Наумова О.В. Воздействие консервирования на белки внеклеточного матрикса сосудистых протезов//Проблемы криобиологии и криомедицины. 2014. Т. 24. № З. С. 262-267.
- Алуханян О.А., Винокур А.А., Горбов Л.В. Сравнительная характеристика новых образцов сосудистых заплат из политетрафторэтилена в эксперименте//Ангиология и сосудистая хирургия. 2012. № 2. С. 45-51.
- Биосовместимость/под ред. В.И. Севастьянова. М., 1999. 368 с.
- Ярош А.Л., Должиков А.А., Солошенко А.В., Колпаков А.Я., Битенская Е.П., Молчанова А.С., Герасименко Д.В. Исследование биосовместимости хирургических имплантатов нового поколения для пластики передней брюшной стенки//Фундаментальные исследования. 2011. № 10-1. С. 186-189.
- Бокерия Л.А., Абдулгасанов Р.А., Аракелян В.С., Рахимов А.А. Результаты 3000 операций с использованием имплантатов и заплат «БАСЭКС» в сердечно-сосудистой хирургии//Грудная и сердечно-сосудистая хирургия. 2012. № З. С. 47-51.
- Новикова С.П., Салохединова Р.Р., Лосева С.В. Обеспечение Биологической безопасности имплантируемых медицинских изделий//Бюллетень НЦССХ им. А.Н. Бакулева РАМН. Сердечно-сосудистые заболевания. 2012. Т. 13. № 2. С. 64-69.
- Basu J., Genheimer D.W., Guthrie K.I., Sangha N., Quinlan S.F., Bruce A.I., Reavis B., Halberstadt C., Ilagan R.M., Ludlow J.W. Expansion of the human adipose-derived stromal vascular cell fraction yields a population of smooth muscle-like cells with markedly distinct phenotypic and functional properties relative to mesenchymal stem cells//Tissue Eng. Part C. Methods. 2011. Vol. 17 (8). P. 84З-60. DOI: 10.1089/ten. tec.2010.O697.
- Лазаренко С.В., Липатов В.А., Иванов А.В., Парфенов И.П. Отличительные особенности реакции tunica media и tunica intima аорты на имплантацию различных лавсановых протезов//Курский научно-практический вестник «Человек и его здоровье». 2014. № 4. С. 11-18.
- Суковатых Б.С., Иванов А.В., Валуйская Н.М., Герасимчук Е.В. Влияние поздней имплантационной тканевой реакции на выбор полипропиленового эндопротеза для превентивной подапоневротической пластики брюшной стенки//Новости хирургии. 2О1З. Т. 21. № 5. С. 11-17.


