Исследование редких видов пшениц как доноров для селекции на содержание антоцианов в зерне
Автор: Шоева О.Ю., Гордеева Е.И., Хлесткина Е.К., Гашимов М.Э., Куркиев К.У.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Молекулярно-генетические методы и селекция
Статья в выпуске: 5 т.59, 2024 года.
Бесплатный доступ
Мягкая пшеница (Triticum aestivum L.), накапливающая антоцианы в зерне, - перспективное сырье для производства продукции для функционального питания. При создании богатых антоцианами сортов зерновых культур актуален выбор подходящих доноров. В настоящей работе впервые с помощью комплексного анализа паттернов антоциановой пигментации вегетативных органов и зерна у редких видов пшениц из коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР) были выявлены доноры доминантных аллелей генов Ba , Pp-1 и Pp3 , контролирующих синтез антоцианов, а также проведена оценка их устойчивости к грибным болезням. Целью работы было исследование редких видов пшеницы на наличие антоциановой окраски зерна и вегетативных органов, выявление доноров доминантных аллелей генов Ba , Pp-1 и Pp3 , а также оценка потенциальных доноров на устойчивость к грибным болезням. Проявления антоциановой окраски зерна и вегетативных органов исследовали у 16 редких видов пшеницы из коллекции ВИР: однозернянок T. urartu Thum. ex Gandil (n = 68), T. boeoticum Boiss. (n = 99), T. monococcum L. (n = 113); полб T. dicoccoides (Körn. ex Aschers. et Graebn.) Schweinf. (n = 256), T. dicoccum (Schrank) Schuebl. (n = 502), T. araraticum Jakubz. (n = 42), T. timopheevii Zhuk. (n = 45); голозерных тетраплоидов T. aethiopicum Jakubz. (n = 246), T. persicum Vav. (n = 140), T. polonicum L. (n = 61), T. turanicum Jakubz. (n = 38), T. turgidum L. (n = 421); спельт T. spelta L. (n = 231), T. macha Dekapr. et Menabde (n = 37); голозерных гексаплоидов T. compactum Host. (n = 616), T. sphaerococcum Perciv. ( n = 54). Всего было проанализировано 2969 образцов. Наличие антоциановой окраски колеоптиля оценивали у 5-7-суточных проростков, полученных на чашках Петри в условиях комнатной температуры и естественного освещения. Окраску листового влагалища, узла соломины и ушек листовой пластинки оценивали на Дагестанской опытной станции ВИР (41,98° N, 48,33° E) в 2019-2021 годах. Цвет листового влагалища определяли в межфазный период выход в трубку-колошение, окраску влагалищ оценивали у трех нижних листьев, цвет ушек и стеблевых узлов отмечали в фазу колошения, просматривая минимум 10 растений. Для генотипирования из изучаемой коллекции пшеницы были отобраны 65 образцов, среди которых 22 образца T. boeoticum (17 образцов с голубой и 5 - с красной окраской зерна), 3 образца T. durum (с фиолетовой, белой и красной окраской зерна), 8 образцов T. spelta (2 образца с голубой, 3 - с белой и 3 - с красной окраской зерна) и 32 образца T. aethiopicum (23 образца с фиолетовой, 1 - с белой и 8 - с красной окраской зерна). ДНК выделяли из молодых листьев пяти растений каждого образца. Выделенную ДНК анализировали с помощью ПЦР с использованием внутригенных маркеров Pp3-diagnostic и ThMyc4E-specific, разработанных для генов биосинтеза антоцианов соответственно Pp3 и Ba1. Фенологические наблюдения и оценку устойчивости образцов к грибным болезням на естественном инфекционном фоне проводили на Дагестанской опытной станции ВИР в 2017-2018 годах. Устойчивость оценивали по 9-балльной шкале. В коллекции были выявлены 13 и 2 голубозерных образца соответственно T. boeoticum и T. spelta , несущие доминантные аллели генов Ba , контролирующих синтез антоцианов в алейроновом слое зерновки, и 22 фиолетовозерных образца T. aethiopicum , несущие доминантные аллели гена Pp3 , контролирующего совместно с генами Pp-1 синтез антоцианов в перикарпе зерновки. Присутствие доминантных аллелей генов Ba и Pp3 в геноме у выявленных образцов было подтверждено с помощью генотипирования ДНК молекулярными маркерами. Все образцы T. timopheevii и большинство образцов T. turanicum были белозерными, что указывает на наличие мутаций в генах, контролирующих синтез проантоцианидинов. Анализ окраски вегетативных органов показал, что разные виды пшеницы характеризуются различными паттернами пигментации, что подразумевает вовлечение в формирование окраски различных частей растения, помимо известных генов Pp-1 , контролирующих окраску вегетативных органов, дополнительных генов. У большинства проанализированных видов окраска колеоптиля зачастую проявлялась совместно с окраской листовых влагалищ и ушек, за исключением T. timopheevii и T. araraticum , у которых при наличии окраски колеоптиля и ушек отсутствовала окраска листовых влагалищ. Окраска узлов стебля зачастую не зависела от наличия антоцианового пигмента на других вегетативных органах и, по-видимому, наследуется независимо. Выявленные образцы с антоциановой пигментацией служат перспективными донорами для селекции с целью получения продукции, предназначенной для рациона функционального питания, а неокрашенные образцы представляют интерес в качестве идентифицированного генофонда для сравнительных генетических исследований молекулярно-генетических механизмов формирования признаков окраски у разных видов пшеницы.
Антоциановая пигментация, молекулярные маркеры, редкие виды пшениц, функциональное питание
Короткий адрес: https://sciup.org/142243787
IDR: 142243787 | УДК: 633.11:631.522/.524:577.2 | DOI: 10.15389/agrobiology.2024.5.955rus
Текст научной статьи Исследование редких видов пшениц как доноров для селекции на содержание антоцианов в зерне
Мягкая пшеница ( Triticum aestivum L., 2 n = 6 ½ = 42, AABBDD) служит источником углеводов, белков, пищевых волокон, минеральных веществ и различных фенольных соединений. Среди них выделяют антоцианы, которые все чаще рассматриваются в качестве компонентов функциональных продуктов питания (1, 2).
Антоцианы представляют собой водорастворимые окрашенные гликозиды, содержащие в качестве агликона антоцианидины — замещенные 2-фенилхромены. На основании наличия гидроки- и метокси-групп в положениях 3´ и 5´ молекулы агликона выделяют шесть основных антоцианидинов: цианидин, дельфинидин, мальвидин, пеларгонидин, пеонидин и пе-тунидин. Дополнительные модификации этих агликонов, среди которых наиболее распространены гликозилирование, метилирование и ацилирование ароматическими и алифатическими кислотами, определяют разнообразие антоцианов, насчитывающее более 500 индивидуальных соединений (3).
В зависимости от типа и места локализации антоцианов в зерновке зерно пшеницы может иметь фиолетовую, голубую или темно-фиолетовую окраску. Фиолетовая окраска обусловлена синтезом антоцианов в перикарпе, где преобладает цианидин-3-гликозид. Голубая окраска связана с накоплением антоцианов в алейроновом слое зерна с преобладанием дель-фининдин-3-гликозида. Темно-фиолетовую окраску имеет зерно, накапливающее антоцианы и в перикарпе, и в алейроновом слое; такое зерно характеризуется широким спектром антоциановых соединений, среди которых преобладают цианидин-3-гликозид и дельфининдин-3-гликозид (4-6). Зерно, содержащее антоцианы, имеет более разнообразный состав флавоноидов. Кроме того, оно содержит больше белка и незаменимых аминокислот, макро- и микроэлементов, витаминов по сравнению с зерном, не содержащим антоциановые соединения (7-10). Окрашенное антоцианами зерно пшеницы используют для производства продуктов питания функционального назначения, таких как цельнозерновой хлеб, хлебобулочные и макаронные изделия, каши, печенье, бисквиты, крекеры (11-13). В настоящее время во всем мире, в том числе в Российской Федерации, активно осуществляются селекционные программы по созданию сортов пшеницы, накапливающих антоцианы в зерне (2, 14-16). В России прошли конкурсное сортоиспытание и включены в реестр селекционных достижений три фиолетовозерных сорта мягкой пшеницы: Надира (17), Памяти Коновалова (18) и Эф 22 (19).
Ввиду возросшего интереса к повышению пищевой ценности возделываемых сортов пшеницы за счет увеличения содержания антоцианов в зерне, поиск доноров генов, контролирующих их накопление, считается актуальной задачей.
Среди генов, контролирующих синтез антоцианов, выделяют структурные, кодирующие ферменты метаболического пути, и регуляторные, кодирующие факторы транскрипции, которые регулируют экспрессию структурных генов. Транскрипционные факторы, принадлежащие семействам R2R3-MYB, bHLH и WD40, регулируют синтез антоцианов, объединяясь в MBW-комплексы (20). Показано, что именно вариабельность регуляторных генов обусловливает различные паттерны пигментации у растений (21).
У мягкой пшеницы накопление антоцианов в перикарпе зерновки, приводящее к фиолетовой окраске зерна, контролируется двумя комплементарными генами Pp (Purple pericarp): геном Pp3, картированным на хромосоме 2A, и одним из гомеологичных генов Pp-1, картированных на коротких плечах хромосом 7-й гомеологической группы (22).
С помощью метода позиционного клонирования из генома мягкой пшеницы была выделена нуклеотидная последовательность гена Pp3 (синонимичные названия TaMyc1 , TaPpb1 ), кодирующего транскрипционный фактор с доменом bHLH (23). В промоторе этого гена у окрашенных генотипов были выявлены шесть тандемных повторов каждый длиной 261 нуклеотид (аллель TaMyc1p ), тогда как у неокрашенных сортов присутствовал один такой повтор ( TaMyc1w ) (24, 25). Обнаруженные различия послужили основой для разработки диагностического ДНК-маркера, который используется в настоящее время в селекции фиолетовозерных сортов пшеницы (26-28).
Второй комплементарный ген Pp-1 , необходимый для формирования признака фиолетовой окраски зерна, был картирован в составе кластера генов, включающего Ra ( Red auricles ), Rc ( Red coleoptile ), Pan ( Purple anthers ), Pc ( Purple culm ), Pg ( Purple glume ), Pls ( Purple leaf sheath ), на коротких плечах хромосом 7-й гомеологической группы. Выявленный кластер ко-локализу-ется с геном Mpc1 (R2R3-MYB protein C1), ортологичным гену C1 кукурузы. Последний кодирует регуляторный фактор с доменом R2R3-MYB и контролирует у кукурузы окраску вегетативных органов (22).
Позднее были выделены нуклеотидные последовательности гена TaC1 , контролирующего окраску колеоптиля у пшеницы (29). Было показано участие гена TaC1 (синонимы Pp-1 , TaPpm1 , TaMpc1 ) в окраске перикарпа зерна пшеницы (24). Таким образом, второй ген, необходимый для формирования окраски зерна, имеет плейотропный эффект в отношении пигментации колеоптиля у пшеницы. Ряд авторов отмечают, что окраска колеоптиля, стебля, листовых влагалищ и узлов стебля наследуется совместно (30), что подразумевает участие генов Pp-1 в окраске не только колеоптиля, но и органов взрослого растения.
У пшеницы были выявлены мутаций каждого из гомеологичных генов TaC1 , приводящие к отсутствию пигментации, среди которых инсер-ции, в том числе протяженные (более 1 тыс. нуклеотидов), делеция и замена в кодирующей области гена и в интроне (24, 29). Присутствие трех гомео-логичных генов в рецессивном нефункциональном состоянии обусловливает отсутствие окраски колеоптиля, тогда как наличие хотя бы одной из копий гена в доминантном состоянии приводит к формированию красной окраски колеоптиля.
Голубая окраска алейрона, обусловленная антоциановыми пигментами, контролируется генами Ba ( Blue aleurone ), которые были унаследованы мягкой пшеницей от близкородственных видов T. monococcum , T. bo-eoticum , Thynopirum ponticum (син. Agropyron elongatum ), Th. bessarabicum в процессе межвидовой гибридизации (31). В геноме голубозерной пшеницы, несущей интрогрессию от Th. ponticum , выявлена нуклеотидная последовательность гена Ba1 — ThMyc4E , кодирующего транскрипционный фактор с доменом bHLH; показано ее участие в регуляции синтеза антоцианов в алейроне (32). Ортологичная ей последовательность TbMyc4A , дифференциально экспрессирующаяся в голубом зерне при сравнении с белым, обнаружена в геноме T. boeoticum — донора гена Ba2 (33).
Химически близкие антоцианам полимерные проантоцианидины накапливаются в оболочке зерна и придают ему красную окраску. Гены R-1, контролирующие синтез этих соединений, были картированы на длинных плечах хромосом 3-й гомеологической группы. Показано, что они кодируют транскрипционные факторы с доменом R2R3-MYB, активирующим транскрипцию структурных генов биосинтеза флавоноидов в оболочке зерна пшеницы (34).
Донорами генов, контролирующих окраску зерновки, могут быть редкие виды пшениц, которые рассматриваются также как источники хозяйственно ценных признаков для селекции. В частности, среди образцов T. monococcum , T. dicoccum , T. timopheevii , T. macha , и T. persicum из коллекции ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова) выявлены образцы с групповой устойчивостью к возбудителям бурой и желтой ржавчины, пиренофороза, септориоза (35). Наличие у образцов редких видов пшениц генов, контролирующих окраску зерновки, позволит более эффективно использовать их в селекционных исследованиях.
В настоящей работе впервые с помощью комплексного анализа паттернов антоциановой пигментации вегетативных органов и зерна у редких видов пшениц из коллекции ВИР выявлены доноры доминантных аллелей генов Ba , Pp-1 и Pp3 , контролирующих синтез антоцианов, а также проведена оценка устойчивости этих образцов к грибным болезням.
Целью работы было исследование редких видов пшеницы на наличие антоциановой окраски зерна и вегетативных органов, выявление доноров доминантных аллелей генов Ba , Pp-1 и Pp3 , ее контролирующих, а также оценка потенциальных доноров на устойчивость к грибным болезням.
Методика. Проявления антоциановой окраски зерна исследовали у 16 редких видов пшеницы из коллекции ВИР, для 9 из которых также провели оценку окраски вегетативных органов. Были изучены следующие виды: однозернянки T. urartu Thum. ex Gandil ( n = 68), T. boeoticum Boiss. ( n = 99), T. monococcum L. ( n = 113); полбы T. dicoccoides (Korn. ex Aschers. et Graebn.) Schweinf. ( n = 256), T. dicoccum (Schrank) Schuebl. ( n = 502), T. araraticum Jakubz. ( n = 42), T. timopheevii Zhuk. ( n = 45); голозерные тетраплоиды T. aethiopicum Jakubz. ( n = 246), T. persicum Vav. ( n = 140), T. polonicum L. ( n = 61), T. turanicum Jakubz. ( n = 38), T. turgidum L. ( n = 421); спельты T. spelta L. ( n = 231), T. macha Dekapr. et Menabde ( n = 37); голозерные гексаплоиды T. compactum Host. ( n = 616), T. sphaerococcum Perciv. ( n = 54). Всего было проанализировано 2969 образцов.
Наличие антоциановой окраски колеоптиля оценивали у 5-7-суточных проростков, пророщенных на чашках Петри при комнатной температуре и естественном освещении (Дагестанская опытная станция ВИР, 41,98 ° N, 48,33 ° E) (37) в 2019-2021 годах. Для каждого образца, отобранного для анализа окраски вегетативных органов, проращивали по 30 зерен. Образец считался окрашенным даже при наличии слабой антоциановой пигментации.
Окраску листового влагалища, узла соломины и ушек листовой пластинки оценивали в полевых условиях также на Дагестанской опытной станции ВИР в 2019-2021 годах. Каждый образец высевали на делянках площадью 1 м2 по шесть рядков, по 50-60 растений в рядке. Цвет листового влагалища определяли в межфазный период выход в трубку—колошение, окраску влагалищ оценивали у трех нижних листьев, цвет ушек и стеблевых узлов отмечали в фазу колошения, просматривая минимум 10 растений. Оценку антоциановой пигментации вегетативных органов у каждого из исследуемых образцов в полевых условиях проводили однократно.
Для генотипирования ДНК из изучаемой коллекции пшеницы были отобраны 65 образцов, среди которых 22 образца T. boeoticum (17 образцов 958
с голубой и 5 — с красной окраской зерна), 3 образца T. durum (с фиолетовой, белой и красной окраской зерна), 8 образцов T. spelta (2 образца с голубой, 3 — с белой и 3 — с красной окраской зерна) и 32 образца T. aethio-picum (23 образца с фиолетовой, 1 — с белой и 8 — с красной окраской зерна).
ДНК выделяли из молодых листьев пяти растений каждого образца согласно ранее описанной методике (38). Этот этап работы проводили в Институте цитологии и генетики Сибирского отделения РАН в 2021-2024 годах. Качество и количество выделенной ДНК оценивали методом аналитического электрофореза с маркером длины 100 bp (ООО «Лаборатория МЕДИГЕН», Россия). Выделенную ДНК анализировали с помощью ПЦР с использованием внутригенных маркеров Pp3-diagnostic и ThMyc4E-specific, разработанных для генов биосинтеза антоцианов соответственно Pp3 и Ba1 : Маркер Хромосома Праймеры Размер продуктов ПЦР, п.н
Pp3-diagnostic 2A 5´-AAGAAATGACACTTCGCCACAA-3´ 429/398
5´- GGTGGGCTCTTCCTGGCAT-3´
ThMyc4E-specific 4Th 5´-GAAACAACAGGACCGAGCAG-3´ 198/-
5´-CTTGATGGCGTCAAACACTT-3´
ПЦР проводили согласно описанному протоколу (27). Реакционная смесь объемом 20 мкл содержала до 100 нг ДНК-матрицы, 67 мM Трис-НСl (рН 8,8), 1,8 мM МgCl 2 , 0,01 % Tween 20, 18 мM (NH 4 ) 2 SO 4 , по 0,2 мM каждого дНТФ, по 0,3 мкМ прямого и обратного специфических праймеров, 1 ед. Taq ДНК-полимеразы. Амплификацию проводили в T100 Thermal Cycler («Bio-Rad», США) в следующих условиях: 2 мин при 94 ° С (преденатурация); 15 с при 94 ° С (денатурация), 30 с при 65 ° С с понижением на 0,7 ° С/цикл (отжиг матрицы с праймерами), 45 с при 72 ° C (полимеризация) (13 циклов); 15 с при 94 ° С (денатурация), 30 с при 56 ° С (отжиг матрицы с праймерами), 30 с при 72 ° C (полимеризация) (24 цикла); 5 мин при 72 ° С (достраивание ПЦР-фрагментов).
Продукты ПЦР разделяли в 2 % агарозном геле (LE Agarose, «Lonza Rockland, Inc.», США) в горизонтальной камере в течение 1-5 ч при 7 Вт/см. Фотографии в УФ-свете и анализ изображения делали с помощью системы документации гелей Molecular Imager® Gel DocTM XR+ System («Bio-Rad Laboratories, Inc.», США). В качестве контроля использовали ДНК образцов с доминантными аллелями генов Ba1 и Pp3 — созданной на основе родительского сорта Саратовская 29 (S29) пшенично-пырейной замещенной линии s:S29 Ba1 4Th(4D), несущей вместо хромосомы 4D пшеницы хромосому 4Th пырея, где был картирован ген Ba1 , и почти-изогенная линия i:S29 Pp3 P Pp-D1 P с доминантным аллелем гена Pp3 (27).
Фенологические наблюдения и оценку устойчивости образцов к грибным болезням на естественном инфекционном фоне проводили на Дагестанской опытной станции ВИР в 2017-2018 годах в соответствии с методическими указаниями ВИР (39). Образцы высевали на делянках площадью 1 м2 по шесть рядков, по 50-60 растений в рядке. Устойчивость оценивали по 9-балльной шкале при визуальном осмотре поражений на листьях на протяжении всего вегетационного периода. Максимальный балл получали образцы, на которых не было выявлено поражение болезнью или отмечены единичные пустулы, окруженные некрозом, у единичных растений с делянки. Минимальный балл получали образцы, у которых основная часть растений с делянки имела пораженные болезнью листья.
Результаты. Для поиска потенциальных доноров доминантных аллелей генов Ba и Pp, контролирующих синтез антоцианов соответственно в алейроновом слое и перикарпе зерновок, коллекция редких видов пшениц была проанализирована на наличие пигментации зерна. Выделяли образцы с фиолетовой либо голубой окраской, обусловленной антоцианами, с красной окраской, которая образуется за счет синтеза и последующего окисления проантоцианидинов, и образцы без окраски, у которых был нарушен синтез проантоцианидинов в зерне и не синтезировались антоцианы (табл. 1).
1. Окраска зерна у редких видов пшеницы из коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР)
|
Секция |
Группа видов |
Вид |
2 n |
Геном |
Окраска зерна |
Всего |
|||
|
Б |
К |
Ф 7 |
Г |
||||||
|
Urartu Dorof. et A. Filat. |
Однозернянки |
T. urartu Thum. ex Gandil |
14 |
Au |
- |
+ |
- |
68 |
|
|
Dicoccoides |
Полбы |
T. dicoccoides (Körn. ex Aschers. et |
28 |
BAu |
- |
+ |
- |
- |
256 |
|
Flaksb. |
Graebn.) Schweinf. T. dicoccum (Schrank) Schuebl. |
28 |
BAu |
Един. |
+ |
- |
- |
502 |
|
|
Голозерные |
T. aethiopicum Jakubz. |
28 |
BAu |
+ |
+ |
+ |
- |
246 |
|
|
тетраплоиды |
T. persicum Vav. (= T. carthlicum Nevski |
28 |
BAu |
Един. |
+ |
- |
- |
140 |
|
|
T. polonicum L. |
28 |
BAu |
+ |
+ |
- |
- |
61 |
||
|
T. turanicum Jakubz. |
28 |
BAu |
+ |
Един. |
- |
- |
38 |
||
|
T. turgidum L. |
28 |
BAu |
+ |
+ |
- |
- |
421 |
||
|
Triticum |
Спельты |
T. spelta L. |
42 |
BAuD |
+ |
+ |
- |
Един. |
231 |
|
T. macha Dekapr. et Menabde |
42 |
BAuD |
- |
+ |
- |
- |
37 |
||
|
Голозерные |
T. compactum Host. |
42 |
BAuD |
+ |
+ |
- |
- |
616 |
|
|
гексаплоиды |
T. sphaerococcum Perciv. |
42 |
BAuD |
+ |
+ |
- |
- |
54 |
|
|
Monococcon |
Однозернянки |
T. boeoticum Boiss. |
14 |
Ab |
- |
+ |
- |
+ |
99 |
|
Dum. |
T. monococcum L. |
14 |
Ab |
- |
+ |
- |
- |
113 |
|
|
Timopheevii |
Полбы |
T. araraticum Jakubz. |
28 |
GAb |
+ |
+ |
- |
- |
42 |
|
A. Filat. et Dorof. |
T. timopheevii Zhuk. |
28 |
GAb |
+ |
- |
- |
- |
45 |
|
Примечани е. Б — белая, К — красная, Ф — фиолетовая, Г — голубая. « +» — наличие образцов с указанной окраской зерна, « - » — отсутствие образцов с указанной окраской зерна, един. — единичные образцы с указанной окраской зерна. Классификация видов пшениц по Н.П. Гончарову (36).
Среди диплоидных видов пшеницы зерно голубого цвета, окрашенное антоцианами, выявили лишь у образцов T. boeoticum , тогда как для T. monococcum и T. urartu была характерна красная окраска зерна, образцов с белой окраской мы не обнаружили.
Большинство тетраплоидных видов пшеницы имели красную окраску зерновки. У T. turanicum выявляли единичные образцы с красной окраской, тогда как большинство образцов этого вида имели белое зерно. У всех проанализированных образцов T. timopheevii зерно оказалось не окрашено. У тетраплоидных видов пшениц не были обнаружены образцы с голубым зерном. Фиолетовая окраска зерна наблюдалась у ряда образцов T. aethiopicum , у T. aethiopicum также были выявлены образцы с красной и белой окраской зерновки.
Все проанализированные гексаплоидные виды пшениц были представлены краснозерными и белозерными образцами. Лишь у T. spelta два образца имели голубую окраску зерновки.
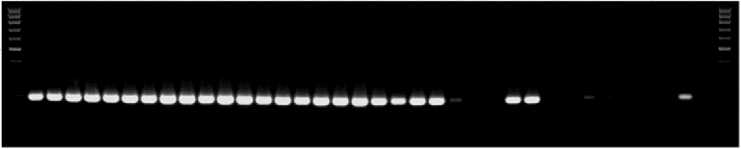
У всех образцов T. boeoticum вне зависимости от их окраски в ПЦР с маркером ThMyc4E-specific амплифицировались фрагменты длиной 198 п.н., совпадающие по размеру с ПЦР-фрагментами, получаемыми с помощью этого маркера в случае пшенично-пырейной замещенной линии s:S29 Ba1 4Th(4D) (рис. 1, А). Используя маркер ThMyc4E-specific, мы не получили ПЦР-фрагменты на матрице ДНК образцов T. durum и T. aethiopicum , за исключением некоторых образцов, где ПЦР-фрагменты, сходные по длине с целевым ПЦР-продуктом, присутствовали в следовых количествах. Это указывает на частичную амплификацию ортологичных последовательностей ДНК, однако интенсивность амплификации была значительно снижена по сравнению с контрольным образцом s:S29 Ba1 4Th(4D) и образцами T. boeoticum .
л
Т. boeotkum Т. durum Т. spelta Кошроли
М 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28'28-’29129-’30 31 К1К2КЗМ
ГГГГГГГГГ ГГ Г Г Г Г Г Г КККККФБКГГББКККБКГФ
Т. aethiopicum Кошроли
М 3233 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 5 I 52 53 54 55 56 57 58 59 60 61 62 63 КI К2КЗМ
ф ф ф ф ф ф ф ф ф ф ф ф ф ф ф ф ф ф ф ф Ф Ф Ф Б К К К К К К К К К Г Ф
Б
Т. boeotkum Т. durum Т. spelta Кошроли
Ml 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 2728'28’29'29^0 31К1К2КЗМ

ГГГГГГГГГ ГГ Г Г Г Г Г Г КККККФБКГГББКККБКГФ
Т. aethiopicum Кошроли
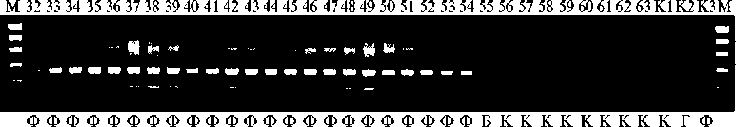
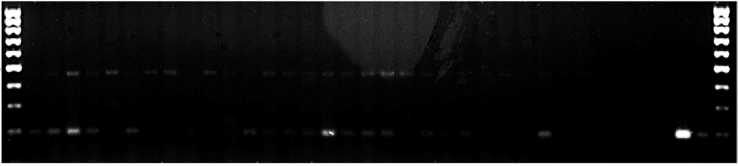
Рис. 1. Электрофореграммы продуктов ПЦР, полученных с использованием молекулярных маркеров ThMyc4E-specific (А) и Pp3-diagnostic (Б) и ДНК образцов Triticum boeoticum (1-22) , T. durum (23-25) , T. spelta (26-31) , T. aethiopicum (32-63) и контрольных образцов T. aestivum сорта Саратовская 29 (К1) , пшенично-пырейной замещенной линии s:S29 Ba1 4Th(4D) (К2) и по-чти-изогенной линии i:S29 Pp3 P Pp-D1 P (К3): 1 — k-18424 (Крым, Россия), 2 — k-58512 (Армения), 3 — k-58674 (Армения), 4 — k-59173 (Нагорный Карабах, Азербайджан), 5 — k-61036 (Иран), 6 — k-61037 (Иран), 7 — k-61038 (Турция), 8 — k-61039 (Турция), 9 — k-61040 (Иран), 10 — k-61660 (Греция), 11 — k-61666 (Греция), 12 — k-61669 (Турция), 13 — k-64833 (Армения), 14 — k-61673 (Болгария), 15 — k-62492 (Болгария), 16 — k-62495 (Греция), 17 — k-64833 (Армения), 18 — k-58512 (Армения), 19 — k-62492 (Болгария), 20 — k-40117 (Ирак), 21 — k-40119 (Ирак), 22 — k-62495 (Греция); 23 — k-46512 (Чили), 24 — k-17884 (Кипр), 25 — k-54928 (Иран); 26 — k-28321 (Германия до 1949 года), 27 — k-45767 (Чехословакия до 1992 года), по две популяции: 281, 2 — k-52450 (Таджикистан), 291, 2 — k-52459 (Таджикистан) (, 30 — k-63663 (Швейцария), 31 — k-52471 (Таджикистан); 32 — k-624629, 33 — k-624630, 34 — k-624631, 35 — k-624639, 36 — k-624652, 37 — k-624661, 38 — k-624665, 39 — k-624665, 40 — k-624666, 41 — k-624669, 42 — k-624669, 43 — k-624670, 44 — k-624681, 45 — k-624682, 46 – k-624684, 47 — k-624684, 48 — k-624683, 49 — k-624688, 50 — k-624688, 51 — k-624689, 52 — k-624690, 53 — k-624690, 54 — k-19553, 55 — k-19530, 56 — k-624637, 57 — k-624656, 58 — k-624660, 59 — k-624662, 60 — k-19567, 61 — k-19616, 62 — k-21816, 63 — k-43762 (все образцы из Эфиопии). Окраска зерна образца указана снизу: Б — белая, Г — голубая, К — красная, Ф — фиолетовая. Стрелками указаны фрагменты маркера длины 100bp (ООО «Лаборатория МЕ-ДИГЕН», Россия), соответствующие 500 п.н.
Таким обозом, маркер ThMyc4E-specific амплифицировал не только фрагменты гена Ba1 пырея, но также фрагменты гена Ba2 T. boeoticum. При этом различий в размерах ПЦР-фрагментов между окрашенными и неокрашенными образцами установлено не было. При генотипировании с использованием маркера ThMyc4E-specific восьми образцов T. spelta у двух образцов, имеющих голубую окраску зерновки, были получены ПЦР-продукты, тогда как у неокрашенных образцов ПЦР-фрагменты не выявили. Наши результаты указывают на то, что голубозерные образцы несли в геноме либо ген Ba1, унаследованный от пырея, либо ген Ba2 от T. boeoticum.
Все образцы также были генотипированы с помощью ДНК-маркера Pp3-diagnostic, позволяющего отличить доминантный аллель гена Pp3 от рецессивного. Все образцы T. aethiopicum с фиолетовой окраской зерновки имели ПЦР-фрагмент длиной 398 п.н., соответствующий доминантному аллелю гена Pp3, тогда как ПЦР-фрагменты у белозерных и краснозерных образцов T. aethiopicum имели длину 429 п.н., соответствующую рецессивному аллелю гена Pp3 (см. рис. 1, Б) . С использованием маркера Pp3-diagnostic на матрице ДНК образцов T. boeoticum не было получено специфических ПЦР-фрагментов гена Pp3 , а у образцов T. speltа амплифициро-вались фрагменты рецессивного аллеля гена Pp3, за исключением одного образца (¹ 26, см. рис. 1, Б), для которого ПЦР-фрагментов мы не получили. Возможно, у этого образца участок генома был замещен участком генома близкородственного вида, у которого указанный ген отсутствовал. Таким образом, все изученные фиолетовозерные образцы пшеницы — доноры доминантного аллеля гена Pp3, присутствие которого в геноме подтверждено с помощью ПЦР-анализа.
Выявленные образцы с антоциановой пигментацией зерна могут стать перспективными донорами для селекции на содержание антоцианов (табл. 2).
2. Образцы редких видов пшеницы из коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР) с антоциановой окраской зерна и их устойчивость к патогенам
Продолжение таблицы 2
|
k-61669 |
Турция |
T. boeoticum var. mikoianii , pant-chitchii , pubescentinigrum , rufinigrum |
Голубой |
9 |
9 |
|
k-64833 |
Армения |
T. boeoticum var. kurbagalense |
Голубой |
н.д. |
н.д |
|
k-28321 |
Германия до 1949 года |
T. spelta var. viridarduini |
Голубой |
н.д. |
н.д |
|
k-45767 |
Чехословакия до 1992 года |
T. spelta var. viridarduini |
Голубой |
н.д. |
н.д |
|
k-624629 |
Эфиопия |
T. aethiopicum var. arraseita |
Фиолетовый |
1 |
1 |
|
k-624630 |
Эфиопия |
T. aethiopicum var. arraseita |
Фиолетовый |
3 |
9 |
|
k-624631 |
Эфиопия |
T. aethiopicum var. arraseita |
Фиолетовый |
3 |
7 |
|
k-624639 |
Эфиопия |
T. aethiopicum var. alboviolaceum |
Фиолетовый |
5 |
3 |
|
k-624652 |
Эфиопия |
T. aethiopicum var. arraseita |
Фиолетовый |
3 |
9 |
|
k-624661 |
Эфиопия |
T. aethiopicum var. arraseita |
Фиолетовый |
5 |
9 |
|
k-624665 |
Эфиопия |
T. aethiopicum var. schimperi |
Фиолетовый |
7 |
9 |
|
k-624666 |
Эфиопия |
T. aethiopicum var. steudelianum |
Фиолетовый |
7 |
9 |
|
k-624669 |
Эфиопия |
T. aethiopicum var. densarraseita |
Фиолетовый |
н.д. |
н.д |
|
k-624669 |
Эфиопия |
T. aethiopicum var. arraseita |
Фиолетовый |
н.д. |
н.д |
|
k-624670 |
Эфиопия |
T. aethiopicum var. arraseita |
Фиолетовый |
3 |
9 |
|
k-624681 |
Эфиопия |
T. aethiopicum var. shweinfurtii |
Фиолетовый |
5 |
9 |
|
k-624682 |
Эфиопия |
T. aethiopicum var. nigridensischimperi |
Фиолетовый |
1 |
9 |
|
k-624684 |
Эфиопия |
T. aethiopicum var. nigridensarraseita |
Фиолетовый |
5 |
9 |
|
k-624684 |
Эфиопия |
T. aethiopicum var. shweinfurtii |
Фиолетовый |
5 |
7 |
|
k-624683 |
Эфиопия |
T. aethiopicum var. densischimperi |
Фиолетовый |
5 |
7 |
|
k-624688 |
Эфиопия |
T. aethiopicum var. nigrimarginatum |
Фиолетовый |
9 |
9 |
|
k-624688 |
Эфиопия |
T. aethiopicum var. schimperi |
Фиолетовый |
н.д. |
н.д |
|
k-624689 |
Эфиопия |
T. aethiopicum var. schimperi |
Фиолетовый |
9 |
9 |
|
k-624690 |
Эфиопия |
T. aethiopicum var. steudelianum |
Фиолетовый |
9 |
9 |
|
k-624690 |
Эфиопия |
T. aethiopicum var. pseudoschiperi |
Фиолетовый |
9 |
9 |
|
k-19553 |
Эфиопия |
T. aethiopicum var. pseudopurpureum |
Фиолетовый |
н.д. |
н.д |
Примечание. Для T. boeoticum представлена устойчивость к бурой ржавчине, для T. aethi-opicum — к желтой ржавчине; н.д. — нет данных.
С целью изучения распространения доминантных аллелей генов Pp-1 , которые контролируют фиолетовую окраску вегетативных органов, а совместно с геном Pp3 — фиолетовую окраску зерна, было проведено исследование антоциановой окраски колеоптиля, листового влагалища, ушек и узла соломины у образцов девяти видов пшениц: T. boeoticum ( n = 82), T. mono-coccum ( n = 101), T. urartu ( n = 56), T. dicoccoides ( n = 101), T. dicoccum ( n = 362), T. araraticum ( n = 42), T. persicum ( n = 106), T. polonicum ( n = 50), T. timopheevii ( n = 43) (рис. 2).
Колеоптиль у большинства проанализированных образцов оказалось окрашено. Единственный вид, у которого не было выявлено ни одного образца с окрашенным колеоптилем, — T. persicum . У образцов T. monococcum , T. dicoccum , T. dicoccoides наблюдался полиморфизм окраски колеоптиля, что свидетельствует о наличии аллельного разнообразия генов Pp-1 , включая доминантные и рецессивные аллели. Однако частота встречаемости образцов с антоциановой окраской колеоптиля у T. monococcum , составившая 13 %, была ниже, чем у T. dicoccum и T. dicoccoides , у которых окрашенный колеоптиль имели соответственно 81 и 74 % образцов.
Листовые влагалища были окрашены у всех образцов T. urartu , T. boeoticum , T. dicoccum , T. polonicum , тогда как мы не выявили ни одного образца T. monococcum , T. timopheevii и T. araraticum с антоциановой окраской листовых влагалищ. У T. dicoccoides 96 % образцов имели окрашенные листовые влагалища, у T. persicum — 32 %.
Ушки листового влагалища были окрашены у всех видов, кроме T. monococcum и T. persicum , у которых ни одного образца с антоциановой
окраской ушек выявлено не было, у T. polonicum окраску ушек имели 90 % образцов.
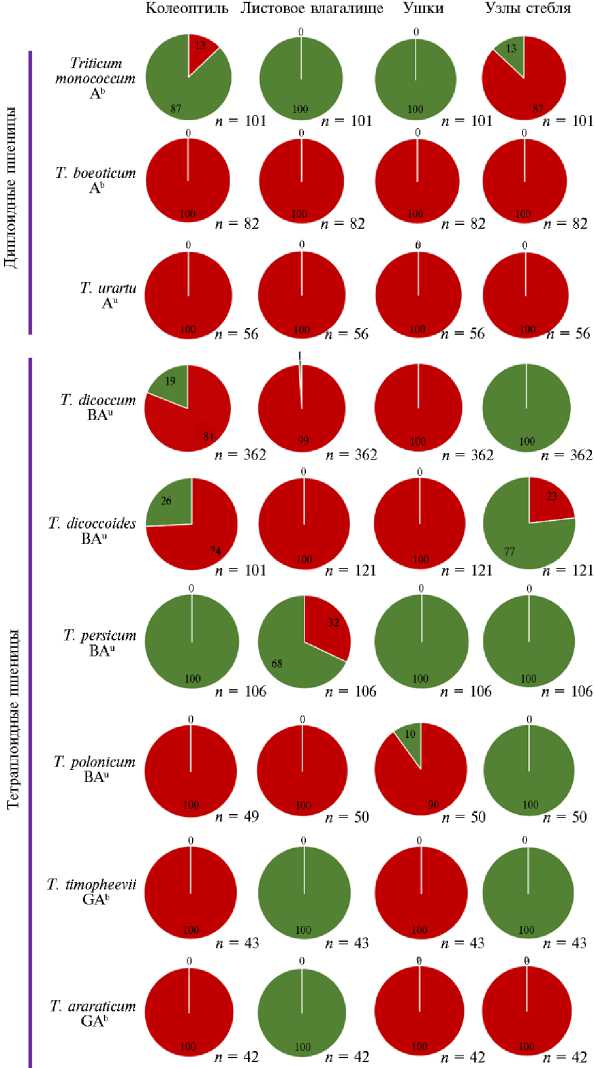
Рис. 2. Частота распространения антоциановой окраски вегетативных органов у редких видов пшеницы из коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР). Красным цветом на круговой диаграмме отмечена доля образцов (%), у которых были визуально детектированы антоциановые пигменты в различных частях растений, зеленым цветом — доля образцов, не имеющих антоциановой пигментации; n — число проанализированных образцов.
Узлы соломины были окрашены у всех образцов диплоидных видов пшеницы, за исключением 13 % образцов T. monococcum, тогда как у тетра- плоидных видов окраска узлов соломины была редким признаком: ее обнаружили лишь у образцов T. araraticum и у 23 % образцов T. dicoccoides (см. рис. 2).
Выявленные образцы с антоциановой окраской зерновки были оценены на устойчивость к мучнистой росе и бурой (или стеблевой — в случае T. aethiopicum ) ржавчине. Среди T. boeoticum образцы k-61039, k-61040, k-61660, k-61669 продемонстрировали максимальную устойчивость (9 баллов) к обоим патогенам, также устойчивые к обоим патогенам образцы были выявлены среди T. aethiopicum — k-624688, k-624689, k-624690 (две популяции) (см. табл. 2).
При селекции новых сортов пшеницы с повышенным содержанием антоцианов в зерне, пригодных для производства функциональных продуктов питания, выбор подходящих доноров генов, контролирующих синтез этих соединений, представляет важную задачу. Среди диплоидных видов пшеницы из коллекции ВИР были выявлены образцы T. boeoticum с голубой окраской зерновки. Они служат донорами гена Ba2 . Этот ген был картирован на хромосоме 4Ab (40) и, как установлено позднее, является ортологом гена Ba1 пырея Th. ponticum (33). Помимо T. boeoticum и Th. ponticum , голубая окраска, контролируемая геном Ba2 на хромосоме 4Am, описана у T. mo-nococcum (41). Однако среди 113 проанализированных образцов T. monococ-cum из коллекции ВИР ни одного образца с голубой окраской зерновки выявлено не было. Возможно, это связано с низкой экспрессивностью признака. J. Dubcovsky с соавт. (41) установили, что T. monococcum содержит аллель гена Ba2 с неполным доминированием, обозначенный авторами как Ba(a) , который определяет слабую голубую окраску зерна, отличную от полной голубой окраски, обусловленной аллелем Ba(b) пырея (41).
С помощью межвидовой гибридизации гены Ba2 T. boeoticum или T. monococcum через тетраплоидную пшеницу могут быть перенесены в геном мягкой пшеницы. При этом у полученных голубозерных линий происходит замещение гомологичных хромосом 4A или 4B пшеницы парой хромосом 4Ab T. boeoticum или 4Am T. monococcum , как было показано для образцов из коллекции Blaukorn (31), а также пшенично- T boeoticum замещенных линий (42). Поскольку диплоидные виды пшениц несут аллели гена Ba2 , определяющие слабую голубую окраску, то пырей, несущий доминантный аллель гена Ba1 , который контролирует насыщенную голубую окраску, представляется предпочтительным донором. Однако замещение целых хромосом пшеницы хромосомами пырея зачастую приводит к снижению урожайности и ухудшению качества зерна у получаемых голубозерных линий (43-45). Поэтому наиболее предпочтительными донорами для селекции служат образцы с транслокациями фрагментов генома пырея в геном пшеницы. Среди пшенично-пырейных линий с полным замещением хромосом 4B или 4D на хромосомы 4Th пырея, а также линий, дополненных пырейными хромосомами и их плечами, были обнаружены линии, несущие транслокации от пырея в хромосомах 4-й гомеологической группы мягкой пшеницы (45, 46).
На сегодняшний день в селекции на наличие антоцианов в алейроне используются ранее созданные голубозерные линии пшеницы, однако у таких образцов не всегда очевидно происхождение генов Ba (47). Например, в коллекции ВИР нами были выявлены два голубозерных образца T. spelta. Один из образцов (k-28321) под названием Blaukorniger был получен из Германии, где в 1930-е годы Э. Чермак создал коллекцию окрашенных линий пшениц Blaukorn. Большинство голубозерных образцов из этой коллекции было получено на основе пырея (31). Однако позднее цитологический анализ не выявил у ряда образцов геномный материал пырея, в том числе у образца Tschermaks Blaukorniger Sommerweizen (вероятно, идентичного образцу k-28321, зарегистрированному в коллекции ВИР под названием Blaukor-niger), у которого авторы предполагают интрогрессию фрагментов генома от T. monococcum (47).
Второй выявленный образец голубозерной спельты k-45767 получен из Чехословакии, куда были переданы образцы из коллекции Blaukorn, которые активно вовлекались в селекцию голубозерной пшеницы, включая спельту (48). Наличие у выявленных голубозерных образцов T. spelta ПЦР-фрагментов, амплифицированных с помощью молекулярного маркера ThMyc4E-specific, позволяет предполагать, что их голубая окраска может быть обусловлена либо геном Ba1 пырея, либо геном Ba2 T. boeoticum . Дальнейшее выявление нуклеотидных последовательностей генов Ba у доноров признака голубой окраски зерна методами молекулярной генетики и их сравнение с нуклеотидными последовательностями генов Ba у созданных голубозерных линий пшеницы позволит определить происхождение этих генов, в том числе у голубозерных образцов T. spelta из коллекции ВИР.
Тетраплоидных видов пшеницы с голубой окраской в коллекции ВИР мы не выявили, однако были обнаружены образцы T. aethiopicum с фиолетовой окраской зерновки (см. табл. 2). T. aethiopicum — эндемичный вид на территории Эфиопии, Эритреи и Йемена (49). Он рассматривается в качества донора признака фиолетовой окраски зерна, тогда как ни у диплоидных видов, ни у эгилопсов, в том числе доноров геномов мягкой пшеницы (A — T. urartu , B — Aegilops speltoides , D — Ae. tauschii ), фиолетовая окраска зерна не описана (31). Была выделена нуклеотидная последовательность гена Pp3 — TaMyc1p , которая обнаруживалась во всех фиолетовозерных сортах мягкой пшеницы, а также фиолетовозерных образцах тетрапло-идных видов T. durum , T. polonicum , T. turgidum из Эфиопии и Эритреи (25). От T. aethiopicum доминантный аллель гена Pp3 был передан с помощью гибридизации другим тетраплоидам — T. durum и T. dicoccum , T. dicoccon , T. polonicum , T. turgidum , T. carthlicum , а также гексаплоидной пшенице T. aestivum (14, 15, 31, 50, 51). Наличие доминантного аллеля гена Pp3 у всех проанализированных в настоящей работе фиолетовозерных образцов пшеницы было подтверждено с помощью молекулярного маркера Pp3-diagnostic.
Помимо гена Pp3 , для формирования фиолетовой окраски зерновки необходим как минимум один из генов Pp-1 в доминантном состоянии, который также отвечает за окраску вегетативных органов (22). Оценка окраски вегетативных органов — важный этап при селекции фиолетовозерных линий пшеницы (26, 27, 52). Наличие антоциановой пигментации позволяет судить о функциональности ферментов метаболического пути синтеза антоцианов и возможности создать новый генотип с фиолетовой окраской зерна c помощью направленного отбора по одному гену Pp3 , специфически активирующему синтез антоцианов именно в зерне, а не по двум генам Pp3 и Pp-1 , как в случае селекции на основе реципиентного сорта, не имеющего окраски вегетативных органов (16).
Мы провели анализ окраски колеоптиля, листовых влагалищ, ушек листового влагалища и узлов стебля у исследуемых видов пшениц (см. рис. 2). Ранее предполагалось, что антоциановая окраска перечисленных органов контролируется совместно (30). Однако у проанализированных видов пшеницы наблюдались различные паттерны пигментации, что подразумевает наличие специфических генов, контролирующих антоциановую пигментацию в разных органах. Показано, что окраска колеоптиля зачастую проявлялась совместно с окраской ушек листовых пластинок и листовых 966
влагалищ, за исключением T. timopheevii и T. araraticum , у которых при наличии окраски колеоптиля и ушек листовых пластинок отсутствовала окраска листовых влагалищ.
Окраска узлов стебля зачастую не была связана с наличием окраски на других вегетативных органах и, по-видимому, наследовалась независимо. В частности, у некоторых образцов T. dicoccum и T. dicoccoides в лабораторных условиях не наблюдалась антоциановая пигментация колеоптиля, тогда как она была обнаружена на листовых влагалищах и ушках листовых пластинок в полевых условия, где, по-видимому, синтез антоцианов активировался дополнительными стимулами, такими как солнечный свет и другие абиотические факторы.
Влияние среды на интенсивность антоциановой окраски зерна пшеницы отмечено в ряде работ (4, 43, 53). Однако, помимо генов Pp-1 и влияния среды на окраску вегетативных органов, можно предположить наличие регуляторных факторов, специфически контролирующих антоциановую окраску органов у взрослых растений. Так, у T. persicum окраска колеоптиля не наблюдалась, тогда как 34-35 % образцов имели окраску листовых влагалищ. У T. timopheevii и T. araraticum , наоборот, при наличии окраски колеоптиля у всех проанализированных образцов окраска листового влагалища отсутствовала. Рецессивные аллели дополнительных генов, которые приводят к отсутствию окраски колеоптиля либо листовых влагалищ у этих видов, могут объяснить наблюдаемые паттерны пигментации.
Среди T. spelta и T. aethiopicum c антоциановой окраской зерновки были обнаружены образцы, проявляющие устойчивость к грибным заболеваниям в условиях естественного инфекционного фона. Они представляют особый интерес для селекции в качестве доноров, так как несут гены антоциановой окраски зерна в сочетании с генами устойчивости, обеспечивающими генетическую защиту сортообразцов, создаваемых для получения продуктов здорового питания.
Помимо окрашенных образцов, для молекулярно-генетических и эволюционных исследований представляют интерес образцы, не имеющие антоциановой окраски вегетативных органов или проантоцианидинов в зерне. Последние характеризуются белым зерном. У таких образцов можно ожидать присутствия мутации в генах синтеза антоцианов и/или проанто-цианидинов (24, 29). Так, все образцы белозерного вида T. timopheevii имеют окраску колеоптиля, что свидетельствует о функционировании биосинтетического пути синтеза антоцианов. Однако проантоцианидины в зерне у этого вида не образуются. Следовательно, мутации, обусловливающие бе-лозерность, произошли в генах, кодирующих либо специфические для синтеза проантоцианидинов ферменты, либо регуляторные факторы. В дальнейшем необходимо определить, затронули ли мутации гены R-1 , контролирующие синтез проантоцианидинов в зерне у мягкой пшеницы (34), или мутации у этого вида произошли в других генах. Выявленные образцы станут основой для таких исследований. Обратная картина наблюдалась у T. persicum : при отсутствии окраски колеоптиля лишь единичные образцы имели белое зерно, тогда как большинство образцов были краснозерными, что подразумевает наличие мутаций в специфических регуляторных генах синтеза антоцианов, но не проантоцианидинов. Лишь у образцов, характеризующихся отсутствием антоцианов в колеоптиля и проантоцианидинов в зерне (белое зерно), можно ожидать наличия мутаций в ключевых структурных генах или в генах, кодирующих универсальные для двух этих биосинтетических путей регуляторные факторы.
Итак, при анализе признаков антоциановой окраски зерна и вегета- тивных органов у редких видов пшениц из коллекции ВИР были выявлены перспективные доноры для селекции, а также образцы для молекулярногенетических исследований. Показано, что, несмотря на наличие генов с плейотропным эффектом, определяющих окраску различных частей растений, исследуемые виды пшеницы имеют неодинакове паттерны пигментации. У некоторых видов одновременно наблюдалась пигментация всех вегетативных органов либо окраска одних органов и ее отсутствие на других. На основании этого наблюдения сделано предположение, что, помимо известных генов, контролирующих синтез антоцианов в вегетативных органах, существуют не известные до сих пор дополнительные тканеспецифические регуляторные гены, контролирующие синтез антоцианов, и выявленные в коллекции ВИР образцы пшениц служат перспективным материалом для молекулярно-генетических исследований таких генов.
Список литературы Исследование редких видов пшениц как доноров для селекции на содержание антоцианов в зерне
- Wang X., Zhang X., Hou H., Ma X., Sun S., Wang H., Kong L. Metabolomics and gene expres-sion analysis reveal the accumulation patterns of phenylpropanoids and flavonoids in different colored-grain wheats (Triticum aestivum L.). Food Research International, 2020, 138(part A): 109711 (doi: 10.1016/j.foodres.2020.109711).
- Garg M., Kaur S., Sharma A., Kumari A., Tiwari V., Sharma S., Kapoor P., Sheoran B., Goyal A., Krishania M. Rising demand for healthy foods-anthocyanin biofortified colored wheat is a new research trend. Frontiers in Nutrition, 2022, 9: 878221 (doi: 10.3389/fnut.2022.878221).
- Castañeda-Ovando A., Pacheco-Hernández Ma de L., Páez-Hernández Ma.E., Rodríguez J.A., Galán-Vidal C.A. Chemical studies of anthocyanins: a review. Food Chemistry, 2009, 113(4): 859-871 (doi: 10.1016/j.foodchem.2008.09.001).
- Abdel-Aal E.-S.M., Hucl P., Shipp J., Rabalski I. Compositional differences in anthocyanins from blue- and purple-grained spring wheat grown in four environments in central Saskatchewan. Cereal Chemistry, 2016, 93(1): 32-38 (doi: 10.1094/CCHEM-03-15-0058-R).
- Abdel-Aal E.S.M., Hucl P. Composition and stability of anthocyanins in blue-grained wheat. Journal of Agricultural and Food Chemistry, 2003, 51(8): 2174-2180 (doi: 10.1021/jf021043x).
- Sharma N., Tiwari V., Vats S., Kumari A., Chunduri V., Kaur S., Kapoor P, Garg M. Evaluation of anthocyanin content, antioxidant potential and antimicrobial activity of black, purple and blue colored wheat flour and wheat-grass juice against common human pathogens. Molecules, 2020, 25(24): 5785 (doi: 10.3390/molecules25245785).
- Ficco D.B.M., Mastrangelo A.M., Trono D., Borrelli G.M., De Vita P., Fares C., Beleggia R., Platani C., Papa R. The colours of durum wheat: a review. Crop and Pasture Science, 2014, 65(1): 1-15 (doi: 10.1071/CP13293).
- Tian S.-Q., Chen Z.-C., Wei Y.-C. Measurement of colour-grained wheat nutrient compounds and the application of combination technology in dough. Journal of Cereal Science, 2018, 83: 63-67 (doi: 10.1016/j.jcs.2018.07.018).
- Granda L., Rosero A., Benešová K., Pluháčková H., Neuwirthová J., Cerkal R. Content of se-lected vitamins and antioxidants in colored and nonpigmented varieties of quinoa, barley, and wheat grains. Journal of Food Science, 2018, 83(10): 2439-2447 (doi: 10.1111/1750-3841.14334).
- Dhua S., Kumar K., Kumar Y., Singh L., Sharanagat V.S. Composition, characteristics and health promising prospects of black wheat: a review. Trends in Food Science and Technology, 2021, 112: 780-794 (doi: 10.1016/j.tifs.2021.04.037).
- Gamel T.H., Saeed S.M.G., Ali R., Abdel-Aal E.S.M. Purple wheat: food development, antho-cyanin stability, and potential health benefits. Foods, 2023, 12(7): 1358 (doi: 10.3390/foods12071358).
- Хлесткина Е.К., Пшеничникова Т.А., Усенко Н.И., Отмахова Ю.С. Перспективные возможности использования молекулярно-генетических подходов для управления технологическими свойствами зерна пшеницы в контексте цепочки «зерно — мука — хлеб». Вави-ловский журнал генетики и селекции, 2016, 20(4): 511-527 (doi: 10.18699/VJ15.140).
- Usenko N.I., Khlestkina E.К., Asavasanti S., Gordeeva E.I., Yudina R.S., Otmakhova Y.S. Pos-sibilities of enriching food products with anthocyanins by using new forms of cereals. Foods and Raw Materials, 2018, 6(1): 128-135 (doi: 10.21603/2308-4057-2018-1-128-135).
- Фисенко А.В., Калмыкова Л.П., Кузнецова Н.Л., Кузьмина Н.П., Ермоленко О.И., Упел-ниек В.П. Селекция фиолетовозерной мягкой пшеницы и ее технологические свойства. Аграрная Россия, 2020, 10: 43-48 (doi: 10.30906/1999-5636-2020-10-43-48).
- Стёпочкин П.И., Гордеева Е.И., Хлесткина Е.К. Маркер-ориентированная селекция в создании гибридных линий Triticum dicoccon (Schrank) Schuebl. ½ Triticum aethiopicum Jakubz. с фиолетовоокрашенным зерном. Труды по прикладной ботанике, генетике и селекции, 2023, 184(2): 139-148 (doi: 10.30901/2227-8834-2023-2-139-148).
- Гордеева Е.И., Шаманин В.П., Хлесткина Е.К., Шоева О.Ю. Об особенностях селекции фиолетовозерной пшеницы на основе сортов c антоциановой окраской колеоптиля и стебля. Сельскохозяйственная биология, 2024, 59(3): 507-524 (doi: 10.15389/agrobiology.2024.3.507rus).
- Василова Н.З., Асхадуллин Д.Ф., Асхадуллин Д.Ф., Багавиева Э.З., Тазутдинова М.Р., Хусаинова И.И. Фиолетовозерный сорт яровой мягкой пшеницы Надира. Зернобобовые и крупяные культуры, 2021, 4(40): 66-75 (doi: 10.24412/2309-348X-2021-4-66-75).
- Рубец В.С., Ворончихина И.Н., Игонин В.Н., Сидоренко В.С., Ворончихин В.В. Характеристика фиолетовозерных сортов яровой мягкой пшеницы в условиях центрального рай-она нечерноземной зоны России. Международный сельскохозяйственный журнал, 2022, 65(5(389)): 525-529 (doi: 10.55186/25876740_2022_65_5_525).
- Шаманин В.П., Потоцкая И.В., Чурсин А.С., Шепелев С.С., Нардин Д.С., Пожеру-кова В.Е., Köksel H., Моргунов А.И. Селекция яровой мягкой пшеницы (Triticum aestivum L.) для производства экологически чистого зерна с функциональными свойствами в условиях Западной Сибири. Сельскохозяйственная биология, 2024, 59(3): 492-506 (doi: 10.15389/agrobiology.2024.3.492rus).
- Аджиева В.Ф., Бабак О.Г., Шоева О.Ю., Кильчевский А.В., Хлесткина Е.К. Молекулярно-генетические механизмы формирования окраски плодов и семян растений. Вавиловский журнал генетики и селекции, 2015, 19(5): 561-573 (doi: 10.18699/VJ15.073).
- Durbin M.L., Lundy K.E., Morrell P.L., Torres-Martinez C.L., Clegg M.T. Genes that determine flower color: the role of regulatory changes in the evolution of phenotypic adaptations. Molecular Phylogenetics and Evolution, 2003, 29(3): 507-518 (doi: 10.1016/s1055-7903(03)00196-9).
- Хлесткина Е.К. Гены, детерминирующие окраску различных органов пшеницы. Вавилов-ский журнал генетики и селекции, 2014, 16(1): 202-216.
- Shoeva O.Y., Gordeeva E.I., Khlestkina E.K. The regulation of anthocyanin synthesis in the wheat pericarp. Molecules, 2014, 19(12): 20266-20279 (doi: 10.3390/molecules191220266).
- Jiang W., Liu T., Nan W., Jeewani D.C., Niu Y., Li C., Wang Y., Shi X., Wang C., Wang J., Li Y., Gao X., Wang Z. Two transcription factors TaPpm1 and TaPpb1 co-regulate anthocyanin biosynthesis in purple pericarps of wheat. Journal of Experimental Botany, 2018, 69(10): 2555-2567 (doi: 10.1093/jxb/ery101).
- Zong Y., Xi X., Li S., Chen W., Zhang B., Liu D., Liu B., Wang D., Zhang H. Allelic variation and transcriptional isoforms of wheat TaMYC1 gene regulating anthocyanin synthesis in pericarp. Frontiers in Plant Science, 2017, 8: 1645 (doi: 10.3389/fpls.2017.01645).
- Gordeeva E., Shamanin V., Shoeva O., Kukoeva T., Morgounov A., Khlestkina E. The strategy for marker-assisted breeding of anthocyanin-rich spring bread wheat (Triticum aestivum L.) culti-vars in Western Siberia. Agronomy, 2020, 10(10): 1603 (doi: 10.3390/agronomy10101603).
- Гордеева Е.И., Шоева О.Ю., Шаманин В.П., Хлесткина Е.К. Использование молекуляр-ных маркеров в селекции мягкой пшеницы (Triticum aestivum L.) с различной антоциано-вой окраской зерновок. Письма в Вавиловский журнал генетики и селекции, 2023, 9: 86-89 (doi: 10.18699/LettersVJ-2023-9-11).
- Шоева О.Ю., Гордеева Е.И., Хлесткина Е.К. Внутригенный ДНК-маркер для отбора пшеницы с повышенным содержанием антоцианов в перикарпе зерновки. ФГБНУ ФИЦ Институт цитологии и генетики Сибирского отделения Российской академии наук, № 2774444. Заявл. 29.11.2021. Опубл. 21.06.2022. Бюл. № 18.
- Himi E., Taketa S. Isolation of candidate genes for the barley Ant1 and wheat Rc genes controlling anthocyanin pigmentation in different vegetative tissues. Molecular Genetics and Genomics, 2015, 290: 1287-1298 (doi: 10.1007/s00438-015-0991-0).
- Zeven A.C. The colour of the coleoptile of wheat. 2. A review and geographical distribution of the purple coleoptile of Triticum aestivum. Euphytica, 1973, 22(3): 471-478 (doi: 10.1007/BF00036643).
- Zeven A.C. Wheats with purple and blue grains: a review. Euphytica, 1991, 56(3): 243-258 (doi: 10.1007/BF00042371).
- Li N., Li S., Zhang K., Chen W., Zhang B., Wang D., Liu D., Liu B., Zhang H. ThMYC4E, candidate Blue aleurone 1 gene controlling the associated trait in Triticum aestivum. PLoS ONE, 2017, 12(7): e0181116 (doi: 10.1371/journal.pone.0181116).
- Liu X., Zhang M., Jiang X., Li H., Jia Z., Hao M., Jiang B., Huang L., Ning S., Yuan Z., Chen X., Chen X., Liu D., Liu B., Zhang L. TbMYC4A is a candidate gene controlling the blue aleurone trait in a wheat-Triticum boeoticum substitution line. Frontiers in Plant Science, 2021, 12: 762265 (doi: 10.3389/fpls.2021.762265).
- Himi E., Noda K. Red grain colour gene (R) of wheat is a Myb-type transcription factor. Eu-phytica, 2005, 143: 239-242 (doi: 10.1007/s10681-005-7854-4).
- Волкова Г.В., Анпилогова Л.К., Кремнева О.Ю., Андронова А.Е., Коваленко Л.С., Ваганова О.Ф., Митрофанова О.П. Сорта, коллекционные образцы и редкие виды пшеницы и образцы эгилопса с групповой устойчивостью к возбудителям болезней листьев. Вестник защиты растений, 2011, 2: 40-45.
- Гончаров Н.П. Сравнительная генетика пшениц и их сородичей. Новосибирск, 2002.
- Соловьев Д.В., Коноплев С.А., Гребенкина А.М. Агроклиматические ресурсы Дагестанской АССР. Л., 1975.
- Plaschke J., Ganal M.W., Röder M.S. Detection of genetic diversity in closely related bread wheat using microsatellite markers. Theoretical and Applied Genetics, 1995, 91: 1001-1007 (doi: 10.1007/BF00223912).
- Мережко А.Ф., Удачин Р.А., Зуев Е.В., Филатенко А.А., Сербин А.А., Ляпунова О.А., Ко-сов В.Ю., Куркиев У.К., Охотникова Т.В., Наврузбеков Н.А., Богуславский Р.Л., Абдула-ева А.К., Чикида Н.Н., Митрофанова О.П., Потокина С.А. Пополнение, сохранение в живом виде и изучение мировой коллекции пшеницы, эгилопса и тритикале. Метод. указ. /Под ред. А.Ф. Мережко. СПб, 1999.
- Singh K., Ghai M., Garg M., Chhuneja P., Kaur P., Schnurbusch T., Keller B., Dhaliwal H.S. An integrated molecular linkage map of diploid wheat based on a Triticum boeoticum ½ T. monococ-cum RIL population. Theoretical and Applied Genetics, 2007, 115: 301-312 (doi: 10.1007/s00122-007-0543-z).
- Dubcovsky J., Luo M.-C., Zhong G.-Y., Bransteitter R., Desai A., Kilian A., Kleinhofs A., Dvorak J. Genetic map of diploid wheat, Triticum monococcum L., and its comparison with maps of Hordeum vulgare L. Genetics, 1996, 143(2): 983-999 (doi: 10.1093/genetics/143.2.983).
- Liu X., Feng Z., Liang D., Zhang M., Liu X., Hao M., Liu D., Ning S., Yuan Z., Jiang B., Chen X., Chen X., Zhang L. Development, identification, and characterization of blue-grained wheat-Triticum boeoticum substitution lines. Journal of Applied Genetics, 2020, 61: 169-177 (doi: 10.1007/s13353-020-00553-9).
- Gordeeva E., Shoeva O., Mursalimov S., Adonina I., Khlestkina E. 2022. Fine points of marker-assisted pyramiding of anthocyanin biosynthesis regulatory genes for the creation of black-grained bread wheat (Triticum aestivum L.) Lines. Agronomy, 2022, 12(12): 2934 (doi: 10.3390/agron-omy12122934).
- Arbuzova V.S., Badaeva E.D., Efremova T.T., Osadchaya T.S., Trubacheeva N.V., Dobro-volskaya O.B., A cytogenetic study of the blue-grain line of the common wheat cultivar Sara-tovskaya 29. Russian Journal of Genetics, 2012, 48: 785-791 (doi: 10.1134/S102279541205002X).
- Gordeeva E., Badaeva E., Yudina R., Shchukina L., Shoeva O., Khlestkina E. Marker-assisted development of a blue-grained substitution line carrying the Thinopyrum ponticum chromosome 4Th(4D) in the spring bread wheat Saratovskaya 29 background. Agronomy, 2019, 9(11): 723 (doi: 10.3390/agronomy9110723).
- Zheng Q., Li B., Li H., Li Z. Utilization of blue-grained character in wheat breeding derived from Thinopyrum poticum. Journal of Genetics and Genomics, 2009, 36(9): 575-580 (doi: 10.1016/S1673-8527(08)60149-6).
- Burešová V., Kopecký D., Bartoš J., Martinek P., Watanabe N., Vyhnánek T., Doležel J. Variation in genome composition of blue-aleurone wheat. Theoretical and Applied Genetics, 2015, 128: 273-282 (doi: 10.1007/s00122-014-2427-3).
- Martinek P., Škorpík M., Chrpová J., Fučík P., Schweiger J. Development of the new winter wheat variety Skorpion with blue grain. Czech Journal of Genetics and Plant Breeding, 2013, 49: 90-94 (doi: 10.17221/7/2013-CJGPB).
- Дорофеев В.Ф., Филатенко А.А., Мигушова Э.Ф., Удачин Р.А., Якубцинер М. Культурная флора СССР. Т. 1. М., 1979.
- Habtemariam G., Mekbib H. Characterization and preliminary evaluation of ethiopian Triticum polonicum germplasm accession. PGRC/E-ICCA Germplasm Newsletter, 1988: 2-7.
- Belay G., Tesemma T., Bechere E., Mitiku D. Natural and human selection for purple-grain tetraploid wheats in the Ethiopian highlands. Genetic Resources and Crop Evolution, 1995, 42: 387-391 (doi: 10.1007/BF02432143).
- Хлесткина Е.К., Гордеева Е.И., Шоева О.Ю., Кукоева Т.В., Шаманин В.П., Моргу-нов А.И. Способ отбора линий яровой мягкой пшеницы с повышенным содержанием антоцианов в зерне. ФГБНУ ФИЦ Институт цитологии и генетики Сибирского отделения Российской академии наук, № 2762804. Заявл. 09.02.2021. Опубл. 23.12.2021. Бюл. № 36.
- Bustos D.V., Riegel R., Calderini D.F. Anthocyanin content of grains in purple wheat is affected by grain position, assimilate availability and agronomic management. Journal of Cereal Science, 2012, 55(3): 257-264 (doi: 10.1016/j.jcs.2011.12.001).


