Исследование режимов регенерации радия из его сульфата
Автор: Буткалюк Павел Сергеевич, Буткалюк Ирина Львовна, Корнилов Александр Степанович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-5 т.15, 2013 года.
Бесплатный доступ
Проведены исследования режимов регенерации радия из его сульфата с использованием имитатора радия-бария по методике, заключающейся в его растворении в растворе ЭДТА и Na 2CO 3 с последующим вытеснением радия из комплексов раствором Pb(NO 3) 2. Исследовано влияние концентрации Pb 2+, CO 32-, SO 42-, ЭДТА 2-, Ba 2+.
Изотопы, альфа-эмиттеры, радий, сульфат, карбонат
Короткий адрес: https://sciup.org/148202419
IDR: 148202419 | УДК: 621.039.3
Текст научной статьи Исследование режимов регенерации радия из его сульфата
Успехи в области клинических испытаний альфа-излучающих радионуклидов медицинского назначения на основе 213Bi [3], 225Ac [4] и 223Ra [5] возродили интерес к работам по облучению 226Ra в реакторах [6] и на ускорителях заряженных частиц [7-9]. Определенный интерес представляет использование для этих работ радия, извлеченного из источников ионизирующего излучения и радона. К настоящему времени срок эксплуатации большинства таких источников истек и они подлежат дорогостоящему захоронению.
Во избежание последствий, связанных с возможной разгерметизацией источников, значительная их часть содержит радий в форме сульфата. Сульфат радия является труднорастворимым соединением ( ПР = [ Ra 2 + ][ SO 4 ] = 4,25^10 -11 моль2/л2) [10] и не растворимым в водных растворах минеральных кислот, щелочей и в органических растворителях. Исключение составляют концентрированные серная и хлорная кислоты, а также щелочные растворы сильных комплек-сообразователей [11, 12]. Во многих случаях эти способы перевода сульфата радия в раствор неприемлемы, так как при изменении состава раствора (разбавление, изменение pH) происходит повторное выпадение осадка. Все это делает неудобным использование сульфата радия в качестве стартового материала для облучения в реакторе, так как затрудняет последующую радиохимическую переработку облученного материала.
Буткалюк Павел Сергеевич, научный сотрудник Отделения радионуклидных источников и препаратов.
Имеющиеся в литературе методы перевода сульфатов радия и бария в другие химические формы можно разделить на несколько типов. К первому типу относятся те, в которых происходит восстановление серы в сульфате под действием различных восстановителей.
Более распространенными способами перевода сульфатов радия и бария в другие соединения являются те, в которых происходит замещение сульфат-иона без его восстановления, т.е. основанные на обменных реакциях. Используют сплавление с Na2CO3 [13], нагревание в токе HCl [14], в токе HF [15], сплавление с метафосфатом натрия [16,17].
Неудобством методов, основанных на сплавлении, является длительность и коррозия используемых платиновых тиглей.
Наиболее распространенным является способ многократного кипячения сульфата радия в растворе Na2CO3 [18-20]. Недостатком этого процесса является длительность и низкий выход радия в форму RaCO3.
Все существующие методы перевода сульфата радия в растворимую форму являются или трудоемкими, длительными, или требующими нагревания высокоактивных солей до высоких температур, что нетехнологично.
Поэтому ранее нами был предложен новый экспресс-метод регенерации радия из его сульфата [1, 2]. В качестве базового метода была взята карбонизация сульфатов водными растворами карбонатов. Основной недостаток данного способа, низкая скорость гетерогенного процесса, можно устранить переводом сульфата радия в растворимое состояние действием щелочного раствора комплексообразователя (динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) или диэтилентриаминпентауксусная кислота (ДТПА)). После создания в растворе достаточной концентрации ионов CO32-, комплек- сы радия можно разрушить добавлением солей свинца (II), образующего с комплексонами более прочные комплексы, чем радий. Выделяющиеся ионы радия будут вступать в реакцию с ионами CO32- и SO42-, находящимися в растворе с образованием карбоната и сульфата в соотношениях, зависящих от концентраций реагентов.
В результате регенерации по данному методу полученный радий будет разбавлен солями свинца.
Целью данной работы было исследование влияния условий на полноту регенерации радия из сульфата. В работе варьировали концентрацию ионов Ba2+, Pb2+, SO42-, CO32-, а также соотношения ЭДТА:Pb.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Моделирование
С помощью программного комплекса Hyperquad Simulation and Speciation смоделировано поведение Ba2+ и Pb2+ в системах:
Pb2+-SO42--CO32—ЭДТА2-,
Pb2+-CO32-SO42-.
Ba2+ - SO42- - CO32- –Pb2+-ЭДТА2-.
При расчетах были учтены следующие равновесия [21]:
Ba2+ + SO42- ↔ BaSO4 pKs = 9,97
Pb2+ + SO42- ↔ PbSO4 pKs = 7,80
Pb2+ + CO32- ↔ PbCO3 pKs = 12,82
Ba2+ + CO32- ↔ BaCO3 pKs = 8,85
Pb2+ + 2OH- ↔ Pb(OH)2 pKs = 15,44
Ba2+ + ЭДТА2- ↔ BaЭДТА рК=8,00
Pb2++ ЭДТА2- ↔ PbЭДТА рК=18,20
PbCO3 + H2O ↔ Pb(OH)CO3- + H+ рК=10,90 Pb(OH)2 + H2O ↔ Pb(OH)3- рК=13,30
H4ЭДТА ↔ H+ + H3ЭДТА- рК=10,30
H3ЭДТА- ↔ H+ + H2ЭДТА2- рК=16,40
H2ЭДТА2- ↔ H+ + HЭДТА3- рК=19,10
HЭДТА3- ↔ H+ + ЭДТА4- рК=21,10
Все лабораторные эксперименты проводили с использованием имитатора радия - бария. Содержание бария определяли радиометрически по метке 133Ba с помощью многозадачного радиометра TRIATHLER.
Для выполнения экспериментов использовали хим. реактивы марки х.ч., азотную кислоту марки о.с.ч.
Исследование влияния концентрации ионов Ba2+, Pb2+, SO42-, CO32-
Для исследования влияния различных факторов на выход бария при регенерации его из сульфата была проведена следующая серия экспериментов. В 29 полипропиленовых флаконах приготовили растворы, соблюдая следующих порядок добавления реагентов: дистиллированная вода, 5% раствор ЭДТА (0,1343 М) в 0,030М NaOH, 2М раствор Na2CO3, 0,043М раствор Ba(NO3)2, раствор метки 133Ba(NO3)2, 0,043М раствор Na2SO4. Полученные растворы тщательно перемешивали и выдерживали в течение 1-2 ч для прохождения реакций изотопного обмена. После этого во флаконы добавляли рассчитанный объем 0,2 М Pb(NO3)2.
Флаконы плотно закрывали крышками, перемешивали в течение 4 ч на орбитальном лабораторном шейкере и оставляли на 16 ч для созревания выпавших осадков. Осадки отделяли от растворов фильтрованием через бумажные фильтры «зеленая лента» и промывали на фильтрах 5 мл 0,05М Na2CO3 и 10 мл дист. воды.
От фильтратов и промывных растворов отбирали аликвоты для определения объемной активности 133Ba. Осадки на фильтрах растворяли в 30 мл 2 М HNO3. После растворения осадков, фильтры промывали 5 мл дист. воды. Азотнокислые растворы осадков и промывные растворы собирали в мерных колбах объемом 50,0 мл. Растворы в колбах разводили до метки дист. водой и перемешивали. От полученных растворов отбирали аликвоты для определения объемной активности 133Ba.
После растворения осадков фильтры поместили в стаканы объемом 250 мл и нагревали в течение 1-2 ч с 50-100 мл раствора 5% ЭДТА + 10% NaOH. 5 мл полученной суспензии центрифугировали, от раствора отбирали аликвоты объемом 1,00 мл для определения объемной активности 133Ba. Барий в нерастворимом остатке на фильтре наиболее вероятно находится в форме сульфата, повторно выпадающего при разрушении комплексов бария или образующегося при растворении осадка карбоната бария из сульфат-ионов, находящихся в осадке в форме PbSO4 или в адсорбированной форме.
Исследование влияния соотношения ЭДТА:Pb
Для более детального исследования зависимости степени осаждения бария (радия) от количества добавленного свинца была проведена следующая серия экспериментов. В 3 стакана объемами 250 мл внесли навески BaSO4, содержащие метку 133Ba. Массы навесок составили 0,1020 г, 0,1020 г и 0,1089 г. Навески растворили при перемешивании в 100 мл раствора содержащего 0,06715 М ЭДТА и 0,4-2,0 М Na2CO3. Полученные смеси нагревали в течение 30 мин при температуре 60-70°C. После охлаждения до комнатной температуры объемы всех растворов довели до 100 мл.
К полученным растворам из бюретки добавляли 0,2 М раствор Pb(NO3)2 в 0,001 М HNO3. Добавление вели порциями по 1,00 мл. После добавления каждой порции раствор перемешивали в течение 1-2 мин. После добавления каждых 5 мл (после начала выпадения осадка каждый 1 мл) от раствора отбирали аликвоту объемом 2 мл, центрифугировали для отделения от выпадающего осадка. От маточного раствора отбирали аликвоту объемом 0,1 мл для определения объемной активности 133Ba. Остальное содержимое перемешивали и возвращали в реакционный объем. При расчете учитывали разбавление за счет добавления раствора нитрата свинца.
После прекращения видимого выпадения осадка все осадки от экспериментов отфильтровали через бумажные фильтры «синяя лента». В эксперименте №2 отделение осадка от конечной смеси проводили не фильтрованием, а центрифугированием. Осадки промывали порциями по 5 мл 0,01 М Na2CO3 и растворяли в 250 мл 2М HNO3. Нерастворимые остатки растворяли в 100 мл смеси 5% ЭДТА в 1 М NaOH при нагревании для растворения бария в виде сульфата. От всех растворов отбирали аликвоты для определения активности 133Ba.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Моделирование
Полученные расчетные кривые представлены на рис.1-3.
Согласно рис. 1 свинец предпочтительно связывается с ЭДТА, при достижении сотношения Pb:ЭДТА=1:1, свинец выпадает в осадок в виде карбоната. Образование осадка сульфата свинца возможно только при малом отношении исходных концентраций CO32- : SO42- (рис. 2).
С увеличением концентрации соды в растворе начало осаждения бария сдвигается в область меньших объемов добавленного нитрата свинца, а прямая осаждения становится более пологой. Это является закономерным следствием сдвига равновесия между комплексами PbЭДТА/ BaЭДТА в растворе и осадками соответствующих карбонатов при увеличении концентрации CO32- ионов. согласно расчетным данным выпадение PbCO3 начинается после достижения соотношения Pb:ЭДТА=1:1.
Исследование влияния концентрации ионов Ba2+, Pb2+, SO42-, CO32-
Согласно экспериментальным данным были построены кривые зависимости содержания бария в фильтрате от концентрации Na2CO3 (рис.4 (А)), кривая зависимости содержания бария в фильтрате от концентрации бария (рис.4 (Б)) и зависимость количества бария в остатке на фильтре от концентрации Na2CO3 (рис.5). Полученные экспериментальные данные подтверждают расчетные данные о том, что при увеличении концентрации Ba2+ или CO32- ионов в растворе увеличивается степень осаждения бария. При этом согласно рис. 5 в выпадающем осадке барий находится главным образом в виде карбоната. Согласно соотношению произведений растворимости для BaSO4 и BaCO3, барий только в виде карбоната будет находиться при достижении соотношения концентраций CO32-:SO42->100. Значимые количества сульфата бария в осадке
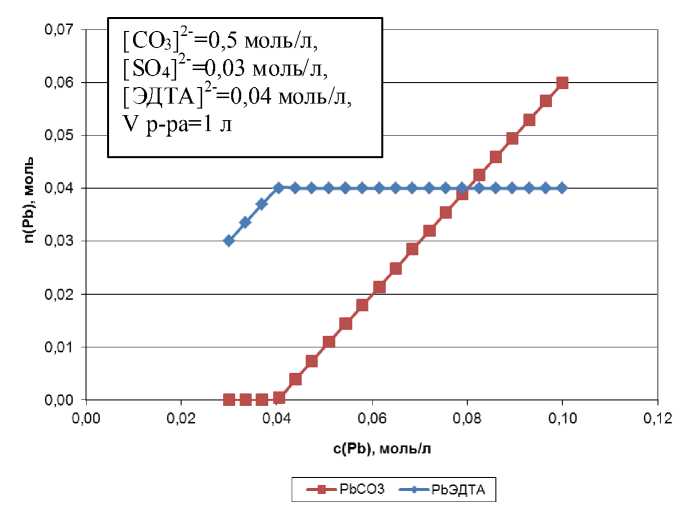
Рис. 1. Распределение свинца в системе Pb2+-SO42--CO32—ЭДТА2-
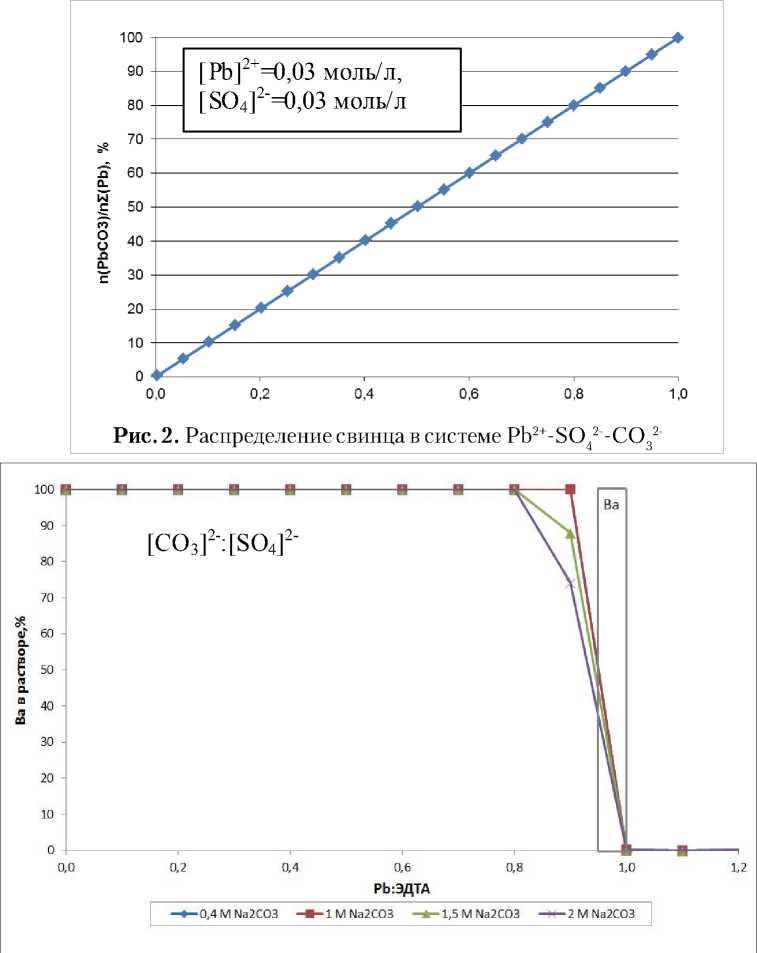
Рис. 3. Моделирование поведения бария и свинца при добавлении 0,2М раствора Pb(NO3)2 к 100 мл раствора, содержащего 0,1 г осадка BaSO4 и 0,067 моль/л ЭДТА, 0,015 моль/л NaOH, 0,4-2 моль/л Na2CO3. Доля ЭДТА, изначально связанного в комплекс с ионами Ba2+, отмечена серым прямоугольником (7%).
наблюдались только при концентрации Na2CO3 <0,1 моль/л.
На рис.6 (А) представлены зависимость содержания бария в фильтрате от концентрации солей свинца, зависимость содержания бария в фильтрате от концентрации SO42- (Б). Согласно экспериментальным и расчетным данным на степень осаждения карбоната бария не влияют исходная концентрация солей свинца (II) и концентрация SO42- ионов (в исследуемом диапазоне, когда с(CO32-):с(SO42-)>100), но в тоже время количество Pb(II) должно хватать на полное разрушение комплексов бария с ЭДТА. В частности, первая точка на графике зависимости концентрации бария в фильтрате от количества добавленного свинца (рис.6 А) демонстрирует случай, когда количество Pb2+ меньше количества ЭДТА в растворе.
На рис. 7 представлена зависимость содержания бария в фильтрате от концентрации ЭДТА.
Согласно экспериментальным данным никакой закономерности в зависимостях активности бария в нерастворимых остатках от исходных концентраций растворов Na2SO4, Pb2+, Ba2+ и ЭДТА в исследуемом диапазоне обнаружено не было. Все экспериментальные значения лежат в диапазоне от 0,2 до 2,7% от исходного количества бария.
При нулевой концентрации карбоната натрия барий почти полностью находится в фильтрате. То, что даже при отсутствии карбонат
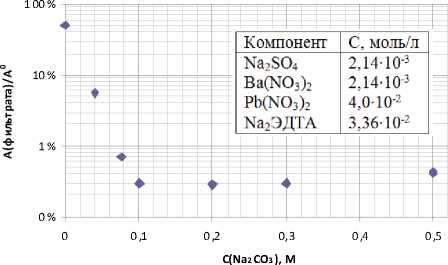
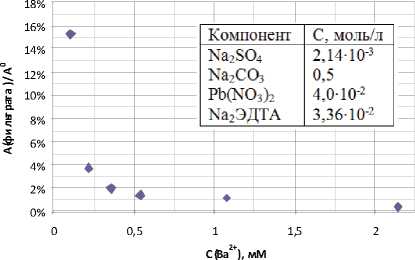
Рис. 4. Зависимость содержания бария в фильтрате от концентрации Na2CO3 (А), от концентрации бария (Б)
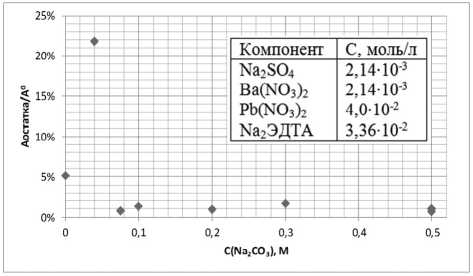
Рис. 5. Зависимость количества бария в остатке на фильтре от концентрации Na2CO3
центрации карбонат ионов практически не влияет на степень превращения бария. Так же не играет существенной роли концентрация ЭДТА и количество добавленного свинца, при условии, что суммарного количества ЭДТА должно хватать для полного растворение сульфата бария, а суммарного количества солей свинца на полное разрушение комплексов бария с ЭДТА. Не было обнаружено значимого влияния сульфат ионов в концентрации до 4 ммоль/л на степень регене- рации бария.
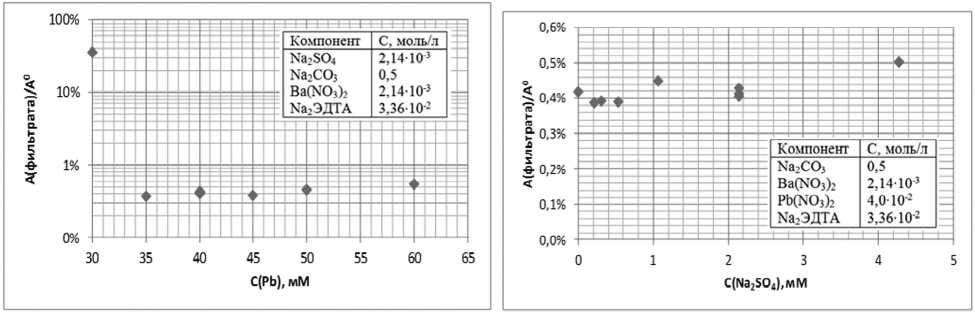
Рис. 6. Зависимость содержания бария в фильтрате от концентрации солей свинца (А), зависимость содержания бария в фильтрате от концентрации SO42-(Б)
Исследование влияния соотношения
ионов барий не выпадает в виде сульфата в осадок после разрушения комплексов с ЭДТА, может свидетельствовать о связывании SO42- c ионами свинца. Повышение же доли бария в нерастворимом осадке при низкой концентрации CO32-можно объяснить выпадением в осадок смеси BaCO3/BaSO4/PbCO3/PbSO4 и последующим прохождением обменных реакций при растворении осадка в кислоте
Ba2+ + PbSO4 = BaSO4 + Pb2+
Исходя из изображенного на рис. 4 А графика зависимости потерь бария с фильтратом от концентрации карбонат ионов в растворе можно утверждать, что методика осуществима при [CO32-] ≥ 0,1моль/л. Дальнейшее увеличение кон-
ЭДТА:Pb
На рис. 8 представлены зависимости содержания бария в растворе от соотношения Pb:ЭДТА. Начало снижения объемной активности бария в растворе совпадает с началом появления визуально наблюдаемого осадка, который не растворяется при длительном перемешивании.
В случае 2М Na2CO3 осадку предшествовало помутнение раствора при отношении Pb:ЭДТА >0,6.
В реакционной смеси большая часть ионов ЭДТА2- находится в свободном виде, меньшая часть в виде комплексов BaЭДТА. При добавлении раствора нитрата свинца свинец сначала связывается с ионами ЭДТА2-, которые не связа-
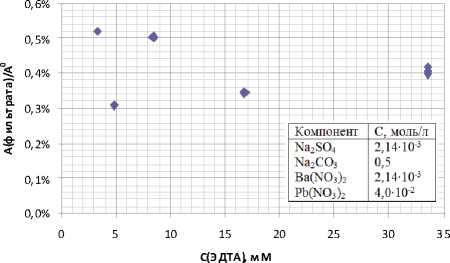
Рис. 7. Зависимость содержания бария в фильтрате от концентрации ЭДТА ны в комплекс с барием. Как только количество ионов свинца превысит количество свободных ионов бария, тогда должен начать выпадать BaCO3.
BaЭДТА + Pb2+ → Ba2+ + PbЭДТА (1)
Ba2+ + CO32- → BaCO3 ↓ (2)
Но согласно рис.6 во всех случаях карбонат бария начинает выпадать раньше, чем ионы Pb2+ полностью свяжут все «свободные» ионы ЭДТА2-. При избытке ЭДТА ионов в растворе равновесие реакции смещено влево.
BaЭДТА + CO32- → BaCO3 + ЭДТА2- (3)
По мере добавления свинца в раствор ионы
Pb2+ связываются с ионами ЭДТА по реакции
Pb2+ + ЭДТА2- → PbЭДТА (4)
Так как при этом уменьшается концентрация ионов ЭДТА в реакционной смеси, то равновесие реакции (3) смещается вправо и начинает выпадать осадок BaCO3.
Как видно из полученных графиков, при использовании 0,4М Na2CO3 осадок появляется практически при полном расходовании не связанного с барием ЭДТА, т.е. когда C(ЭДТА) = C(Pb) +C(Ba). При этом угол наклона прямой наибольший из трех представленных. Сам про- цесс в данном случае становится подобен радиометрическому титрованию ЭДТА свинцом со 133Ba в качестве индикатора.
С увеличением концентрации соды в растворе начало осаждения бария сдвигается в область меньших объемов добавленного нитрата свинца, а прямая осаждения становится более пологой. Это является закономерным следствием сдвига равновесия между комплексами PbЭДТА/ BaЭДТА в растворе и осадками соответствующих карбонатов при увеличении концентрации CO32- ионов.
В табл. 1 представлены экспериментальные данные по содержанию бария в фильтратах при извлечении бария из BaSO4. При всех исследованных концентрациях Na2CO3 при достижении соотношения Pb:ЭДТА = 1:1 барий в фильтрате практически отсутствует. Следовательно, при дальнейшем добавлении солей свинца в осадок выпадет карбонат свинца, не содержащий бария (радия). Поэтому варьировать соотношение Pb:Ba в осадке можно только изменяя момент начала выпадения карбонатов, который зависит от концентрации Na2CO3.
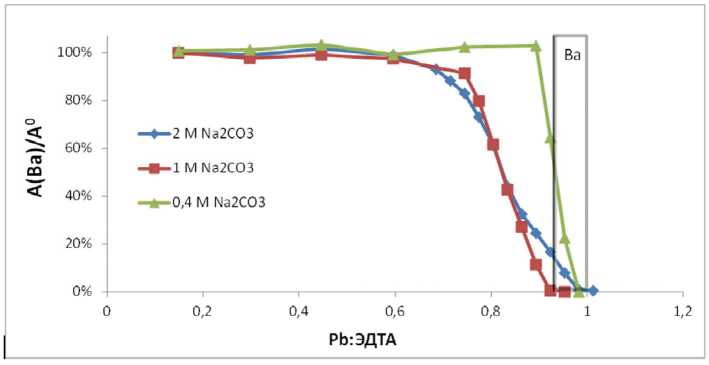
Рис. 8. Зависимость содержания бария в растворе BaSO4/ЭДТА/Na2CO3 при добавлении 0,2М Pb(NO3)2
Доля ЭДТА, изначально связанного в комплекс с ионами Ba2+, отмечена серым прямоугольником (6,5 ^ 7%)
Таблица 1. Содержание бария в фильтратах и нерастворимых остатках при извлечении бария из BaSO4.
|
№ |
Кон центрация Na2 CO3 , моль/л |
Итоговое соотношение Pb: ЭДТА |
133 Доля Ba в фильтрате |
|
1 |
0,4 |
1,07 |
<0,6% |
|
2 |
1,0 |
0,953 |
0,37% |
|
3 |
2,0 |
1,01 |
0,5% |
ВЫВОДЫ
Предложенный метод регенерации бария (радия) из сульфата осуществим при [CO32-] ≥ 0,1моль/л, при меньшей концентрации карбонат ионов наблюдаются значительные потери за счет неполного осаждения. С увеличением концентрации карбоната натрия в растворе начало осаждения бария сдвигается в область меньших объемов добавленного нитрата свинца. При всех исследованных концентрациях Na2CO3 при достижении соотношения Pb:ЭДТА = 1:1 барий в фильтрате практически отсутствует. Следовательно, при дальнейшем добавлении солей свинца в осадок выпадет карбонат свинца, не содержащий бария. Поэтому варьировать соотношение Pb:Ba в осадке можно только изменяя момент начала выпадения карбонатов, который зависит от концентрации Na2CO3. На полноту перевода бария в карбонат не оказывает значительного влияния концентрация ЭДТА, при условии, что количества ЭДТА должно хватать на полное растворение сульфата бария, а суммарного количества солей свинца на полное разрушение комплексов бария с ЭДТА.
При растворении образующихся осадков в азотной кислоте, часть бария оказывается в нерастворимом остатке, наиболее вероятно в форме сульфата. Количество бария в нерастворимом остатке не зависит от условий осаждения.
Работа выполнена при поддержке Министерства образования и науки Российской Федерации.
Список литературы Исследование режимов регенерации радия из его сульфата
- Кузнецов Р.А., Буткалюк П.С., Буткалюк И.Л. Разработка экспресс-метода регенерации радия из его сульфата//Радиохимия. 2013. Т.55. №. 1. С. 78-81.
- Способ регенерации радия из его сульфата. Патент РФ № 2441842.
- Sgouros G., Ballangrud A.M., Jurcic J.G., et al.//J. Nucl. Med. 1999. V. 40. №. 11. P. 1935-1946.
- Protein Design Labs Licenses Development Rights to SMART M195 Antibody to Actinium Pharmaceuticals//Actinium Pharmaceuticals Inc. Press Realize from 18.03.2003.
- Nilsson S., Larsen R.H., Fossa S., et al.//Clin. Cancer Res. 2005. V. 11. N. 12. P. 4451-4459.
- Вахетов Ф.З., Топоров Ю.Г.//Сборник трудов НИИАР. 2004. Т.1. С. 29-38.
- Apostolidis C., Molinet R., McGinley J., et al.//Appl. Radiat. Isot. 2005. V. 62. P. 383-387.
- Melville G., Meriarty H., Metcalfe P., et al.//Appl. Radiat. Isot. 2007. V. 65. P. 1014-1022.
- Melville G., Liu S. F., Allen B.J.//Appl. Radiat. Isot. 2006. V. 64. P. 979-988.
- Nikitin B., Tolmatscheff P.//Z. Phys. Chem. 1934. A. 167. P. 260.
- Бок Р. Методы разложения в аналитической химии. М.: Химия. 1984.
- Vebersik V., Norova K.//Z. Anal. Chem. 1958. V. 162. P. 401.
- ORNL Radioisotopes Procedures Manual. ORNL-3633. US Atomic energy commission. 1964. 167p.
- Вдовенко В.М., Дубасов Ю.В. Аналитическая химия радия. Л.: 1973. 187 с.
- REPORT KLX-1222. Summation report recovery of radium from k-65 residue. US Atomic energy commission. 1950. 51 p.
- Ballczo H., Doppler G. Natriummetaphosphat als Aufschluβmittel//Microchimica Act.a 1954. V. 42. N. 3-4. P. 403-412.
- Ballczo H., Doppler G. Die mikromaßanalytische Bariumsulfatbestimmung//Microchimica Acta. 1956. V. 44. N. 4-6. P. 734-740.
- Книпович Ю.Н., Морачевский Ю.В. Анализ минерального сырья. Л.: Химиздат, 1959. 1055 с.
- Ebler E., Bender W.//Z. Anorg. Chem. 1913. V. 83. P. 149.
- Curie M.//Traite de Radioactivite. 1910. V. 1. P. 164.
- Bredt O.P.C. Concentrating the Radium Contents of Radium Barium Sulfate Residues. US Patent 1,154,230. 1914.
- Новый справочник химика-технолога в 10 томах. С-Пб.: Мир и Семья, 2002.


