Исследование системы иодид бария-ГМТА-вода
Автор: Алтыбаева Дильбара Тойчуевна, Абдуллаева Жыпаргуль Душабаевна, Атакулова Б. М., Джумаева Ж. Ш., Мирзаева Махира
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 12 т.7, 2021 года.
Бесплатный доступ
Актуальность. В статье изучены гетерогенные равновесия в тройных водных системах BaI2 - (CH2)6N4 - H2O, синтезированные комплексы могут быть применены в качестве антибактериального препарата в ветеринарии. Материалы и методы исследования: гетерогенные равновесия были изучены изотермическим методом растворимости при 25 °C. Установлены концентрационные пределы существования соединений и типы их растворимости. Цели исследования: определить тип химической связи между комплексообразователем и лигандом, а также общие закономерности термического разложения синтезированных соединений. Результаты исследования: изучена и составлена изотерма растворимости системы BaI2 - (CH2)6N4 - H2O. Выводы: выявлено влияние анионов на комплексообразование и состав образующихся соединений.
Гетерогенные равновесия, изотермический метод, изотерма растворимости, комплексообразователь
Короткий адрес: https://sciup.org/14121596
IDR: 14121596 | УДК: 541.486.541.11.541.49 | DOI: 10.33619/2414-2948/73/01
Текст научной статьи Исследование системы иодид бария-ГМТА-вода
Бюллетень науки и практики / Bulletin of Science and Practice
Исследование комплексов биометаллов с ионами брома, иода с фармако-физиологическим лигандом гексаметилентетрамином (ГМТА) позволяет определить их особенности, выявить новые полезные свойства. Йод принадлежит к жизненно важным микроэлементам, который участвует в нормальном функционировании человеческого организма и является структурным компонентом гормонов щитовидной железы [1].
Многие работы, однако, выполнены препаративным методом, не позволяющим определить их концентрационные пределы. Вследствие этого данные о составе эти соединений противоречивы. С точки зрения развития теории координационной химии [2] представляет интерес изучение взаимного влияния лигандов (ГМТА, вода, анионы) на процесс комплексообразования, а также зависимости состава и строение образуемых ими комплексных соединений [3]. Изучение этих вопросов послужит основой для установления общих закономерностей процессов комплексообразования соединений, содержащих ионы металла – органический лиганд – вода, а также их взаимосвязь в последовательности состав – строение – свойства.
Таким образом, необходимым является изучение влияния на комплексообразование галогенидов бария, концентрации компонентов на физико-химические свойства, образующихся соединений, а также выявление закономерностей термохимических превращений полученных соединений, определение температуры разложения, определение химической связи между комплексообразователем и лигандам, что и обуславливает актуальность настоящего исследования.
Цели и задачи исследования. Целью работы было установить общие закономерности комплексообразования в тройных водных системах [4], содержащих иодид бария и ГМТА.
Материал и методы исследования
В статье использованы следующие методы исследования: метод растворимости для изучения гетерогенных равновесий в тройных водных системах иодид бария – ГМТА – вода при 25 °С; определение состава и концентрационных пределов существования соединений, а также установить характер их растворимости, физикo-химические свойства синтезированных соединений, наметить пути практического использования полученных соединений.
Растворимость новых соединений в органических растворителях
Определение растворимости синтезированных соединений проводилось с целью подбора индифферентной жидкости для определения плотности кристаллов. Для этой цели были взяты следующие растворители: бензол, четыреххлористый углерод, ацетон, хлороформ. Определение проводилось следующим образом. Колбу емкостью 50 мл с измельченным испытуемым комплексом, который заливали органической жидкостью до получения насыщенного раствора, помещали в термостат, где выдерживали в течение суток с периодическим перемешиванием при 25 °С. После этого во взвешенные бюксы отфильтровывали и взвешивали часть растворителя. Затем фильтрат выпаривали и вес бюкса доводили до постоянного значения.
Результаты и обсуждение
Гексаметилентетрамин, (CH 2 ) 6 N 4 (ГМТА), являющийся производным формальдегида, впервые был получен в 1859 г. А. М. Бутлеровым в реакции взаимодействия газообразного аммиака с параформальдегидом [5]. А. В. Гофманом [6] в 1869 г. была представлена реакция, получения ГМТА из водного раствора формальдегида и газообразного аммиака. Эта реакция имеет следующий вид:
6СН 2 О (В) + 4NH 3 (r) → (CH 2 ) 6 N 4 + 6Н 2 Ож + 81 ккал.
В настоящее время гексаметилентетрамин получают пропусканием газообразного аммиака (при температуре 20, 100, 150 °С) через 30%-ный раствор формалина, содержащего 1–2% метанола. ГМТА — бесцветное, не имеющее запаха кристаллическое вещество со сладковатым вкусом, кристаллизуется при обычных условиях из водных растворов в безводной форме, в виде ромбических додекаэдров. Изотерма растворимости системы ВаI 2 – (CH 2 ) 6 N 4 – H 2 O. Результаты исследования растворимости приведены в Таблице 1 и представлены на Рисунке.
Таблица 1
|
ИЗОТЕРМА РАСТВОРИМОСТИ СИСТЕМЫ ВаI 2 – (CH 2 ) 6 N 4 – H 2 O при 25 °C |
|||||||
|
№ точки |
Состав жидкой фазы масс.% |
Состав твердого остатка масс.% |
Молекулярный состав твердых фаз |
||||
|
ВаI 2 |
(CH 2 ) 6 N 4 |
Z солей |
ВаI 2 |
(CH 2 ) 6 N 4 |
Z солей |
||
|
1 |
68,60 |
— |
68,60 |
78,34 |
— |
78,34 |
ВаI 2 × 2H 2 O |
|
2 |
— |
— |
— |
76,70 |
0,2 |
76,91 |
ВаI 2 × 2H 2 O |
|
3 |
56,02 |
4,28 |
60,30 |
— |
0,43 |
77,13 |
ВаI 2 × 2H 2 O |
|
4 |
71,65 |
0,04 |
78,69 |
ВаI 2 × 2H 2 O |
|||
|
5 |
58,12 |
22,10 |
80,22 |
ВаI 2 ×2H 2 O+ВаI 2 ×2(CH 2 ) 6 N 4 ×8H 2 O |
|||
|
6 |
50,80 |
24,26 |
75,06 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|||
|
7 |
51,32 |
5,21 |
56,53 |
48,96 |
25,26 |
74,22 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|
8 |
44,11 |
7,98 |
52,09 |
46,78 |
26,23 |
72,01 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|
9 |
37,68 |
11,81 |
49,49 |
44,19 |
25,70 |
69,98 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|
10 |
31,69 |
15,63 |
47,32 |
41,00 |
26,41 |
67,41 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|
11 |
25,66 |
21,14 |
46,80 |
39,96 |
29,63 |
69,59 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|
12 |
2,09 |
27,31 |
49,40 |
38,25 |
31,86 |
60,09 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|
13 |
40,00 |
35,46 |
75,46 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|||
|
14 |
29,41 |
47,14 |
76,55 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O |
|||
|
15 |
20,98 |
38,02 |
59,00 |
21,13 |
57,98 |
79,11 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O +(CH 2 ) 6 N 4 |
|
16 |
ВаI 2 × 2(CH 2 ) 6 N 4 × 8H 2 O +(CH 2 ) 6 N 4 |
||||||
|
17 |
14,43 |
38,58 |
53,01 |
2,01 |
92,00 |
94,01 |
(CH 2 ) 6 N 4 |
|
18 |
10.55 |
40,59 |
51,09 |
1,02 |
93,12 |
94,14 |
(CH 2 ) 6 N 4 |
|
19 |
5,50 |
43,19 |
48,69 |
0,80 |
93,71 |
94,51 |
(CH 2 ) 6 N 4 |
|
20 |
— |
(CH 2 ) 6 N 4 |
|||||
|
21 |
47,00 |
47,00 |
— |
100,00 |
100,00 |
— |
(CH 2 ) 6 N 4 |
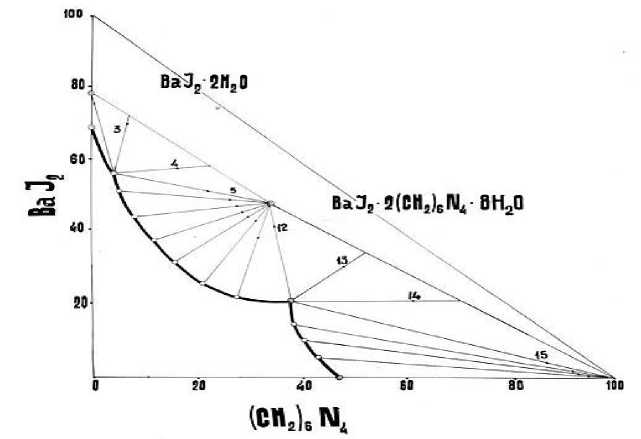
Рисунок. Изотерма растворимости ВаI 2 – (CH 2 ) 6 N 4 – H 2 O при 25 °С.
Как видно из Рисунка, изотерма растворимости системы характеризуется тремя ветвями кристаллизации. Крайние две ветви отвечает выделению в твердую фазу исходных компонентов: шестиводного иодида бария, растворимость которого равна 66,80% и гексаметилентетрамина. В области средней ветви (точки 5–12), соответствующей следующей концентрации исходных компонентов: иодида бария 55,02–20,98%, ГМТА 4,28–38,02%, в твердую фазу выделяется новое соединение Ва1 2 2(CH 2 ) 6 N 4 x 8H 2 O, растворимое в воде конгруэнтно.
Исследование термической устойчивости соединений
Исследование термической устойчивости соединения в Таблице 2 сопровождалось изучением ИК-спектров остатков, что позволило качественно расшифровать многие термоэффекты: дериватограмма ГМТА характеризуется двумя эффектами. Первый эффект при 282° соответствует возгонке ГМТА. При дальнейшем повышении температуры наблюдается незначительное разложение ГМТА. Экзотермический эффект при 530°, вероятно, обусловлено окислением оставшегося углерода.
Таблица 2
ТЕРМИЧЕСКИЕ ЭФФЕКТЫ СОЕДИНЕНИЯ ГМТА С ИОДИДОМ БАРИЯ
|
Формулы соединения |
Термоэффекты |
Выводы |
|
(CH 2 ) 6 N 4 |
282° |
Возгонка с незначительным разложением |
|
ВаI 2 × 2Н 2 О (лит.) |
99° |
Обезвоживание |
|
ВаI 2 × (CH 2 ) 6 N 4 × 8H 2 O |
160° |
Ступенчатая дегидратация |
|
246° |
Разложение комплекса |
|
|
274° |
Выводы
Выделенные соединения подвергали обезвоживанию, а затем снимали спектры поглощения в вазелиновом масле. На ИК-спектрах обезвоживание основные полосы валентных колебаний ГМТА расщеплены.
Это подтверждает то, что ГМТА в данном соединении с ионом металла связан одним атомом азота, показывая координационную емкость, равную одному.
Таким образом мы приходим к выводу, что отсутствие расщепления не является основанием для подтверждения того, что ГМТА связан четырьмя атомами азота, а следует отметить наличие двух различных типов связи молекул воды в комплексе.
Список литературы Исследование системы иодид бария-ГМТА-вода
- Трошина Е. А., Платонова Н. М. Метаболизм йода и профилактика йододефицитных заболеваний у детей и подростков // Вопросы современной педиатрии. 2008. Т. 7. №3. С. 66-75.
- Михайлов О. В. Структура вещества и теории химических процессов. "Координационное соединение" // Вестник Казанского технологического университета. 2003. №1. С. 7-10.
- Сироткин О. С., Сироткин Р. О., Татаринцева Т. Б. Комплексные соединения в рамках системной классификации химических веществ // Вестник Казанского технологического университета. 2017. Т. 20. №11. С. 11-17.
- Трошанин Н. В., Бычкова Т. И. Гетеролигандные комплексы кобальта (II) с гидразидами некоторых ароматических кислот и L-гистидином // Ученые записки Казанского университета. Серия Естественные науки. 2019. Т. 161. №1. С. 31-41. DOI: 10.26907/2542-064X.2019.1.31-41
- Бердоносов Д. Ю., Гуменюк Г. Я., Тарасов К. С. Разработка генератора газообразного формальдегида и метода анализа формальдегида в газовой и к-фазе, образующихся при работе генератора // Известия Санкт-Петербургского государственного технологического института (технического университета). 2007. №2. С. 66-69.
- Арбузов А. Е. Краткий очерк развития органической химии в России. М.; Л., 1948. 224 с.


