Исследование соотношения прооксидантной и антиоксидантной систем при опухолях кишечника
Автор: Зуйков С.А., Борзенко Б.Г., Зуйкова О.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (62), 2014 года.
Бесплатный доступ
Исследована взаимосвязь обмена пуриновых нуклеотидов с антиоксидантной системой у больных раком толстой кишки, а также влияние ключевых ферментов распада пуринов на пул образования активных форм кислорода. В ходе исследования были определены ферментативные показатели прооксидантной системы: аденозиндезаминаза и ксантиноксидаза, а также уровень оксида азота. Показателем антирадикальной системы служили супероксиддисмутаза и глутатионпероксидаза. Было обследовано 22 больных колоректальным раком (КРР) I-IV стадий, в возрасте 40-59 лет. Установлено значимое повышение показателей прооксидантной системы в гомогенате опухолевой ткани относительно неизмененной ткани слизистой кишечника у больных КРР и неоднозначное изменение активности антиоксидантной системы в зависимости от стадии заболевания. Выявлено, что при окислительном стрессе и в условиях гипоксии на более поздних стадиях рака антиоксиданты могут способствовать лучшему выживанию опухолевых клеток и более быстрому прогрессированию опухоли.
Ксантиноксидаза, аденозиндезаминаза, оксид азота, супероксиддисмутаза, глутатионпероксидаза, колоректальный рак
Короткий адрес: https://sciup.org/14056415
IDR: 14056415 | УДК: 616.345-006.6-008.9-053:612.396
Текст научной статьи Исследование соотношения прооксидантной и антиоксидантной систем при опухолях кишечника
Онкологические заболевания являются актуальной проблемой в Украине и во всем мире, а опухоли кишечника занимают одно из первых мест в структуре данной патологии [2]. Известно, что при раке толстой кишки происходит нарушение кровотока в слизистой оболочке, приводящее к гипоксическим явлениям различной выраженности, с последующим нарушением утилизации кислорода и усиленной генерацией свободных радикалов [10]. Такие факторы, как активация гликолиза, усиление синтеза компонентов нуклеиновых кислот и клеточных структур: нуклеотидов, белков, компонентов мембран, как правило, связаны с высокой пролиферативной активностью. Установлено, что онкологическим больным присуща серия метаболических нарушений, тесно связанных между собой [6]. При этом изменения в нуклеиновом, углеводном, энергетическом обменах и в антиоксидантной системе могут быть обусловлены репарационными процессами и быть этапом в развитии онкологической патологии [1].
Целью исследования являлось изучение обмена нуклеотидов и его взаимосвязи с прооксидант-ной (ПОС) и антиоксидантной системами (АОС) в гомогенате опухолевых тканей больных колоректальным раком (КРР) различной стадии.
Нами была изучена активность ключевых ферментов распада пуриновых нуклеотидов: адено-зиндезаминазы (АДА) и ксантиноксидазы (КО), которые являются ферментативными источниками образования активных форм кислорода (АФК), оказывающих существенное влияние на пул прооксидантов [13], а также неферментативного представителя ПОС – оксида азота (NO), способного проявлять свободнорадикальные свойства. Для изучения антиоксидантного звена защиты нами были определены активности ее ключевых ферментов: супероксиддисмутазы (СОД) и глутатионпероксидазы (ГПО) [12]. Значения этих показателей в гомогенатах тканей мы определяли для изучения действия ПОС и АОС при РТК.
Материал и методы
Исследование показателей проводилось в гомогенате ткани опухоли. Контролем служила неизмененная ткань слизистой оболочки кишечника – ткань края резекции, отдаленная от опухоли (min 30 мм от опухолевого инфильтрата) и не имеющая признаков злокачественной трансформации. Материал для исследования был взят после радикальной операции. Обследовано 22 больных (15 мужчин и 7 женщин) в возрасте от 40 до 59 лет, средний возраст составил 52 года. Основной гистологической формой КРР была умереннодифференцированная аденокарцинома (G2), выявленная в 11 случаях, низкодифференцированная аденокарцинома (G3) диагностирована у 7, высокодифференцированная аденокарцинома (G1) – у 4 больных. Пациенты были разделены на две группы в зависимости от стадии рака: в 1-ю группу были включены 12 человек с I–II стадией, во 2-ю группу – 10 человек с III–IV стадией рака. При проведении статистического анализа исследуемых показателей ПОС и АОС по гендерному признаку значимых отличий нами не обнаружено.
Активность АДА определяли по изменению оптической плотности реакционной смеси при длине волны 265 нм, обусловленному накоплением инозина при гидролитическом распаде аденозина [11]. Определение активности КО основано на способности фермента генерировать супероксид-анион-радикал, о содержании которого судили по скорости восстановления нитросинего тетразолия в формазан [3]. Эндогенный уровень NO в форме нитрит-аниона (NO2-) после энзиматического восстановления нитратов в нитриты определяли с по- мощью классической реакции Грисса и обозначали как NOх [4]. Активность СОД определялась по торможению аутоокисления адреналина, окисляющегося самопроизвольно в щелочной среде с образованием окрашенного соединения – адренохрома с пиком поглощения на 480 нм. Активность СОД выражалась в единицах активности на мг белка (ед/мг). За 1 условную единицу активности СОД принимают количество фермента, необходимое для замедления реакции аутоокисления адреналина в 2 раза. Определение активности ГПО основано на измерении скорости окисления восстановленного глутатиона (GSH) в присутствии энзима и НАДФН, регистрируемого спектрофотометрически по изменению оптической плотности среды в процессе реакции, 1 мкМ НАДФН соответствует 1 мкМ GSH. Все исследуемые показатели определялись спектрофотометрически и регистрировались на спектрофотометре Specord-200. Статистическая обработка данных проводилась с помощью программы «Statistica 10.0» Statsoft. Для проверки распределения данных на нормальность использовался критерий W Шапиро – Уилка. Корреляционный анализ проводился с помощью критерия ранговой корреляции Спирмена.
Исследование соответствует этическим принципам клинических испытаний и положениям Хельсинской декларации Всемирной медицинской ассоциации, не нарушает интересы пациента и не вредит его здоровью (Комиссия по биоэтике Донецкого национального медицинского университета им. М. Горького).
Авторы заявляют, что не имеют конкурирующих интересов.
Результаты исследования
При исследовании ферментативных и неферментативных представителей ПОС у больных КРР нами было установлено увеличение всех показателей в опухолевой ткани относительно слизистой как в первой, так и во второй группе онкобольных. Одновременно исследовав активность ферментов АОС, мы установили снижение всех показателей в опухолевой ткани относительно неизмененной ткани слизистой (таблица). Полученные данные свидетельствуют об ослаблении антиоксидантной системы в опухолевой ткани относительно неизмененной слизистой, что проявляется снижением активности ее ферментативных представителей СОД и ГПО, при этом обнаруженное увеличение
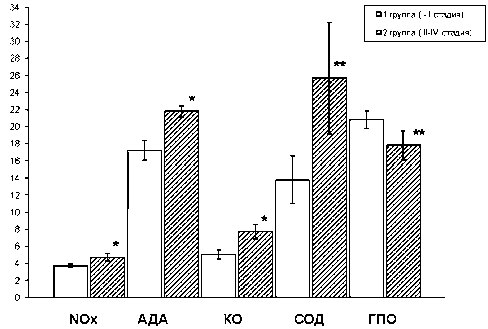
Рис. 1. Сравнение исследуемых показателей прооксидантной и антиоксидантной систем в гомогенате опухолевых тканей у больных КРР при разной стадии заболевания (М ± σ): по оси Х – исследуемые показатели ПОС и АОС в гомогенате ткани опухоли, по оси Y – активности исследуемых показателей.
Примечание: * – различия статистически значимы по сравнению с показателями 1-й группы (КРР I–II стадий), p<0,001;
** – различия статистически значимы по сравнению с показателями 1-й группы (КРР I–II стадий), p<0,05
активности ферментативных и уровня неферментативных показателей ПОС способствует усилению окислительного стресса у онкобольных.
Обсуждение
При сравнении исследуемых показателей в гомогенате опухолевой ткани в зависимости от стадии рака было обнаружено значимое увеличение всех представителей ПОС у больных КРР на более поздних стадиях заболевания. Однако в работе АОС наблюдались неоднозначные изменения: обнаружено, что активность СОД увеличивалась в опухолевой ткани во второй группе относительно первой практически в 2 раза, при этом фермент второй линии защиты ГПО сохранял тенденцию к снижению (рис. 1).
Такую динамику можно объяснить следующим. Повышение содержания АФК сопровождается истощением активности ферментов АОС, а именно, известно, что АФК наиболее интенсивно атакуют тиоловые белки, окисляя SH-группы, что приводит к их структурной модификации. Такими белками являются ключевые ферменты метаболизма углеводов, нуклеотидов и системы антирадикальной защиты, один из которых ГПО [5]. Причем данная модификация приводит к переходу КО из деги-дрогеназной формы, которая работает в физиологических условиях, в оксидазную, образующую супероксиданион радикал (О2-), что еще больше способствует усиленному образованию АФК [7].
Известно, что при данной патологии наблюдаются гипоксические процессы в клетке, стимулирующие нитратредуктазную активность, и, как следствие, возрастание уровня NOx, необходимых для генерации NO. Избыточный синтез NO, сочетающийся с гиперпродукцией О2-, приводит к взаимодействию этих метаболитов друг с другом с синтезом пероксинитрита (ONOO-), способного к образованию нитрозаминов, обладающих канцерогенными свойствами, что, в свою очередь, препятствует гибели раковых клеток по механизму апоптоза, но способствует усилению метастазирования опухолевых клеток [8], так как опухолевый процесс связан с усиленной генерацией активных форм кислорода, которые играют двоякую роль в канцерогенезе, выступая, с одной стороны, фактором прогрессии опухоли, а с другой – при очень высокой концентрации могут необратимо повредить и саму раковую клетку [9].
Показатели прооксидантной и антиоксидантной систем в гомогенате тканей у больных Крр в зависимости от стадии заболевания (М± σ )
Таблица
|
Показатели |
1-я группа, I–II стадия (n=12) |
2-я группа, III–IV стадия (n=10) |
||
|
Неизмененная слизистая |
Опухоль |
Неизмененная слизистая |
Опухоль |
|
|
NOx, мкмоль/л |
2,02 ± 0,22 |
3,74 ± 0,16** |
2,56 ± 0,38 |
4,74 ± 0,42** |
|
АДА, нмоль/мин×мг |
10,2 ± 0,87 |
17,2 ± 1,17** |
12,6 ± 0,81 |
21,8 ± 0,63** |
|
КО, мкмоль/мин×мг |
2,88 ± 0,29 |
5,06 ± 0,52* |
3,58 ± 0,34 |
7,75 ± 0,83** |
|
СОД, ед/мг |
46,7 ± 8,06 |
13,8 ± 2,79** |
57,7 ± 6,40 |
25,7 ± 6,52** |
|
ГПО, мкмоль/мин×мг |
26,3 ± 1,15 |
20,8 ± 1,02* |
22,6 ± 0,99 |
17,8 ± 1,66** |
Примечание: * – различия статистически значимы по сравнению неизмененной тканью слизистой оболочки кишечника (p<0,05); ** – различия статистически значимы по сравнению с неизмененной тканью слизистой оболочки кишечника (p<0,001).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2014. № 2 (62)
Таким образом, можно говорить о том, что при сходном уровне генерации супероксида (безусловно, повышенном), у больных 2-й группы в опухоли имеется значительное усиление антирадикальной защиты, что может способствовать лучшему выживанию опухолевых клеток и более быстрому прогрессированию опухоли (это согласуется с клиническим течением заболевания у данной группы больных).
Заключение
Установленные нарушения работы АОС в гомогенате ткани опухоли оказывают существенное влияние на жизнеспособность опухолевой клетки и её функциональную полноценность, что более характерно на поздних стадиях заболевания. Такие нарушения вызывают дисбаланс между ПОС и АОС, которые тесно связаны с ферментативными изменениями в обмене нуклеотидов, способствуют регуляции друг друга по принципу обратной связи, что приводит к развитию окислительного стресса и, как следствие, структурной модификации, прежде всего, биомембран, ферментов и нуклеотидов. От степени выраженности этих нарушений, в свою очередь, зависит интенсивность обменных процессов и патогенетическая перестройка на клеточном уровне. Следовательно, баланс между окислителями и антиоксидантами является ключевым вопросом в развитии рака, который остается актуальным до настоящего времени.


