Исследование специфичных свойств регулярного мультимолекулярного сорбента Fe (III)
Автор: Гладилович В.Д., Шрейнер Екатерина Владимировна, Дубровский Я.А., Колоницкий П.Д., Краснов К.А., Бабина Е.В., Мурашко Е.А., Бабаков В.Н., Кельциева О.А., Краснов И.А., Ануров М.С., Русских Я.В., Чернова Е.Н., Жаковская З.А., Суходолов Н.Г., Селютин А.А., Александрова М.Л., Подольская Е.П.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Хроматография, ПЦР-, ДНК-анализ
Статья в выпуске: 1 т.23, 2013 года.
Бесплатный доступ
В настоящее время проблема специфичного выделения различных веществ из сложных смесей, в том числе биологических образцов, стоит весьма остро. Одним из методов, позволяющих решать такие задачи, является металл-аффинная хроматография. Исторически ее использовали для обогащения фосфорсодержащих пептидов, однако представляется возможным применять ее для обогащения и других классов веществ. В работе проведено исследование специфичных свойств нового регулярного мультимолекулярного сорбента на основе стеарата железа(III). Показано, что с помощью металл-аффинной хроматографии на РММС Fe(III) могут быть успешно выделены и проанализированы такие типы соединений, как фосфорорганические соединения (фосфорилированные пептиды, фосфонилированные пептиды, пестициды), фторкислоты (перфтороктановая сульфокислота), токсины цианобактерий (микроцистин-RR).
Металл-аффинная хроматография, регулярный мультимолекулярный сорбент, стеарат железа (iii), фосфорилированные пептиды, фосфонилированные пептиды, пестициды, фторкислоты, микроцистин
Короткий адрес: https://sciup.org/14264834
IDR: 14264834 | УДК: 543.544.17
Текст научной статьи Исследование специфичных свойств регулярного мультимолекулярного сорбента Fe (III)
Объектом исследования данной работы являются сорбенты для металл-аффинной хроматографии (МАХ), предназначенные для разделения и выделения различных веществ в аналитической химии, биохимии, медицине. В основе данного хроматографического метода лежит различное сродство органических соединений к ионам некоторых металлов, обусловленное образованием координационных связей между металлом и гетероатомами в молекулах органических соединений (кислород, сера, фосфор, азот). Ионы металлов связывают различными способами. Самым популярным является метод хелатирования иона металла полидентантными лигандами, иммобилизованными на вспомогательной подложке (силикагель, агароза, сефароза, сшитый сополимер полистирола и дивинилбензола и др.).
Принцип этого метода впервые был сформулирован в работе Пората в 1975 году. С тех пор метод нашел применение в различных областях науки. Основные направления использования металл-аффинных сорбентов [1–3] следующие.
-
1. Металл-аффинная хроматография является высокоспецифичным методом пробоподготовки, который успешно применяется при решении многих протеомных задач для снижения числа маскирующих пептидов в образце, а также обогащения
-
2. Специфичное выделение или разделение химических веществ (в том числе макромолекул, например белков) из матриц различного типа [6]. В данном случае выбор условий хроматографического разделения, а также иммобилизованного иона металла зависит от свойств анализируемых биомолекул.
-
3. Ионообменные смолы [7]. Ионообменные смолы являются полимерными органическими соединениями, содержащими функциональные группы, способные вовлекаться в ионный обмен. Новейшие методы ионообменной хроматографии, в частности высокоэффективная хроматография (ВЭЖХ), широко используются в фармакологии (при создании и определении лекарственных веществ), в клинической биохимии (при определении биологически активных веществ в физиологических жидкостях), в биотехнологических процессах и производствах и других областях.
-
4. Очистка производных ДНК и олигонуклеотидов, меченных остатками гистидина. Благодаря относительно высокому аффинному сродству ионов металла к гистидину отчистка таких соединений с помощью МАХ в большинстве случаев приводит к такой степени отчистки макромолекул,
пептидных смесей некоторыми типами пептидов (например, фосфорсодержащими, серасодержащими) для последующего масс-спектрометрического анализа [4, 5].
которая является достаточной для большинства методов исследования [8].
Выделение органических соединений с помощью металл-аффинных сорбентов чрезвычайно перспективно. Использование различных ионов металлов дает возможность регулировать сродство сорбента к различным веществам, при этом значительно возрастает специфичность разделения по сравнению с другими методами. Разнообразие свойств металл-аффинных сорбентов позволяет решать большое число аналитических задач.
Но одними из наиболее распространенных на сегодняшний день объектами исследования с помощью металл-аффинной хроматографии являются фосфорилированные соединения и фосфобелки. Нами было сделано предположение о возможности использования в качестве аналитических объектов не только фосфорилированных, но и фосфонилированных пептидов, пестицидов, а также соединений, имеющих пептидную природу (токсины цианобактерий). Кроме того, учитывая тот факт, что трехвалентные металлы являются жесткими кислотами Льюиса, соответственно, по теории Пирсона, они должны взаимодействовать с жесткими основаниями, к которым относится кислород и фтор, и чтобы доказать это предположение, в качестве объекта, содержащего фтор, была выбрана перфтороктансульфоновая кислота.
В последние годы ведутся активные поиски новых металл-аффинных сорбентов, и недавно был разработан новый регулярный мультимолекуляр-ный сорбент на основе стеарата трехвалентного железа. В работе [9] было показано, что он действительно обладает свойствами металл-аффинного сорбента и имеет достаточно высокую сорбционную емкость по фосфорилированному пептиду, т. е. может быть применен в классических фосфо-протеомных исследованиях. Однако интерес представляет изучение и других специфичных свойств данного сорбента.
Таким образом, целью работы было исследовать специфичность нового регулярного мульти-молекулярного сорбента на основе стеарата Fe(III) для таких типов соединений, как токсины цианобактерий (микроцистин-RR), фторкислоты (перфтороктановая сульфокислота), фосфорорганические соединения (фосфонилированные пептиды, пестициды).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Металл-аффинная хроматография микроцистина-RR на РММС Fe(III)
-
2 коллапсированных РММС Fe(III) поместили в носик между двумя мембранами для исключения вымывания сорбента. Сорбент при помощи шпри-
- ца промыли 20 мкл ацетонитрила, затем 20 мкл 0.1 % ТФУ. После этого через сорбент трижды медленно пропустили 5 мкл раствора микроцис-тина-RR в воде (концентрация 5 нг/мл). Затем снова промыли 20 мкл 0.1 % ТФУ и провели последовательную элюцию 5 мкл 0.4 М водным аммиаком и 0.5 % водным пиперидином по 5 мкл каждого. Проскок и элюаты анализировали методом MALDI TOF.
Металл-аффинная хроматография перфтороктансульфоновой кислоты на РММС Fe(III)
20 коллапсированных монослоев РММС Fe(III) перенесли в спиновую колонку. Колонку поместили в микропробирку объемом 1.5 мл и с помощью центрифуги (3 мин при 5000 об./мин) удалили избыток жидкой фазы. Затем в колонку поместили 100 мкл 100 % ацетонитрила и в тех же условиях его удалили. Для проведения анализа в спиновую колонку, содержащую промытый ацетонитрилом сорбент, добавили 100 мкл раствора перфторок-тансульфоновой кислоты в 0.1 % ТФУ в воде с концентрацией 1 мкг/мл и оставили на 20 минут на перемешивающей платформе, после чего избыток жидкой фазы также удалили при помощи центрифуги. Проскок оставили для проведения масс-спектрометрического анализа. Для исключения неспецифичной сорбции сорбент промыли 100 мкл 0.1 % ТФУ в воде и удаленный центрифугированием раствор также оставили для масс-спектрометрического анализа. Элюирование с сорбента проводили в два этапа. На первом этапе в спиновую колонку поместили 100 мкл 0.5 % раствора пиперидина в воде и на 5 мин оставили на перемешивающей платформе. Раствор удалили при помощи центрифугирования и затем к сорбенту добавили 100 мкл 100 % ацетонитрила, который через 5 мин также удалили центрифугированием. Оба элюата сохранили для масс-спектрометрического анализа.
Металл-аффинная хроматография метафоса на РММС Fe(III)
В микропробирку поместили 2 коллапсированных монослоя РММС Fe(III), промыли 50 мкл ацетонитрила, микропробирку центрифугировали 10 мин при 10 000 об./мин, супернатант отбросили. Затем сорбент промыли 50 мкл 0.1 % ТФУ, супернатант после центрифугирования 10 мин при 10 000 об./мин также отбросили. После этого в микропробирку с сорбентом добавили 40 мкл раствора метафоса в 50 % ацетонитриле (концентрация 660 мкг/мл) и 40 мкл 0.1 % ТФУ и оставили на 15 минут, после чего микропробирку центрифугировали 10 мин при 10 000 об./мин, затем суперна- тант отбросили. К сорбенту добавили 200 мкл 0.1 % ТФУ для промывки, оставили на 10 мин, после чего микропробирку центрифугировали 10 мин при 10000 об./мин и супернатант отбросили. Элюирование проводили последовательно 50 мкл 0.4 М водного аммиака и 70 мкл 0.5 % пиперидина с отбором фракций в чистые микропробирки.
Металл-аффинная хроматография пептидов модифицированного зарином альбумина человека на РММС Fe(III)
В спиновую колонку поместили 5 коллапсированных монослоев РММС Fe(III), промыли 50 мкл ацетонитрила, микропробирку центрифугировали 2 мин при 5000 об./мин, супернатант отбросили. Затем сорбент промыли 100 мкл 0.1 % ТФУ, супернатант после центрифугирования 2 мин при 5000 об./мин также отбросили. После этого в спиновую колонку с сорбентом добавили 50 мкл раствора пептического гидролизата сывороточного альбумина человека, модифицированного зарином (исходная концентрация зарина 10–1 мг/мл), и оставили на 15 мин, после чего микропробирку центрифугировали 2 мин при 5000 об./мин, затем супернатант отбросили. К сорбенту добавили 100 мкл 0.1 % ТФУ для промывки, оставили на 10 мин, супернатант удалили. Элюирование проводили 50 мкл 0.5 % пиперидина, фракцию после центрифугирования 10 мин при 10000 об./мин отобрали в чистую микропробирку для последующего масс-спектрометрического анализа.
Масс-спектрометрический анализ методом MALDI-TOF и MALDI-TOF-TOF
Масс-спектрометрический анализ проводили с помощью времяпролетного масс-спектрометра Axima Perfomance с источником ионов MALDI, оснащенном УФ-лазером (337 нм) при следующих настройках: режим детектирования отрицательных ионов (анализ перфтороктансульфоновой кислоты) или положительных ионов (микроцистины, фосфонилированные пептиды) с использованием рефлектрона при следующих настройках ионного источника: напряжение 20 кВ, напряжение на линзах (lens) 6.5 кВ, напряжения на рефлектроне (Ref) 24.38 кВ. Ионы детектировали в диапазоне m/z от 280 до 5000, в режиме рефлектрона. Масс-спектры регистрировали при помощи программы MALDI-MS Shimadzu Biotech (Shimadzu, Япония). Калибровку в режиме отрицательных ионов проводили по стандартным пикам матрицы и двум пептидам [М – Н]– 336.18 Да и [М – Н]– 724.39 Да. Калибровку в режиме положительных ионов проводили по масс-спектру смеси пептидов: ангиотензин 2 (МН+ = 1046.542 Да), ангиотензин 1 (МН+ = 2296.685 Да), N-ацетилренин (МН+ = = 1800.943 Да), аденокортикотропный гормон (117) (МН+ = 2093.086 Да).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выделение метаболитов цианобактерий
В настоящее время существует много сообщений о массовом развитии в водоемах цианобактерий, синтезирующих токсины — микроцистины. Микроцистины представляют собой циклические пептиды и при попадании в организм человека или животных вызывают интоксикацию организма с последующим некрозом печени. Это делает важным не только обнаружение класса токсических веществ, но и идентификацию индивидуальных соединений, т. к. они обладают разной степенью токсичности [10].
К наиболее обширному классу гепатоксинов относятся более 80 циклических гепта- (микроцистины) и пентапептидов (нодуларины) с молекулярной массой в интервале 800–1100 Да, содержащих редкие аминокислоты. Например, циклические пептиды микроцистины состоят из семи аминокислот, пять из которых постоянны в составе соединений этого класса, а две L-аминокислоты — вариабельны. Фармакологическое действие микроцистинов обусловлено наличием АДДА-фрагмента 3-амино-9-метокси-10-фенил-2,6,8 три-метилдека-4,6-диеновой кислоты (рис. 1), который является характеристичным для данного класса соединений [11].
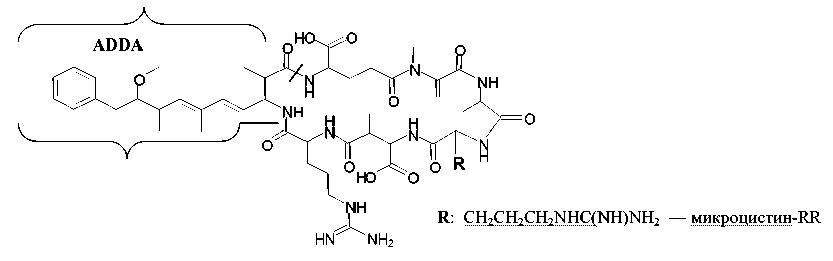
Рис. 1. Структура микро-цистина-RR
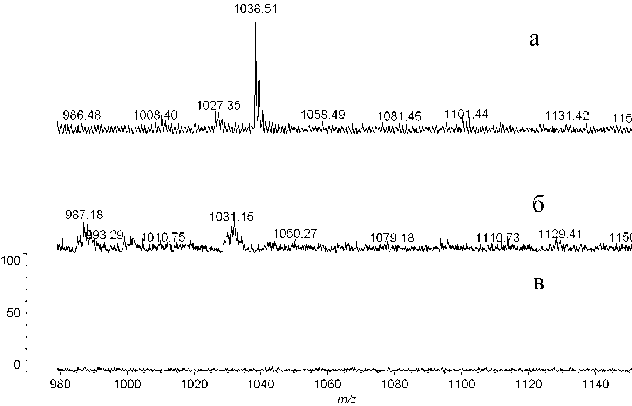
Рис. 2. MALDI-масс-спектр фракций после металл-аффинной хроматографии микроцистина-RR на РММС Fe(III).
а — элюат 0.5 % пиперидином в воде; б — промывка 0.4 М аммиаком в воде; в — проскок с колонки
Метод жидкостной хроматографии—масс спектрометрии в сочетании с тандемной масс-спектрометрией (МСn) высокого разрешения, применяемый при анализе и изучении цианотоксинов в последние годы, обеспечивает надежную идентификацию, которая достигается комбинацией фрагментных масс-спектров и точных значений молекулярных масс, избирательно характеризующих определяемые соединения, и соответствующих времен удерживания [12]. В связи с пептидной природой микроцистинов, зачастую обеспечивающей наличие активного кислорода, который способен вступать во взаимодействие с ионами металла, возникло предположение о возможности их выделения с применением металл-аффинных сорбентов. Исследование такой возможности было проведено с использованием стандартного раствора микроцистина-RR.
Результат масс-спектрометрического анализа раствора микроцистина-RR в воде ( m / z 1038 Да) представлен на рис. 2. Как видно из данных масс-спектров, в экспериментальных образцах, полученных после промывки сорбента раствором аммиака, и в проскоке не наблюдается сигнал с данной массой. В то время как в масс-спектре элюата пиперидином детектируется сигнал, соответствующий микроцистину-RR. Таким образом, можно сделать вывод, что РММС Fe(III) может быть использован как сорбент, альтернативный обра-щеннофазовому, при пробоподготовке для анализа микроцитинов.
Исследование сорбции фторсодержащих кислот на примере перфтороктановой сульфокислоты (ПФОСК)
Перфтороктансульфоновая кислота (рис. 3) применяется в производстве металлопокрытий,
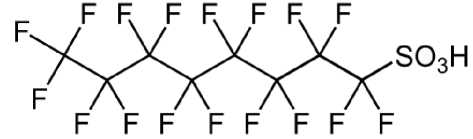
Рис. 3. Структурная формула перфтороктан-сульфоновой кислоты средств тушения огня, в фотографии, в производстве полупроводников и литографии, а также в производстве авиационных гидравлических жидкостей. Промышленность Евросоюза потребляет свыше 12 тонн ПФОСК в год. ПФОСК рассматривается как стойкий органический загрязнитель окружающей среды.
Чрезвычайно стабильная в окружающей среде, перфтороктансульфоновая кислота практически не поддается биоразложению. ПФОСК накапливается в организме человека и выводится крайне медленно — от 2 лет до 21 года (у крыс — за 200 дней). Доза отсутствия токсического воздействия — 0.1 мг/кг/день и доза малого токсического воздействия — 1.0 мг/кг/день [13].
Человек может получать ПФОСК вместе с пищей или питьевой водой, поэтому эксперимент по сорбции проводили в водной среде. Также стоит отметить, что ПФОСК очень плохо выделяется методом твердофазной экстракции на обращеннофазовых сорбентах. Получаемые результаты нестабильны и плохо воспроизводимы, поэтому возможность применения РММС Fe(III) для выделения ПФОСК является актуальной в прикладном аспекте.
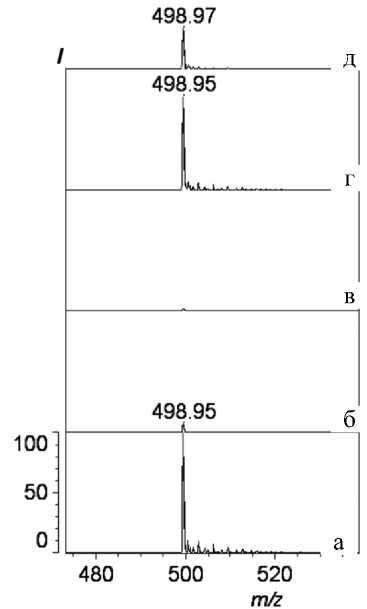
Рис. 4. MALDI-масс-спектры ПФОС.
а — общий спектр образца, взятого на анализ; б — проскок с сорбента; в — промывка 0.1 % ТФУ; г — элюат 0.5 % пиперидином; д — элюат ацетонитрилом
На рис. 4 представлены результаты масс-спектрометрического анализа ПФОСК до (рис. 4, а) и после (рис. 4, б–д) металл-аффинной хроматографии. Как показано на рисунке, в масс-спектрах проскока с сорбента, так же как и промывающего раствора, сигнал, соответствующий ПФОС, практически не наблюдается, в то время как наличие этого сигнала в спектрах элюатов однозначно свидетельствует об успешности металл-аффинного анализа. Что доказывает специфичность РММС Fe(III) к данному классу соединений.
Исследование сорбции фосфорсодержащих пестицидов
Фосфорорганические пестициды представляют собой эфиры различных кислот: фосфорной, фосфористой, тиофосфорной, дитиофосфорной, пи-рофосфорной [14–16].
Для анализа остаточных количеств ФОС в почвах, воде, продуктах питания растительного и животного происхождения, различных тканях организма человека наиболее распространенными на сегодняшний день являются хроматографические методы исследования как наиболее точные и на-
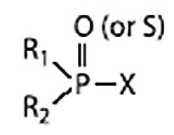
Рис. 5. Общая формула фосфорорганических соединений
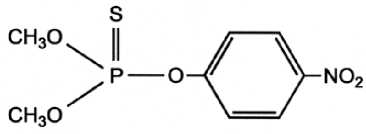
Рис. 6. Cтруктурная формула метафоса дежные. Также наиболее современными и широко используемыми методами определения ФОС являются тандемные (комбинированные) методы: ГХ-МС, РХ-МС, ВЭЖХ-МС, РХ-МС-МС и другие комбинации масс-спектрального и хроматографического методов контроля [17]. Для количественного определения фосфорсодержащих пестицидов необходимо их выделять из достаточно сложных матриц, причем на сегодняшний день отсутствуют методы специфичной эктракции этого класса соединений. На основании химической структуры фосфорсодержащих пестицидов (рис. 5) было сделано предположение, что ряд соединений, обладающих атомами кислорода, соединенными с фосфором, может быть выделен методом металл-аффинной хроматографии на РММС Fe(III). В качестве модельного объекта был выбран метафос (метилпаратион) (рис. 6).
Количественный анализ элюатов после металл-аффинной хроматографии был проведен по методу ВЭЖХ-УФ. УФ-спектр стандартного раствора ме-тафоса представлен на рис. 7, а.
На хроматограмме, полученной после проведения элюции раствором аммиака (рис. 7, б), наблюдается пик, значение времени удерживания которого соответствует метафосу, что является доказательством наличия данного соединения в смеси. Также на основании полученных данных можно сделать вывод о возможности применения металл-аффинной хроматографии на РММС Fe(III) для выделения фосфорсодержащих пестицидов.
Выделение пептидов, модифицированных остатком зарина
Также к фосфорорганическим соединениям относится ряд боевых отравляющих веществ, таких как зарин, зоман, RVX и т. п. Было показано, что ФОС, в том числе и зарин, способны образовывать аддукты с белками крови [18].
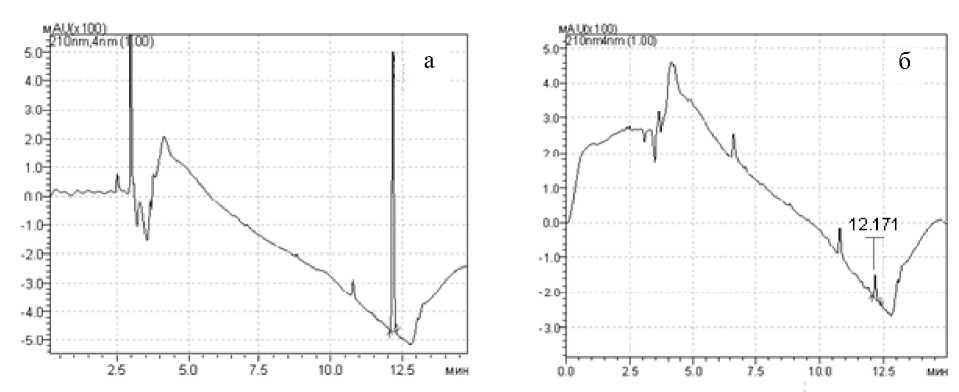
Рис. 7. Хроматограммы: а — стандартного раствора метафоса; б — элюата после металл-аффинной хроматографии на РММС Fe(III) (фракция 0.4 М водный аммиак)
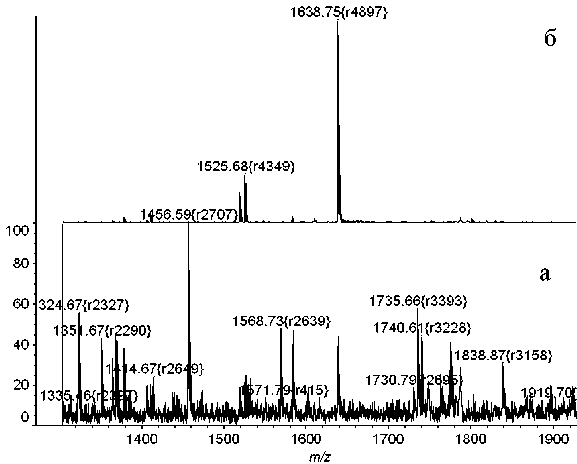
Рис. 8. Масс-спектр образца, содержащего гидролизат сывороточного альбумина человека.
а — до металл-аффинной хроматографии на сорбенте РММС Fe(III); б — после металл-аффинной хроматографии (элюат 0.5 % водным пиперидином)
В последние годы успешно проводятся работы по разработке методик извлечения из биообразцов фосфонилированных пептидов с использованием метода металл-аффинной хроматографии. Причем одним из применяемых сорбентов является коммерческий гель PHOS-Select Iron Affinity Gel (Sigma Aldrich), содержащий ионы железа (III).
Ранее в работах [19, 20] была показана возможность выделения аддуктов фосфорорганических соединений с сывороточным альбумином методом металл-аффинной хроматографии на сорбентах, содержащих Fe(III) и Ti(IV). Следовательно, можно было ожидать, что РММС Fe(III) способны по- казать аналогичные результаты.
Известно, что в пептическом гидролизате сывороточного альбумина человека, модифицированного зарином, должны присутствовать два пептида 1638.9 Да (LVRY зарин TKKVPQVST) и 1525.8 Да (VRY зарин TKKVPQVST), содержащие модифицированный тирозин-411, которые могут быть выделены методом металл-аффин-ной хроматографии. Действительно, после проведения металл-аффинной хроматографии на сорбенте РММС Fe(III) в масс-спектрах элюата надежно детектируются сигналы, соответствующие этим двум аддуктам (рис. 8). Кроме того, наличие
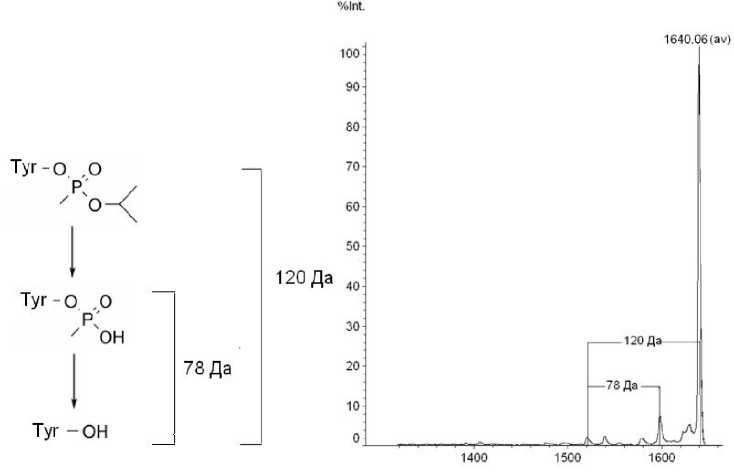
Рис. 9. Определение наличия модификации остатком зарина в фрагментных масс-спектрах аддукта LVRY зарин TKKVPQVST
модификации в пептидах было доказано методом тандемной масс-спектрометрии по отщеплению нейтральной частицы (рис. 9). Следует отметить, что практически полное отсутствие примесных сигналов свидетельствует о высоком уровне специфичности РММС Fe(III) к фосфонилированным пептидам.
ЗАКЛЮЧЕНИЕ
Таким образом, в результаты работы было показано, что регулярный мультимолекулярный сорбент на основе стеарата железа(III) имеет широкий спектр применения в аналитической, биооргани-ческой, экологической химии, и в частности в токсикологическом анализе. Он может быть использован при анализе биообразцов и объектов окружающей среды. Сорбент показывает высокий уровень специфичности, что, как следствие, повышает эффективность как пробоподготовки, так и последующего хроматографического или масс-спектрометрического анализа.


