Исследование строения b-дикетонатов тетраарилсурьмы Ph4Sb[MeC(O)CHC(O)Ph], p-Tol4Sb[MeC(O)CEtC(O)Me] ∙ 1½ PhH, p-Tol4Sb[MeC(O)СHC(O)NHPh]
Автор: Шарутин В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 2 т.16, 2024 года.
Бесплатный доступ
Взаимодействием пентафенилсурьмы и пента(пара-толил)сурьмы с b-дикетонами в бензоле (100 °С, 1 ч) получены b-дикетонаты тетраарилсурьмы Ph4Sb[MeC(O)CHC(O)Ph] (1), p-Tol4Sb[MeC(O)CEtC(O)Me] ∙ 1½PhH (2), p-Tol4Sb[MeC(O)СHC(O)NHPh] (3), охарактеризованные ИК-спектрами и рентгеноструктурным анализом. Кристаллы 1 [C34H29O2Sb, M 591,32; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 9,524(13) Å, b = 9,827(10) Å, c = 17,350(18) Å; a = 99,03(3)°, β = 101,50(6)°, g = 111,02(4)°, V = 1438(3) Å3, Z = 2; rвыч = 1,365 г/см3], 2 [C44H48O2Sb, M 730,57; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 9,740(5) Å, b = 14,283(6) Å, c = 15,174(6) Å; a = 107,818(14), β = 90,292(18), g = 105,33(2) град., V = 1929,7(16) Å3, Z = 2; rвыч = 1,257 г/см3], 3 [C34H30NO2Sb, M 606,34; сингония моноклинная, группа симметрии P21/n; параметры ячейки: a = 9,396(17) Å, b = 10,23(2) Å, c = 29,45(6) Å; β = 95,91(6)°, V = 2817(10) Å3, Z = 4; rвыч = 1,430 г/см3]. Полученные b-дикетонаты тетраарилсурьмы представляют собой кристаллические соединения с четкой температурой плавления, устойчивые к действию влаги и кислорода воздуха, хорошо растворимые в ароматических растворителях и полигалоидных растворителях. Комплекс 2 является сольватом и содержит 1½ молекулы бензола. По данным РСА, атомы сурьмы в комплексах 1-3 имеют искаженную октаэдрическую координацию, причем хелатный цикл и два арильных заместителя находятся в экваториальной плоскости, а два арильных лиганда занимают аксиальные положения.
B-дикетонаты тетраарилсурьмы, синтез, строение, ик-спектры, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147244640
IDR: 147244640 | УДК: 546.865 | DOI: 10.14529/chem240210
Текст научной статьи Исследование строения b-дикетонатов тетраарилсурьмы Ph4Sb[MeC(O)CHC(O)Ph], p-Tol4Sb[MeC(O)CEtC(O)Me] ∙ 1½ PhH, p-Tol4Sb[MeC(O)СHC(O)NHPh]
В литературе описаны многочисленные примеры лигандов, содержащих в своем составе две и более функциональных групп, которые способны закрепляться в координационной сфере центрального атома металла. В этот многочисленный ряд входят дикарбоновые кислоты, оксикарбоновые кислоты и другие соединения. Подобные примеры дополнительной внутримолекулярной координации атома сурьмы с потенциальными координирующими центрами одного из лигандов при атоме Sb известны [1–7], однако структурные особенности β-дикетонатов тетраарилсурьмы изучены недостаточно. Так, в диссертации [8] проанализированы немногочисленные методы синтеза р -дикетонатов тетрафенилсурьмы, которые получали из алкокситетрафенилсурьмы и в-дикетона [9, 10] или из галогенида тетрафенилсурьмы и натриевых солей р -дикетонов [11]. Недостатками перечисленных методов являются двухстадийность и затруднения в разделении продуктов реакции.
Поскольку р -дикетоны являются сравнительно сильными С-Н кислотами, рК а которых приближается к значениям рК а некоторых фенолов (например, рК а ацетилацетона составляет 8,95, а фенола - 9,95 [12]), можно предположить, что р -дикетоны будут взаимодействовать с пентаа-рилсурьмой с образованием р -дикетонатов тетраарилсурьмы. Действительно, показано, что продуктом реакции пентафенилсурьмы и пента( пара -толил)сурьмы с р -дикетонами являются р -дикетонаты тетраарилсурьмы, выход которых достигал 99 % [13–19]. В этом случае получение целевого продукта проходит в одну стадию и его выделение не является трудоемким, а выход достаточно высок.
Экспериментальная часть
В работе использовали дикетоны производства фирмы Alfa Aesar. Получение ^ -дикетонатов тетраарилсурьмы из пентаарилсурьмы и р -дикетона осуществляли по методике, описанной в [8].
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектры соединений 1 - 3 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
РСА кристаллов 1 - 3 проведен на дифрактометре D8 Quest фирмы Bruker (Mo K a-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT- Plus [20]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [21] и OLEX2 [22]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Полные таблицы
. Основные кристаллографические данные и результаты уточнения структур 1‒3 приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1–3
Длины связей и валентные углы в структурах 1‒3
|
Параметр |
1 |
2 |
3 |
|
Формула |
C 34 H 29 O 2 Sb |
C 44 H 48 O 2 Sb |
C 34 H 30 NO 2 Sb |
|
М |
591,32 |
1132,33 |
606,34 |
|
Сингония |
Триклинная |
Триклинная |
Моноклинная |
|
Пр. группа |
P– 1 |
P– 1 |
P 2 1 / n |
|
a , Å |
9,524(12) |
9,740(5) |
9,396(17) |
|
b, Å |
9,827(10) |
14,283(6) |
10,23(2) |
|
c, Å |
17,350(18) |
15,174(6) |
29,45(6) |
|
α, град. |
99,03(3) |
107,818(14) |
90,00 |
|
β, град. |
101,50(6) |
90,292(18) |
95,91(6) |
|
γ, град. |
111,02(4) |
105,33(2) |
90,00 |
|
V , Å3 |
1438(3) |
1929,7(16) |
2817(10) |
|
Z |
2 |
2 |
4 |
|
ρ (выч.), г/см3 |
1,365 |
1,257 |
1,430 |
|
µ , мм–1 |
0,986 |
0,748 |
1,010 |
|
F (000) |
600,0 |
758,0 |
1232,0 |
|
Размер кристалла (мм) |
0,54 × 0,38 × 0,13 |
0,43 × 0,23 × 0,21 |
0,29 × 0,22 × 0,12 |
|
Область сбора данных по 2 θ , град. |
5,6–57 |
5,974–57 |
5,562–56,996 |
|
Интервалы индексов отражений |
–12 ≤ h ≤ 12, –13 ≤ k ≤ 13, –23 ≤ l ≤ 23 |
–13 ≤ h ≤ 13, –19 ≤ k ≤ 19, –20 ≤ l ≤ 20 |
–12 ≤ h ≤ 12, –13 ≤ k ≤ 13, –39 ≤ l ≤ 39 |
|
Измерено отражений |
62345 |
82281 |
90242 |
|
Независимых отражений |
7276 |
9730 |
7147 |
|
Переменных уточнения |
336 |
434 |
345 |
|
GOOF |
1,044 |
1,066 |
1,093 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0310, wR 2 = 0,0735 |
R 1 = 0,0373, wR 2 = 0,0959 |
R 1 = 0,0307, wR 2 = 0,0598 |
|
R -факторы по всем отражениям |
R 1 = 0,0378, wR 2 = 0,0769 |
R 1 = 0,0439, wR 2 = 0,1005 |
R 1 = 0,0498, wR 2 = 0,0649 |
|
Остаточная электронная плотность (min/max), e /Å3 |
0,55/–0,42 |
0,69/–0,79 |
0,56/–0,35 |
Таблица 2
|
Связь |
d , Å |
Угол |
ω, град. |
|
1 |
|||
|
Sb1–O1 |
2,224(2) |
O1‒Sb1‒C31 |
159,66(10) |
|
Sb1–O2 |
2,340(3) |
C11‒Sb1‒O2 |
169,69(7) |
|
Sb1–C1 |
2,146(4) |
C21‒Sb1‒O1 |
166,38(9) |
|
Sb1–C11 |
2,249(3) |
C21‒Sb1‒C11 |
104,86(12) |
|
Sb1–C21 |
2,116(3) |
C21‒Sb1‒C31 |
96,14(12) |
|
Sb1–C31 |
2,171(4) |
C31‒Sb1‒C11 |
96,85(12) |
|
O1‒C8 |
1,296(3) |
C1‒Sb1‒C11 |
96,53(13) |
|
O2‒C10 |
1,281(3) |
O1‒Sb1‒C11 |
88,74(11) |
|
2 |
|||
|
Sb1–O1 |
2,244(2) |
C21‒Sb1‒O2 |
166,39(9) |
|
Sb1–O2 |
2,269(2) |
C1‒Sb1‒C11 |
160,55(10) |
|
Sb1–C21 |
2,156(3) |
C31‒Sb1‒C21 |
104,43(10) |
|
Sb1–C1 |
2,155(3) |
C31‒Sb1‒O1 |
164,78(8) |
Окончание табл. 2
|
Связь |
d , Å |
Угол |
ω, град. |
|
Sb1–C11 |
2,163(3) |
C21‒Sb1‒C11 |
96,50(10) |
|
Sb1–C31 |
2,149(3) |
C31‒Sb1‒C11 |
96,14(10) |
|
O1–C42 |
1,275(3) |
C21‒Sb1‒O1 |
90,78(9) |
|
O2–C44 |
1,277(3) |
C1‒Sb1‒C21 |
95,19(10) |
|
3 |
|||
|
Sb1–O1 |
2,185(4) |
C11‒Sb1‒O2 |
166,99(8) |
|
Sb1–O2 |
2,321(5) |
C31‒Sb1‒C21 |
163,28(9) |
|
Sb1–C21 |
2,162(4) |
C1‒Sb1‒O1 |
166,04(9) |
|
Sb1–C31 |
2,161(4) |
C11‒Sb1‒C1 |
105,79(10) |
|
Sb1–C11 |
2,164(4) |
C21‒Sb1‒C11 |
95,87(11) |
|
Sb1–C1 |
2,169(3) |
C31‒Sb1‒C11 |
95,88(14) |
|
O1–C8 |
1,294(3) |
C31‒Sb1‒C1 |
93,22(14) |
|
O2–C10 |
1,265(3) |
C21‒Sb1‒C1 |
94,98(15) |
Обсуждение результатов
В продолжение работ в указанном направлении синтезировано три р -дикетоната тетраарил-сурьмы и исследовано их строение методом РСА.
Ar 5 Sb + R 1 C(O)CHR 2 C(O)R 3 ^ Ar4Sb[OC(R 1 )CR2C(R 3 )O] + ArH
Ar = Ph, R1 = Me, R2 = H, R3 = Ph ( 1 ); Ar = C 6 H 5 Me-4, R1 = R3= Me, R2 = Et ( 2 );
Ar = C 6 H 5 Me-4, R1 = Me, R2 = Н, R3= NHPh ( 3 )
Полноту протекания реакции контролировали методом тонкослойной хроматографии (элюент – бензол) по исчезновению пятна, характерного для пентаарилсурьмы. С достаточно высокой скоростью эти реакции протекают в полярном растворителе – тетрагидрофуране и более спокойно – в среде ароматического углеводорода, поэтому в качестве растворителя в указанных реакциях синтеза β-дикетонатов тетраарилсурьмы был выбран бензол. Взаимодействие пентаарилсурь-мы с р -дикетоном проводилось при нагревании (100 ° С) в течение 1 ч, поскольку при комнатной температуре пентаарилсурьму обнаруживали в реакционной смеси даже по истечении нескольких суток. р -Дикетонаты тетраарилсурьмы представляют собой кристаллические соединения с четкой температурой плавления, устойчивые к действию влаги и кислорода воздуха, хорошо растворимые в ароматических растворителях и полигалоидных растворителях.
Синтез неизвестных ранее р -дикетонатов тетраарилсурьмы выявил новые объекты исследования в области химии арильных соединений сурьмы, изучение строения и свойств которых позволило бы внести ясность в понимание некоторых вопросов теоретического характера (природа связи между β-дикетонатным лигандом и атомом сурьмы, взаимосвязь природы лиганда с реакционной способностью комплексов и т. п.). С этой целью были исследованы некоторые спектральные характеристики полученных соединений и данные их рентгеноструктурных исследований.
В ИК-спектрах комплексов 1-3 имеются полосы поглощения в области 675-890 см-1, относящиеся к характеристическим колебаниям арильных лигандов [23, 24]. Также содержатся характерные полосы валентных колебаний углеродного скелета ароматических фрагментов при 1603-1483 см-1. Валентным колебаниям связей CAr-H принадлежат полосы при 3088-3028 см-1; плоскостным деформационным колебаниям этих же связей ‒ полосы при 1165‒1031 см–1, внепло-скостным деформационным колебаниям - при 910-849 см-1. Также в ИК-спектрах 1-3 присутствуют интенсивные полосы поглощения, относящиеся к валентным колебаниям карбонильных групп, очень чутко реагирующие на введение полярных заместителей в хелатное кольцо р-дикетонатов тетраарилсурьмы. В ИК-спектрах комплексов 1 и 3 наблюдается наличие дублета в области 1600–1500 см–1, относящегося к валентным колебаниям связей С=О и С=С, а также присутствие интенсивной полосы поглощения в области 1200 см–1, соответствующей колебаниям с участием метинового протона, однако, в отличие от ИК-спектров 1 и 3, в ИК-спектре соединения 2 в области -1550 см-1 наблюдается только одна полоса (1562 см-1). Еще в 1958 году Р.П. Драйден обнаружил, что в спектрах ацетилацетонатов ряда металлов, имеющих заместители в у-положении, вместо дублета в области 1600-1500 см-1 наблюдается интенсивный синглет [25]. Такой эффект упрощения спектра в этой области, получивший в дальнейшем название «правило Драйдена», П.Р. Сингх и Р. Сахайи объясняют тем, что при введении у-заместителя происходит смещение полос поглощения связей С–О и С–С в низкочастотную область и их слияние в одну полосу [26, 27].
Как и в других структурно охарактеризованных в—дикетонатах тетраарилсурьмы [13 - 15], атомы металла в 1 - 3 имеют искаженную октаэдрическую координацию, в которой хелатный цикл и два арильных заместителя находятся в экваториальной плоскости (рис. 1 - 3). Комплекс 2 является сольватом и содержит 1½ молекулы бензола.
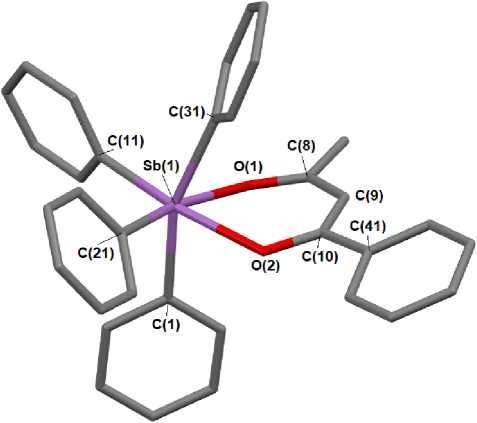
Рис. 1. Строение комплекса 1 (атомы водорода не показаны)
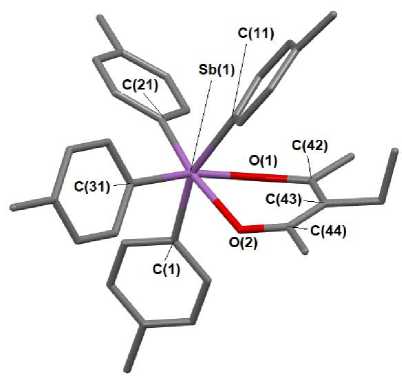
Рис. 2. Строение комплекса 2 (атомы водорода и молекулы сольватного бензола не показаны)
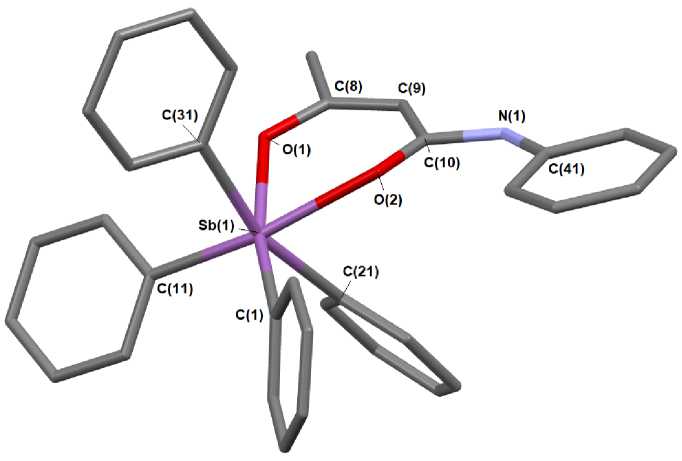
Рис. 3. Строение комплекса 3 (атомы водорода не показаны)
В шестичленных гетероциклах р-дикетонатов тетраарилсурьмы (1-3) атомы О2С3 компланарны в пределах 0,008 А. Плоскость фенильного кольца р-дикетонатного лиганда в 1 отклоняется от плоскости хелатного цикла на 14,47°. Аналогичное отклонение в 3 составляет 3,95°. Аксиальные углы CSbC в 1, 2 и 3 составляют 159,66(10), 160,55(10) и 163,28(9)о соответственно, что гораздо меньше 180° (см. табл. 2). Значения углов OSbO внутри хелатного лиганда (80,99(9)° в 1, 75,61(7)° в 2 и 79,25(8)° в 3) близки между собой. Следует отметить, что длины связей С-С в хелатном кольце соединений 1 и 3 весьма различаются: 1,452(4); 1,392(4) Å в 1, 1,361(4); 1,425(4) Å в 3, что обусловлено присутствием различных по природе и по положению заместителей в би-дентатном лиганде. В комплексе 2 с симметрично расположенной этильной группой в р-дикетонатном лиганде указанные длины связей практически одинаковы (1,408(4), 1,411(4) Å), как и расстояния C-O (1,275(3), 1,277(3) А). Расстояния С-О в 1 равны 1,281(3) и 1,296(3) А, что длиннее, чем в у- хлорацетилацетонате тетрафенилсурьмы (1,272(9), 1,279(10) А [13]). Аналогичные расстояния в 3 составляют 1,265(3) и 1,294(3) А. Длины связей Sb-O (2,224(2) и 2,340(3) А в 1; 2,244(2) и 2,269(2) Å в 2 и 2,185(4) и 2,321(5) Å в 3) приближаются к сумме ковалентных радиусов атомов-партнеров. Можно наблюдать тенденцию, когда более длинной связи Sb–O соответствует более короткая связь С-О. Такие же закономерности в изменении длин связей Sb-O и С—О наблюдаются в других γ-замещенных ацетилацетонатах тетрафенилсурьмы [14, 15]. Отличия в длинах связей в пределах экспериментальной погрешности невелики, что свидетельствует о незначительной асимметрии в расположении лиганда относительно атома сурьмы.
Выводы
Взаимодействием пентафенилсурьмы и пента( пара -толил)сурьмы с р -дикетонами в бензоле (100 ° С, 1 ч) получены р -дикетонаты тетраарилсурьмы Ph 4 Sb[MeC(O)CHC(O)Ph], p -Tol 4 Sb[MeC(O)CEtC(O)Me] ∙ 1½PhH, p -Tol 4 Sb[MeC(O)СHC(O)NHPh]. Проведен анализ данных рентгеноструктурных исследований полученных в работе р -дикетонатов тетраарилсурьмы. Показано, что р -дикетонатный лиганд в р -дикетонатах тетраарилсурьмы проявляет бидентатные свойства, а атом сурьмы имеет КЧ = 6.
Список литературы Исследование строения b-дикетонатов тетраарилсурьмы Ph4Sb[MeC(O)CHC(O)Ph], p-Tol4Sb[MeC(O)CEtC(O)Me] ∙ 1½ PhH, p-Tol4Sb[MeC(O)СHC(O)NHPh]
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46, № 10. С. 579. DOI: 10.1134/S1070328420100012.
- Артемьева Е.В., Шарутина О.К., Шарутин В.В. // Журн. общ. химии. 2017. Т. 87, № 12. С. 2094. EDN: ZVGESP.
- Шарутин В.В., Шарутина О.К., Шалабанова Н.А. // Коорд. химия. 2018. Т. 44, № 6. С. 402. DOI: 10.1134/S0132344X18060130.
- Шарутин В.В., Шарутина О.К., Губанова Ю.О., Ельцов О.С. // Журн. неорган. химии. 2019. Т. 64, № 9. С. 957. DOI: 10.1134/S0044457X19090198.
- Губанова Ю.О., Шарутин В.В., Шарутина О.К. // Журн. общ. химии. 2020. Т. 90, № 12. С. 1927. DOI: 10.31857/S0044460X20120161.
- Губанова Ю.О., Шарутин В.В., Шарутина О.К., Петрова К.Ю. // Журн. общ. химии. 2020. Т. 90. № 9. С. 1407. DOI: 10.31857/S0044460X20090127.
- Шарутин В.В., Семенова А.Д. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. С. 44. DOI: 10.14529/chem230203.
- Задачина О.П. Синтез и строение β-дикетонатов сурьмы: дис. … канд. хим. наук. Иркутск. 2003. 96 с.
- Meinema H.A., Noltes I.G. // J. Organomet. Chem. 1969. V. 16, No. 2. P. 257. DOI: 10.1016/S0022-328X(00)85296-1.
- Matsumura Y., Okawara R. // Inorg. Nucl. Chem. Lett. 1968. V. 4, No. 9. P. 521. DOI: 10.1016/0020-1650(68)80024-8.
- Singhal K., Aggarwal A.K., Ray P. // Indian J. Chem. 1992. V. 31A, No. 10. P. 797.
- Темникова Т.И. Курс теоретических основ органической химии. Л.: Госхимиздат. 1962. 948 с.
- Шарутин В.В., Шарутина О.К., Задачина О.П. и др. // Журн. общ. химии. 2000. Т. 70, № 5. С. 746.
- Шарутин В.В., Шарутина О.К., Задачина О.П. и др. // Журн. общ. химии. 2000. Т. 70, № 10. С. 1672. EDN: LSAKZT.
- Шарутин В.В., Шарутина О.К., Задачина О.П. и др. // Коорд. химия. 2003. Т. 29, № 1. С. 8. EDN: OOFNJT.
- Шарутин В.В., Пакусина А.П., Шарутина О.К. // Химия и компьютерное моделирование. Бутлеровские сообщения. 2003. Т. 4, № 1. С. 34. EDN: JBUWRA.
- Шарутин В.В., Пакусина А.П., Егорова И.В. и др. // Коорд. химия. 2008. Т. 34, № 4. С. 267. EDN: IJKFPH.
- Sharutina O.K., Sharutin V.V., Artem'eva E.V. et al. // J. Fluor. Chem. 2019. Т. 228. С. 109393. DOI: 10.1016/j.jfluchem.2019.109393.
- Artem'eva E.V., Efremov A.N., Sharutina O.K., Sharutin V.V. et al. // J. Inorg. Biochem. 2022. Т. 234. С. 111864. DOI: 10.1016/j.jinorgbio.2022.111863
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison, Wisconsin, USA: Bruker AXS Inc., 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Dis-playing Crystal Structures from Diffraction Data. Madison, Wisconsin, USA: Bruker AXS Inc., 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Васильев А.В., Гриненко Е.В., Щукин А.О. и др. Инфракрасная спектроскопия органических и природных соединений: Учебное пособие. СПб.: СПБФТУ, 2007. 54 с.
- Druden R.P., Winston A. // J. Phys. Chem. 1958. V. 62, No. 5. P. 635.
- Singh P.R., Sahai R. // Austral. J. Chem. 1967. V. 20, No. 4. P. 639. DOI: 10.1071/CH9670639.
- Singh P.R., Sahai R. // Indian. J. Chem. 1969. V. 7, No. 6. P. 628.

![Исследование строения b-дикетонатов тетраарилсурьмы Ph4Sb[MeC(O)CHC(O)Ph], p-Tol4Sb[MeC(O)CEtC(O)Me] ∙ 1½ PhH, p-Tol4Sb[MeC(O)СHC(O)NHPh] Исследование строения b-дикетонатов тетраарилсурьмы Ph4Sb[MeC(O)CHC(O)Ph], p-Tol4Sb[MeC(O)CEtC(O)Me] ∙ 1½ PhH, p-Tol4Sb[MeC(O)СHC(O)NHPh]](/file/cover/147244640/issledovanie-stroenija-b-diketonatov-tetraarilsurmy-ph4sb-mec-o-chc-o-ph.png)
