Исследование тройной системы иодид кальция-ГМТА-вода
Автор: Алтыбаева Дильбар Тойчуевна, Абдуллаева Жыпаргуль Душабаевна, Гулжигит Кызы Айчурок, Мирзаева Махира Рысбаевна, Хаким Кызы Гульсунай
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 1 т.8, 2022 года.
Бесплатный доступ
Актуальность: огромный интерес для биокординационной химии представляет синтез, физико-химические исследования и изучение биоактивности комплексов с солями биометаллов с органическими лигандами. Материалы и методы исследования: в работе использованы изотермический метод в изучении гетерогенных равновесий при 25 оC. Установлены концентрационные пределы существования соединений и типы их растворимости. Цели исследования: исследовать соединения гексаметилентетрамина с солями биометаллов с органическими лигандами с целью снижения токсичности, повышение биоактивности и биодоступности координационных соединений. Результаты исследования: установлены концентрационные пределы существования соединений и типы их растворимости. Выводы: в полученных комплексах лигандом является ГМТА, который имеет в своем составе четыре равнозначных электродонорных атома азота.
Иодид калия, изотермический метод, изотерма растворимости, комплексообразователь, гетерогенные равновесия
Короткий адрес: https://sciup.org/14121649
IDR: 14121649 | УДК: 541.486.541.11.541.49 | DOI: 10.33619/2414-2948/74/03
Текст научной статьи Исследование тройной системы иодид кальция-ГМТА-вода
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 541.486.541.11.541.49
Во многих случаях комплексные соединения проявляют биоактивность не свойственную лигандам в свободном состоянии и эти комплексы зачастую имеют большую активность, чем исходные компоненты, что позволяет получать новые более эффективные лекарственные препараты [1].
Гексаметилентетрамин известен своей формако-активностью и представляет собой важный класс биоактивных соединений основных исходных реагентов для синтеза многих препаратов биомедицинского значения и обладают антимикробными, антигрибковыми, антигельминтыми свойствами. Следовательно, комплексы гексаметилентетрамина с солями металлов имеют перспективы использования [2], в ветеринарии и медицине, а исследование представляет практический интерес. Синтез, физико-химические исследования координационных соединений иодида кальция с активным лигандом-гексаметилентетрамином для установления закономерностей их взаимодействия и выявления биологической активности синтезированных координационных соединений.
Для достижения данной цели решались следующие задачи: проведение систематических исследований фазовых равновесий в тройной водной системе гексаметилентетрамина с иодидом кальция для установления и выделения новых соединений с заданными свойствами; определение состава и строения полученных комплексных соединений физико-химическими методами анализа.
Практическая значимость: впервые выявлены концентрационные пределы образующихся твердых и жидких фаз и могут быть использованы при изучении комплексных соединений в курсе средней школы. В курсе средней школы при прохождении темы щелочноземельных металлов. Использовать методику определения иона кальция трилонометрическим методом в воде, при определении жесткости воды.
Материал и методы исследования
Изотермическим методом растворимости проведено исследование фазовых равновесий в тройной водно-солевой системе, состоящих из гексаметилентетрамина и иодида кальция при 30°С. Установлены концентрационные пределы существования соединений и типы их растворимости. Определена термическая устойчивость полученных соединений.
Физико-химические свойства синтезированных комплексов изучали с использованием различных методов исследования. В частности, были применены термографический, спектрофотометрический, рентгенографический, микрометрический методы, основные принципы которых кратко описаны в соответствующих разделах.
Результаты и обсуждение
Кристаллы гексаметилентетрамина обладают пьезоэлектрическими свойствами: на их гранях при механической деформации возникают электрические заряды [3, 4]. Эти свойства позволяют предположить, что кристаллы новых комплексов на его основе могут быть пьезоэлектрическими.
Способность к образованию гидрата может быть использована для очистки гексаметилентетрамина. Кристаллы (СН 2 ) 6 N 4 • 8Н 2 О ромбические, имеют параметры равные 730 Å; 105,4 Å; 1,209 Å. Проведено рентгеноструктурное исследование гексагидрата, он отнесен к новому типу клатратных соединений. Молекулы воды, соединенные водородными связями, образуют складчатые кольца (Н 2 О) 6 , располагающиеся колоннами. Молекулы гексаметилентетрамина находятся в пустотах каркаса, образованного 8 кольцами (Н 2 О) 6 и с тремя из них соединены водородными связями N-О... Н за счет атомов азота. Четвертый атом азота, по-видимому, в водородной связи участия не принимает. Средняя длина связи О...Н - О равна 2,765±0,008 Å, что соответствует лишь Ван-дер Ваальсовому взаимодействию с ближайшими молекулами воды [4].
Безводный гексаметилентетрамина при нагревании в токе водорода быстро возгоняется в вакууме и испаряется без заметного разложения. На воздухе разлагается при 280°С, а при 450–495°С обугливаются продукты распада [5].
Растворимость в тройной водной системе CaJ 2 -(CH 2 ) 6 N 4 -H 2 O
Изотерма растворимости системы CaJ 2 –(CH 2 ) 6 N 4 -H 2 O при 25°С приведена в Таблице.
Таблица
|
ИЗОТЕРМА РАСТВОРИМОСТИ СИСТЕМЫ CaJ 2 –(CH 2 ) 6 N 4 -H 2 O при 25°С |
||||||
|
№ точки |
Состав жидкой фазы, масс % |
Состав твердого остатка, масс % |
||||
|
CaJ 2 |
(CH 2 ) 6 N 4 |
сумма солей |
CaJ 2 |
(CH 2 ) 6 N 4 |
сумма солей |
|
|
1 |
66.80 |
66.80 |
73.12 |
73.12 |
||
|
2 |
66.00 |
1.22 |
67.22 |
72.05 |
0.40 |
72.45 |
|
3 |
63.30 |
5.00 |
68.30 |
71.98 |
0.62 |
72.60 |
|
4 |
58.02 |
5.40 |
63.42 |
45.02 |
31.20 |
76.22 |
|
5 |
51.45 |
5.80 |
57.25 |
42.80 |
33.42 |
76.22 |
|
6 |
45.12 |
6.21 |
51.33 |
41.58 |
34.18 |
75.76 |
|
7 |
41.24 |
6.58 |
47.82 |
40.98 |
36.00 |
76.98 |
|
8 |
36.19 |
8.31 |
44.50 |
40.23 |
36.00 |
76.23 |
|
9 |
32.41 |
9.63 |
42.04 |
39.81 |
35.78 |
75.59 |
|
10 |
29.00 |
12.00 |
41.00 |
39.90 |
36.60 |
76.50 |
|
11 |
26.02 |
13.98 |
40.00 |
39.2 |
36.45 |
75.65 |
|
12 |
25.14 |
16.76 |
41.90 |
38.4 |
36.00 |
74.40 |
|
13 |
36.41 |
32.60 |
69.01 |
|||
|
14 |
20.50 |
19.02 |
39.52 |
30.40 |
40.00 |
70.40 |
|
15 |
26.23 |
70.85 |
||||
|
16 |
16.43 |
21.21 |
37.64 |
26.00 |
44.62 |
73.80 |
|
17 |
12.30 |
24.00 |
36.30 |
25.40 |
47.80 |
74.00 |
|
18 |
7.37 |
29.06 |
36.43 |
24.60 |
48.60 |
73.70 |
|
19 |
3.20 |
37.00 |
40.20 |
24.30 |
49.10 |
75.00 |
|
20 |
23.58 |
50.70 |
74.98 |
|||
|
21 |
2.80 |
45.53 |
48.33 |
18.81 |
51.40 |
76.60 |
Результаты исследования растворимости этой системе приведены на Рисунке. Из диаграммы видно, что изотерма растворимости представлена четырьмя ветвями кристаллизации, соответствующими выделению из растворов исходных компонентов и двух новых соединений. Ветвь растворимости от точки 4 до точки 5 соответствует кристаллизации в твердую фазу йодида кальция, растворимость которого равна 66,80%. Точка 4 является эвтонической и характеризуется содержанием в жидкой фазе йодида кальция 63,30% и ГМТА 5,00%. Вторая ветвь (точки 5–13) отвечает выделению в твердуюфазу инконгруэнтно растворимого соединения CaI2•2(CH2)6N4•8H2O. Прямоугольные лучи, идущие от этой кривой насыщения раствора с концентрацией йодида кальция 58,02–20,50% и ГМТА соответственно 5,40–19,02%, сходятся в одной точке, указывая на постоянный состав выделяющейся твердой фазы. Химический анализ показал, что в составе соединения содержится: йодида кальция – 40,80%, ГМТА – 39,90%, воды – 19,30%, что хорошо согласуется с теоретически установленным составом. Точка 14 является переходной.
Третья ветвь (точки 15–20) характеризует кристаллизацию из равновесного раствора, содержащего йодида кальция 20,50–2,30% и ГМТА 19,02-45,33%, второго нового химического соединения, конгруэнтно растворимого в воде, с молекулярным соотношением компонентов: 1:4:12, химической формулой CaI2⋅4(CH2)6N4⋅12H2O. Состав соединения определен химическим анализом и ходомлучей Скрейнемакерса: йодида кальция – 28,90%, ГМТА – 50,30%, воды – 20,80%. Процесс образования этого соединения заканчивается энтонической точкой 21. По мере повышения концентрации гексаметилентетрамина из раствора выделяется в осадок второй компонент (четвертая ветвь). Таким образом, нами установлено образование в системе двух соединений: CaI2⋅2(CH2)6N4⋅8H2O и CaI2⋅4(CH2)6N4⋅12H2O.
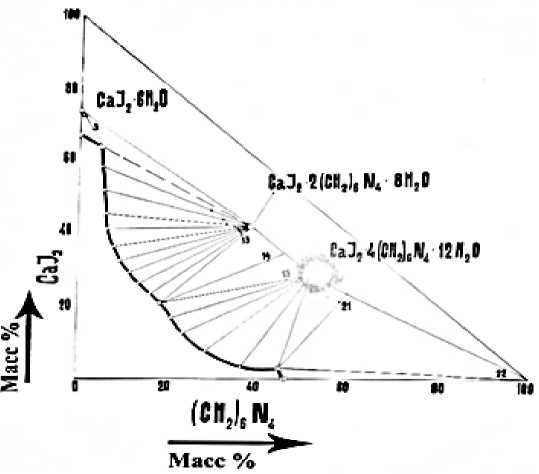
Рисунок. Изотерма растворимости системы 2CaI 2 - (CH 2 ) 6 N 4 -H 2 O
Растворимость новых соединений в органических растворителях.
Определение растворимости синтезированных соединений проводилось с целью подбора индифферентной жидкости для определения плотности кристаллов. Для этой цели были взяты следующие растворители: бензол, четырех хлористый углерод, ацетон, хлороформ.
Определение проводилось следующим образом; колбу емкостью 50 мл с измельченным испытуемым комплексом, который заливали органической жидкостью до получения насыщенного раствора, помещали в термостат, где выдерживали в течении суток с периодическим перемешиванием при 25°С. После этого во взвешенные бюксы отфильтровывали и взвешивали часть растворителя. Затем фильтрат выпаривали и вес бюксов доводили до постоянного значения. По разности весов находили количество растворенного вещества. Результаты проведенных исследований показали, что полученные нами соединения не растворяются в бензоле, четырех хлористом углероде и хлороформе.
Исключение представляет ацетон, в котором они незначительно растворимы. Эти данные указывают, что новые комплексы обладают иными химическими свойствами, чем исходные компоненты.
Определение относительной плотности кристаллов
Определение плотности синтезированных соединений осуществлялось пикнометрическим методом (81.82), по объему вытесняемой жидкости, с применением бензола как индифферентного вещества. Сначала точно калибровался объем пикнометра по дистиллированной воде при 20° С. Затем определяли удельный вес бензола. Довес в капиллярный пикнометр вводили мелко растертый порошок исследуемого комплекса с последующим взвешиванием на аналитических весах. Затем пикнометр заливали бензолом (1\3 объем) и помещали в вакуумный эксикатор, подключенный к насосу для отсасывания воздуха из порошка. После этого пикнометр с капиллярной пробкой наполняли доверху жидкостью и вместе с исследуемым порошком вновь взвешивали на аналитических весах.
Термографические эффекты соединения ГМТА с иодидом кальция.
Термографические исследования проводились на регистрационном пирометре системы Н.С. Курнакова с автоматической записью и применением дифференциальном термопары хромель-алюмель. Температурному воздействию вещество подвергалось в каскадной печи. Равномерно нагревание до 600° обеспечивалось с помощью лабораторного автотрансформатора типа латр-1. Скорость нагревания составляла 5-7° в минуту. Образцы исходных компонентов и соединений растирали в мелкий порошок и загружали в количестве 1-2г в фарфоровые тигли. Методом кривых нагревании были изучены термические устойчивости исходных компонентов и двух новых соединений. Для каждой пробы были сняты 2-3 термограмма.
Выводы
Соединения CaJ 2 ×4(CH 4 )6N 4 ×12H 2 O, как нам кажется, представляют определенный интерес, так как вокруг иона металла (кальций) координируется по четыре молекул ГМТА, и кроме того, имеется еще двенадцать молекул воды. Образование подобных соединений по литературным данным и результаты наших исследований раннее не наблюдалось.
В полученных нами комплекса лигандом является ГМТА который имеет в своем составе четыре равнозначных электродонорных атома азота. Поэтому вопрос о координационной емкости ГМТА является весьма важным. Если ГМТА координируется к иону металла четырьмя атомами азота, полосы поглощения основных колебательных частот в цепи не должны расщепляться, а в случае координации одним или двумя атомами азота мы можем наблюдать расщепление основных полос валентного колебания. Действительно, основные полосы валентных колебаний ГМТА в обезвоженных комплексах расщеплены, что указывает на неравнозначность связи атома азота с ионом металла.
Список литературы Исследование тройной системы иодид кальция-ГМТА-вода
- Басарева О. И., Заикин А. В., Хапчаева Д. А., Костров С. В., Букреева Е. В., Калуцкий П. В., Лазурина Л. П. Изучение биологической активности комплексных соединений металлов с некоторыми антимикробными средствами // Человек и его здоровье. 2007. №4. С. 5-11.
- Rauf S., Trzesowska-Kruszynska A., Sierański T., Świątkowski M. Copper (II) 2, 2-Bis (Hydroxymethyl) Propionate Coordination Compounds with Hexamethylenetetramine: From Mononuclear Complex to One-Dimensional Coordination Polymer // Molecules. 2021. Vol. 26. №11. P. 3358. https://doi.org/10.3390/molecules26113358
- Milstein D. Hexamethylenetetramine formation by Ru-catalyzed methanol hydrogen transfer // Journal of molecular catalysis. 1986. Vol. 36. №3. P. 387-389. https://doi.org/10.1016/0304-5102(86)85094-5
- Либерман А. И., Пименов А. В., Горохов Н. Я., Шмидт Д. Л., Либерман Л. И. Полиамфолитный волокнистый углеродный материал, способ его получения и устройство для непрерывного активирования волокнистого углеродного материала. №2070436. 1988.
- Gonell H. W., Mark H. Röntgenographische Bestimmung der Strukturformel des Hexamethylentetramins // Zeitschrift für Physikalische Chemie. 1923. Vol. 107. №1. P. 181-218. https://doi.org/10.1515/zpch-1923-10715


