Исследование влияния ферментирования на расщепление гликозидной связи бетанина в водном растворе
Автор: Степанянц В.Р., Тимошенко М.А., Соколова Ю.Д.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Химические науки
Статья в выпуске: 11-2 (62), 2021 года.
Бесплатный доступ
Данное исследование направлено на изменение структуры красителя свекольного красного с целью влияния на его стабильность в водных растворах. Для этой цели использовались ферменты гидролазы, расщепляющие гликозидную связь. Было доказано активное действие ферментов в отщеплении от красителя гликозидного остатка. Подобран более активный фермент.
Ферменты, бетанин, краситель свекольный красный, стабилизация, гидролиз
Короткий адрес: https://sciup.org/170192580
IDR: 170192580
Текст научной статьи Исследование влияния ферментирования на расщепление гликозидной связи бетанина в водном растворе
Ферменты являются частью биологических систем и имеют очень специфическое действие, поэтому их можно использовать для изучения конкретных превращений или механизмов реакций, не боясь образования побочных продуктов [1]. В особенности, интересно влияние глюкозидаз на стабильность бетанина в водных вытяжках. Данный класс ферментов действует непосредственно на пигмент, изменяя его структуру. Анализ устойчивости результирующих систем поможет пролить свет на принципы стабилизации красителя свекольного красного.
В работе использовались сухие пластины свеклы столовой толщиной 1 мм, из которых готовились водные вытяжки при комнатной температуре. Содержание сухого продукта составляла 0,5 г/50 мл.
Для приготовления ферментированных растворов бетанина содержимое колб с водными вытяжками бетанина количественно переносили в конические колбы объёмом 50 мл, затем на аналитических весах отбирали навеску 0,0100 г одного из трёх ферментных препаратов: «Амилосуб-тилин», «Глюкаваморин» и «Глюкоамилаза». Растворы оставляли на открытом воздухе при комнатной температуре до изменения окраски или обесцвечивания.
Редуцирующие сахара в растворах бетанина определяли фотометрическим способом методом градиуировочного графика с использованием щелочного раствора K 3 [Fe(CN) 6 ] [2]. Исследования проводили на фотоколориметре «КФК-3М», длина волны λ = 440 нм в кюветах с шириной светопоглощающего слоя I = 0,3065 см.
Углеводы способны образовывать гликозидные связи между гидроксильной группой, сформировавшейся в результате циклизации углевода и заместителем. В водной среде данные связи легко гидролизуются в кислой среде, либо в присутствии ферментов. Кислотный гидролиз протекает преимущественно из циклической формы по достаточно простому механизму (рис. 1).
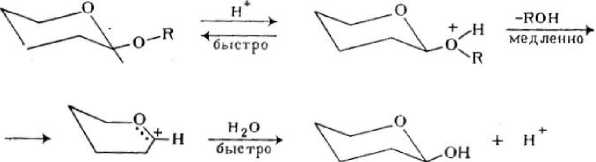
Н
Рис. 1. Механизм кислотного гидролиза гликозидной связи
В общем виде ферментативный гидролиз протекает следующим образом: при взаимодействии субстрата с ферментом происходит образование фермент-субстратного комплекса, затем молекула воды нуклеофильно атакует соседний атом углерода и происходит расщепление гликозидной связи. В случае амилаз (ферментов, расщепляющих а-1,4-глюкозидные связи [3]) механизм гидролиза можно представить следующим образом (рис. 2):
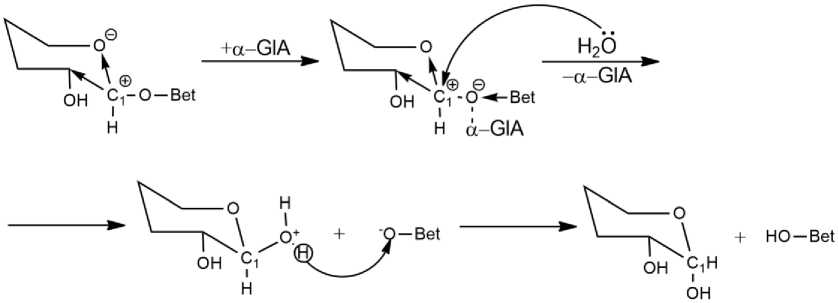
Рис. 2. Механизм ферментативного гидролиза гликозидной связи
Молекула бетанина содержит гликозидную связь в положении 5, при этом углеводной частью является глюкоза [5], которая подавляет электронодонорную способность гликозидного атома кислорода, связанного с индольным ядром [6]. Такой эффект наблюдается из-за наличия в глюкозе ещё пяти атомов кислорода, проявляющих отрицательный индуктивный эффект (рис. 3).
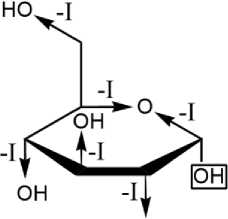
ОН
Рис. 3. Электронные эффекты в молекуле глюкозы. Прямоугольником выделена глико зидная гидроксильная группа
В результате совместного действия этих групп электронная плотность оказывается смещена с гликозидного атома кислорода в сторону глюкопиранозного ядра, в результате чего положительный мезомерный эффект данного атома в сопряжённую п-электронную систему бетанина оказывается сниженным. Это приводит к тому, что на атоме углерода альдиминовой связи в бетанине наблюдается ещё больший дефи- цит электронной плотности, чем в молекуле бетанидина, где нет гликозидной связи. Таким образом, нуклеофильная атака по данному месту ещё более облегчается. Этим фактом может быть обусловлена нестабильность бетанина в кислых и ферментативных амилазных средах.
Влияние присутствия гидролаз на кинетику образования редуцирующих сахаров
Было исследовано влияние гидролаз на кинетику образования редуцирующих сахаров. Гидролазы – это ферменты, катализирующие реакции гидролиза [4]. В частности, реакцией гидролиза является реакция расщепления гликозидной связи, присутствующей в молекулах бетанина и сахарозы, входящих в состав свеклы [7]. Отмечалось, ферменты лись при рые ферменты не добавлялись. Это свидетельствует о гораздо большем содержании сахаров, способных восстанавливаться, чем может образоваться при полном расщеплении сахарозы без добавления фермента, входящей в состав корнеплода .
Подтверждает данное утверждение и кинетические кривые, полученные при выдерживании ферментированных вытяжек на воздухе в течении 6 дней, представленных на рисунке 4 для различных марок ферментов типа гидролаз.
Из рисунка 4 видно, что ферменты имеют разную активность в одинаковых условиях. В литературных источниках указывается, что концентрация продукта ферментативной реакции в условии из-кинетиче-ка [8,9].
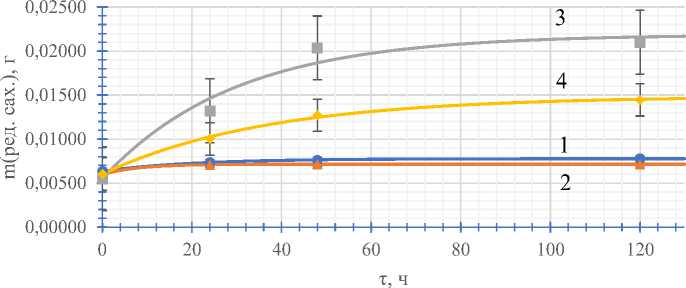
Рис.4. Кинетические кривые содержания редуцирующих сахаров в растворах бетанина
1 – Без ферментов, 2 – с «Амилосубтилином», 3 – с «Глюкаваморином», 4 – с «Глюкоамилазой»
С помощью программы «OriginPro» была произведена аппроксимация снятых зависимостей и получены значения для эффективных констант скорости реакций кэ. Эти константы пропорциональны константам Михаэлиса Кт , которые описывают сродство фермента к субстрату, а соответственно и эффективность действия фермента. Низкие значения констант соответствуют высокой степени сродства и наоборот. Наиболее эффективным ферментным препаратом оказался «Глюкава-морин» ( к э = 0,03391 1 ), наименее активным - «Амилосубтилин» ( к э = 0,12501 1 ) .
Замечателен тот факт, что некоторое накопление редуцирующих сахаров в растворе протекает и в отсутствии ферментов (кривая 1). По форме кривой можно предположить, что реакция так же является ферментативной, т. е. в свекле содержится фермент типа гидролаз. Данный вывод подтверждается проводимыми в этой области исследованиями [5].
Для того, чтобы убедиться в непосредственном влиянии ферментов на бетанин, был проведён эксперимент по снятию кинетической кривой содержания редуцирующих сахаров в растворе сахарозы в присутствии фермента. Для этой цели был вы- бран наиболее эффективный «глюкавамо-рин». Для подавления побочных процессов раствор хранился в вакууме. Результаты представлены
Эффектив ции для «Глю
0,00554 1, что примерно в 6 раз меньше, чем в опыте с бетанином, соответственно сродство фермента с сахарозой больше, чем с бетанином.
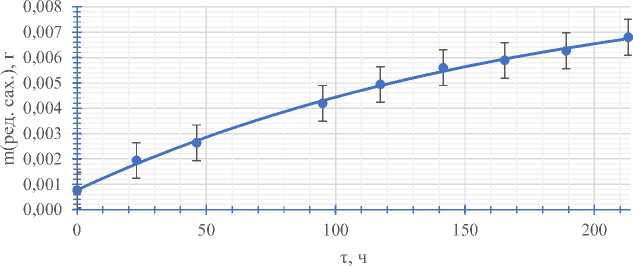
Рис. 5. Кинетическая кривая содержания редуцирующих сахаров в растворе в присутствии фермента в вакууме
Приняв во внимание то, что в свекле изначальное содержание сахарозы пренебрежимо мало, а отсутствие воздуха не влияет на активность ферментов, можно сделать вывод, что выбранные для опыта ферменты действительно способны катализировать расщепление гликозидной связи в молекуле бетанина.
Таким образом, выбранные нами ферменты типа гидролаз действительно спо- собны отщеплять глюкозу от молекулы бетанина, тем самым переводя её в бета-нидин. Также данный эксперимент показывает, что электроноакцепторные группы способствуют более быстрой деградации молекулы бетанина и введение ацильных групп, используемые многими исследователями для стабилизации красителя, является неблагожелательным.
Список литературы Исследование влияния ферментирования на расщепление гликозидной связи бетанина в водном растворе
- Диксон М., Уэбб Э. Ферменты: Пер. с англ. - М.: Мир, 1982. - Т. 1 - 392 с.
- Данина М.М., Сергачева Е.С., Соболева Е.В. Методы исследования свойств сырья, полуфабрикатов, готовых хлебобулочных и кондитерских изделий. Лабораторные работы: Учеб.-метод. Пособие. - СПб.: НИУ ИТМО; ИХиБТ, 2013. - 57 с.
- EDN: ZVDDSJ
- Диксон М., Уэбб Э. Ферменты: Пер. с англ. - М.: Мир, 1982. - Т. 2 - 515 с.
- Коротько Г.Ф. Гидролазы пищеварительных желез в крови: не только информационно-диагностические аспекты // Журнал фундаментальной медицины и биологии. - № 3. - Ростов-на-Дону.: типография ФГБОУ ВО РостГМУ Минздрава России, 2017 г. - с. 14-20.
- EDN: VZPSLZ
- Новиков Н.Н. Биохимия растений. - М.: Колос, 2012. - 679 с.
- EDN: QKUOFJ
- Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. - 7-е изд. - М.: Лаборатория знаний, 2017 г. - Ч. 3. - 570 с.
- Moreno D.A., Garcia-Viguera C., Gill J.I., Gil-Izquierdo A. Betalains in the era of global agri-food science, technology and nutritional health // Phytochemistry Reviews. - Vol. 7. - The Netherlands.: Springer Netherlands, 2008. - p. 261-280.
- EDN: LUMLCD
- Кудряшева Н.С. Физическая и коллоидная химия. - 2-е изд. - М.: изд. Юрайт, 2019 г. - 379 с.
- Стромберг А.Г., Семченко Д.П. Физическая химия. - 4-е изд., испр. - М.: Высш. шк., 2001. - 527 с.


