Исследование влияния физико-химических факторов на активность работы модифицированных ферментных электродов
Автор: Лакина Наталия Валерьевна, Долуда Валентин Юрьевич, Матвеева Валентина Геннадьевна, Сидоров Александр Иванович, Рабинович Галина Юрьевна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 10 т.7, 2021 года.
Бесплатный доступ
Для модификации графитовых электродов проводящей ферментной полимерной матрицей применялась методика капельного нанесения жидкого полимерного раствора различного состава: поливинилпирролидон (40%), хитозан (0,1%), глутаровый диальдегид (0,1%), глюкооксидаза и пероксидаза в соотношении 2:5. Для оценки влияния времени иммобилизации (x1), pH иммобилизации (x2) и соотношения фермент/носитель (x3) на активность работы ферментных электродов, использовался трехфакторный и трехуровневый дизайн Бокса-Бенкена и RSM (Response surface methodology). Эта модель помогла адекватно предсказать результаты иммобилизации в пределах диапазона используемых переменных. Наиболее благоприятные условия и наибольшее число молекул комплекса ферментов находится в электрохимически активном состоянии при их иммобилизации на ПВП с использованием модифицирующих агентов хитозана и глутарового диальдегида. Результаты демонстрируют, что производительность ферментативного биотопливного элемента прямо пропорциональна активности иммобилизованного комплекса GOX/HRP, поскольку в этом случае реакция окисления глюкозы может протекать более эффективно.
Графитовые электроды, ферментполимерная модификация, моделирование электрохимических реакций, дизайн бокса-бенкена
Короткий адрес: https://sciup.org/14121402
IDR: 14121402 | УДК: 66.094.3.098 | DOI: 10.33619/2414-2948/71/02
Текст научной статьи Исследование влияния физико-химических факторов на активность работы модифицированных ферментных электродов
Бюллетень науки и практики / Bulletin of Science and Practice
Актуальность исследований биотопливных элементов на основе ферментных электродов в реакционном растворе глюкозы связывают с поиском альтернативы «зеленому» источнику топлива, который является экономически эффективным и может удовлетворить растущие глобальные потребности в энергии. Поскольку глюкоза является важным источником энергии для многих живых организмов, такие биотопливные элементы нашли применение для питания имплантируемых биоэлектронных устройств, используемых для диагностики и лечения различных заболеваний от метаболических до неврологических. Обычный узел топливного элемента состоит из анода, катода и электролита и основан на преобразовании химической энергии топлива в электролите в электрическую энергию [1, 2]. В топливном элементе происходят два типа реакций: реакция окисления и восстановления, также известная как окислительно-восстановительная реакция. Реакция окисления происходит на границе анода и электролита; тогда как реакция восстановления происходит на границе раздела катода и электролита. Окисление топлива высвобождает электроны, которые проходят через внешние цепи к катоду, производя электричество. Глюкозный биотопливный элемент является подклассом обычных топливных элементов, в которых глюкоза используется в качестве топлива в присутствие кислорода, а затем окисляется с образованием глюконолактона и высвобождает электроны под высоким напряжением, позволяя восстанавливать кислород для обеспечения биоэлектричества [3]. Экспериментальная установка для такого производства энергии показана на Рисунке 1.
Таким образом, глюкозный биотопливный элемент, делает ферментативные биотопливные элементы на основе глюкозы «зеленой» альтернативой обычным топливным элементам для выработки энергии с высокой конверсией и эффективностью при температуре окружающей среды и нейтральной pH. Для улучшения электрических свойств ферментативного биотопливного элемента необходимо повышение активности биокатализатора на электроде [4–6].
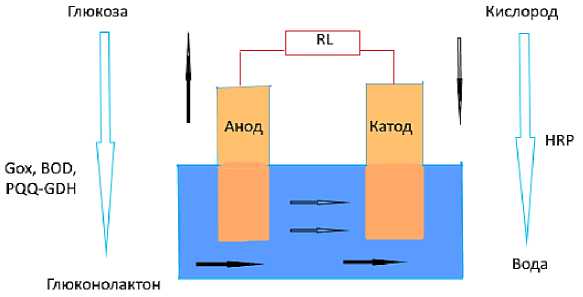
Рисунок 1. Схематическое изображение ферментативного глюкозного биотопливного элемента: где, PQQ-GDH — пирохинолинхинонглюкозодегидрогеназа, HRP — пероксидаза корня хрена (150 ед/г), Gox — глюкооксидаза, BOD — биологическая потребность в кислороде
Целью данной работы явился поиск оптимальных условий работы ферментных электродов на основе окислительно-восстановительных ферментов, иммобилизованных в полимерные матрицы поливинлпирролидона с помощью последовательного нанесения модифицирующих агентов хитозана и глутарового диальдегида (ПВП/Chit/GA/GOx/HRP). Одна единица (А) активности ферментного комплекса GOx/HRP определялась как количество GOx/HRP, вызывающее окисление одного микромоля глюкозы кислородом воздуха в минуту (А, ед/г) [7].
Методика проведения эксперимента
Для модификации графитовых электродов проводящей ферментной полимерной матрицей применялась методика капельного нанесения жидкого полимерного раствора различного состава: поливинилпирролидон (40%), хитозан (0.1%), глутаровый диальдегид (0.1%), глюкооксидаза и пероксидаза в соотношении 2:5. Схема получения исследуемых полимерных пленок на основе поливинилпирролидона (ПВП) представлена на рисунке 2.
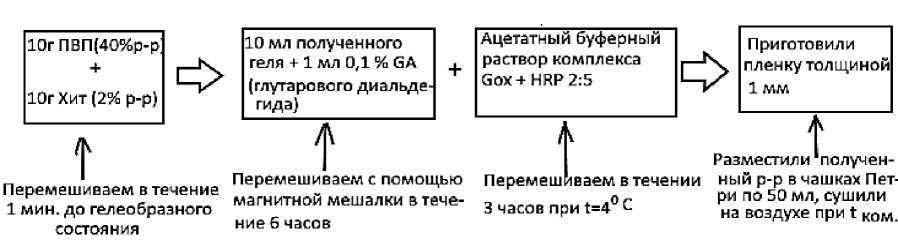
Рисунок 2. Схема получения ферментполимерной композиции на основе ПВП
Для оценки влияния времени иммобилизации (x1), pH иммобилизации (x2) и соотношения фермент/носитель (x3) на активность работы ферментных электродов, использовался трехфакторный и трехуровневый дизайн Бокса-Бенкена и RSM [4]. Методология поверхностного отклика (RSM) - это набор математических и статистических методов для планирования экспериментов, построения моделей, оценки относительной значимости нескольких независимых переменных и определения оптимальных условий для получения желаемых откликов [5]. Она используется для оценки влияния различных параметров и их взаимодействия в процессе, при этом требуется небольшое количество экспериментов. По сравнению с однофакторным планом, который наиболее часто используется в литературе, экспериментальный план и RSM более эффективен в плане сокращения как количества экспериментальных прогонов, так и количества времени, необходимого для исследования оптимальных условий.
Переменные каждого из выбранных уровней исследования были следующими: время иммобилизации 0,5–1,5 ч, pH 6–8 и соотношение фермент/носитель 1–3, масс. частей.
Вольтамперометрические характеристики измерялись с помощью трехэлектродной электрохимической ячейки с разделенным катодным и анодным пространством. Измерения проводились с помощью потенциостата-гальваностата Р-40Х. Все кривые I/E были записаны при скорости сканирования 2 мВ/с.
Результаты и их обсуждение
В Таблице 1 показаны уровни независимых факторов и экспериментальные планы как закодированные (0,1 и -1), так и некодированные (фактическое значение). В общей сложности были применены 15 экспериментальных прогонов, включая комбинации различных уровней трех факторов, были выполнены в двух экземплярах. Экспериментальные данные (Таблица 1) были проанализированы с помощью регрессии поверхности отклика (RSREG) с помощью программного обеспечения SAS, чтобы соответствовать следующему полиномиальному уравнению второго порядка.
Y= в ко + ^ 3=i Pki Xi + '£ f=1 fikiiX ? + Y 2=i ^ j=i+i PkijXiXj (1)
где Y — ответ (активность GOx/HRP); β k0 , β ki , β kii и β kij — постоянные коэффициенты; X i и X j — незакодированные независимые переменные.
Опция максимумов использовалась для расчета предполагаемого максимального отклика для увеличения радиуса активного центра.
Таблица 1.
ПЛАН БОКСА-БЕНКЕНА И НАБЛЮДАЕМЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ
ДЛЯ АНАЛИЗА ТРЕХУРОВНЕВОЙ И ТРЕХФАКТОРНОЙ ОТКЛИКА ПОВЕРХНОСТИ
|
Номер варианта |
Время |
pH, x 2 |
Фермент/субстрат |
Активность GOx/HRP, ед/г |
|
1 |
0 (60) |
-1(6) |
-1(1) |
20,44±0,63 |
|
2 |
1(30) |
0(7) |
-1(1) |
11,76±0,51 |
|
3 |
1(90) |
0(7) |
-1(1) |
16,52±1,06 |
|
4 |
0(60) |
1(8) |
-1(1) |
3,36±0,33 |
|
5 |
1(30) |
-1(6) |
0(2) |
27,18±0,49 |
|
6 |
1(90) |
1(6) |
0(2) |
28,80±0,63 |
|
7 |
0(60) |
0(7) |
0(2) |
20,82±1,40 |
|
8 |
0(60) |
0(7) |
0(2) |
19,60±1,18 |
|
9 |
0(60) |
0(7) |
0(2) |
19,60±0,63 |
|
10 |
1(30) |
1(8) |
0(2) |
5,48±0,11 |
|
11 |
1(90) |
1(8) |
0(2) |
8,45±1,15 |
|
12 |
0 (60) |
-1(6) |
1(3) |
32,81±0,18 |
|
13 |
1(30) |
0(7) |
1(3) |
26,55±0,92 |
|
14 |
1(90) |
0(7) |
1(3) |
23,58±0,54 |
|
15 |
0 (60) |
1(8) |
1(3) |
6,95±0,40 |
Среди различных обработок наибольшей активностью иммобилизованной GOX/HRP (32,81 Ед./г-носитель) была обработка №12 (1 час, pH 6 и фермент/носитель как 3/1), а наименьшая активность иммобилизованного GOX/HRP (всего 3.36 Ед./г носителя) была №4 (1 час, pH=8 и соотношение фермент/носитель=1). Из программного обеспечения SAS, выводимого RSREG полиномиальное уравнение второго порядка может быть выражено формулой (2).
Y =- 05.026646-0.001950 X 1 + 36.797382 X 2 + 27.958758 X 3 + 0.00065 X 1 X 1 (2)
+0.011237 X 2 X 1 – 3.121525X 2 X 2 -0.064411X 3 X 1 -2.196478X 3 X 2 –0.998031X 3 X 3
где Y — активность иммобилизованного GOX/HRP; x 1 — время иммобилизации; x 2 — pH иммобилизации; x 3 — соотношение фермент/носитель.
Дисперсионный анализ показал, что эта квадратичная полиномиальная модель очень значима и в достаточной степени представляет реальную взаимосвязь между ответом и тремя параметрами с очень низким значением p (<0,001) и удовлетворительным коэффициентом детерминации (R 2 = 0,99). Таким образом, эта модель смогла адекватно предсказать результаты иммобилизации в пределах диапазона используемых переменных.
Результаты, представленные в Таблице 2, показывают, что увеличение активности GOX/HRP на электроде повысит стабильность напряжения ячейки и плотность тока. На Рисунке 2 также представлены кривые удельной мощности. В отсутствие GOX/HRP максимальная удельная мощность, получаемая от ПВП/Chit, составила всего 0,02 мВт/см2. Результаты демонстрируют, что производительность ферментативного биотопливного элемента прямо пропорциональна активности иммобилизованного комплекса GOX/HRP, поскольку в этом случае реакция окисления глюкозы может протекать более эффективно.
Таблица 2.
ЭКСПЕРИМЕНТАЛЬНЫЕ УСЛОВИЯ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПОДГОТОВКИ АНОДНОГО ЭЛЕКТРОДА GOX/HRP ДЛЯ ИСПЫТАНИЯ ФЕРМЕНТНОГО ТОПЛИВНОГО ЭЛЕМЕНТА
|
Электрод |
Время (мин) |
pH |
Соотношение фермент/носитель |
Экспериментальная активность, ед/мг |
|
1 |
50 |
5,9 |
3 |
33,5 |
|
2 |
60 |
7,0 |
2 |
20,0 |
|
3 |
60 |
8,0 |
1 |
3,4 |
В атмосфере кислорода в области предельного тока были рассчитаны каталитические константы (k кат ) реакции электровосстановления кислорода, где вторым субстратом являлся электропроводный носитель (электрод) и сопоставлены с k кат (120 ÷ 130 с-1) для ферментативного катализа. Расчет k кат проводили по формуле (3).
I макс = nFk кат ГА
где I макс — максимальный ток; n — число электронов, участвующих в реакции; F — число Фарадея; Г — заполнение ферментом; А — площадь электрода.
Показано, что k кат составила, с-1: 70, 15 для композитов ПВП/Chit/GA/GOx/HRP и ПВП/GOX/HRP соответственно. Отсюда следует, что наиболее благоприятные условия и наибольшее число молекул комплекса ферментов находится в электрохимически активном состоянии при их иммобилизации на ПВП с использованием модифицирующих агентов хитозана и глутарового диальдегида.
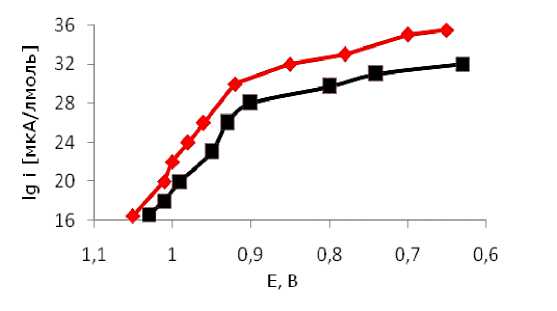
Рисунок 3. Тафелевские зависимости, полученные на композитах: ПВП/ Chit/GA/GOX/HRP — электрод 1, ПВП/ GOx/HRP —электрод 2
На электроде с GOX/HRP, иммобилизованном на ПВП с помощью модификаторов хитозана и глутарового диальдегида, наблюдались более высокие значения тока восстановления кислорода во всей исследованной области потенциалов (рисунок 3). Поляризационные кривые в тафелевских координатах аналогичны для всех электродов с иммобилизованной биополимерной композицией GOX/HRP: наблюдаются наклоны 0,03, 0,06 и 0,12 В и выход на предельный ток (Рисунок 3). При этом, величины токов, полученные на электродах с GOX/HRP, иммобилизованном различными способами, заметно отличаются.
Повторяющиеся циклические вольтамперограммы, полученные с обоими полимерными /ферментными электродами, показали стабильный отклик по току в течение нескольких циклов (Рисунок 4 A, B). В процессе исследований оценивали вклад окисления D-глюкозы, опосредованного GOX/HRP комплексом, чтобы гарантировать, что обнаруженный отклик по току был основан исключительно или в основном на электрической связи между полимером и биокатализатором. В этих испытаниях чистый окислительно-восстановительный полимер был нанесен по каплям на графитовые электроды, и были записаны циклические вольтамперограммы с добавлением Chit/GA и без модификатора. Датчики, модифицированные ПВП/Chit/GA, вырабатывали более сильный анодный ток при добавлении D-глюкозы (Рисунок 4 A), в то время как ПВП/GOX/HRP практически не реагировал на это (Рисунок 4 B).
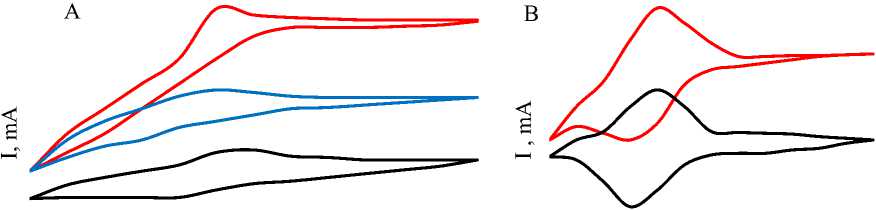
Рисунок 4. A) Циклические вольтамперограммы модификаций графитового электрода ПВП/ Chit/GA/ GOX/HRP (красные линии); ПВП/ /GOx/HRP (синие линии); графитовый электрод без модификаций (черные линии); B) Циклические вольтамперограммы с применением графитовых электродов после 10 циклов работы электрохимической ячейки
Однако, для обоих полимерных покрытий наблюдалось наибольшее повышение тока при потенциалах выше -50 мВ по сравнению с Ag/AgCl/3M, KCl, что указывает на некоторое окисление D-глюкозы непосредственно на поверхности графитового электрода.
В результате проведенного исследования было установлено, что оптимальному пространственному расположению окислительно-восстановительного центра ферментполимерного покрытия графитового электрода способствуют функциональные группы модифицирующих агентов. Данный факт подтверждает тот факт, что с применением электрода покрытого ферментполимерным комплексом содержащим хитозан и глутаровый диальдегид происходит наибольшее увеличение силы тока в реакции окисления D-глюкозы.
Оба протестированных полимера были способны обмениваться электронами с графитовой подложкой электродов, но существенно различались по эффективности, что подтверждает функциональную связь ферментного комплекса GOx/HRP с поверхностью электрода с помощью окислительно-восстановительного полимера. В работе, также, определены оптимальные условия для иммобилизации ферментного комплекса: время иммобилизации 50 мин, рН 5,9, соотношение фермент/носитель 3 масс. ч.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект №19-08-00186).
Список литературы Исследование влияния физико-химических факторов на активность работы модифицированных ферментных электродов
- Duong N. B., Wang C. L., Huang L. Z., Fang W. T., Yang H. Development of a facile and low-cost chitosan-modified carbon cloth for efficient self-pumping enzymatic biofuel cells // Journal of Power Sources. 2019. V. 429. P. 111-119. DOI: 10.1016/j.jpowsour.2019.05.001
- Morshed M. N., Behary N., Bouazizi N., Guan J., Chen G., Nierstrasz V. Surface modification of polyester fabric using plasma-dendrimer for robust immobilization of glucose oxidase enzyme // Scientific reports. 2019. V. 9. №1. P. 1-16. DOI: 10.1038/s41598-019-52087-8
- Turner A., Karube I., Wilson G. S. Biosensors: fundamentals and applications. Oxford university press, 1987.
- Abreu C., Nedellec Y., Ondelc O., Buretc F., Cosnier S., Le, Go Sodium tripolyphosphate cross-linked chitosan based sensor for enhacing sensing properties towards acetone // Journal of Power Sources. 2020. V. 392. P. 176-180.
- Del Torno-de Román L., Navarro M., Hughes G., Esquivel J. P., Milton R. D., Minteer S. D., Sabaté N. Improved performance of a paper-based glucose fuel cell by capillary induced flow // Electrochimica Acta. 2018. V. 282. P. 336-342. DOI: 10.1016/j.electacta.2018.05.074
- Weibel M. K., Bright H. J. The glucose oxidase mechanism: interpretation of the pH dependence // Journal of Biological Chemistry. 1971. V. 246. №9. P. 2734-2744. -X DOI: 10.1016/S0021-9258(18)62246
- Лакина Н. В., Долуда В. Ю., Рабинович Г. Ю., Лакина М. Е., Сивенок А. М. Физико-химическое исследование структуры и активности биополимерных матриц на основе комплекса окислительно-восстановительных ферментов // Бюллетень науки и практики. 2020. Т.6. №11. С. 12-22. DOI: 10.33619/2414-2948/60/01


