Исследование влияния метаболитов растений фенольной природы на свойства поверхности и состав гликополимеров бактерий Azospirillum brasiense SR55
Автор: Каневский Матвей Владимирович, Петрунина Александра Александровна, Гулий Ольга Ивановна, Федоненко Юлия Петровна, Коннова Светлана Анатольевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 1-1 т.16, 2014 года.
Бесплатный доступ
Показано, что выращивание Azospirillum brasilense SR55 в присутствии рутина и кверцетина приводит к изменениям физико-химических свойств поверхности бактериальных клеток, а также индуцирует синтез липополисахаридов, отличных от исходных по структуре антигенных детерминант, макромолекулярной организации, моносахаридному составу и соотношению жирных кислот.
Флавоноиды, кверцетин, рутин, липополисахарид
Короткий адрес: https://sciup.org/148205686
IDR: 148205686 | УДК: 579.262
Текст научной статьи Исследование влияния метаболитов растений фенольной природы на свойства поверхности и состав гликополимеров бактерий Azospirillum brasiense SR55
В процессе жизнедеятельности растения синтезируют и выделяют в окружающую среду широкий спектр соединений: органические кислоты, в том числе и аминокислоты, моно- и полисахариды, а также вторичные метаболиты, которые играют важную роль в растительно-микробных взаимодействиях [21]. Среди всего разнообразия веществ, выделяемых растением в ризосферу, особое место занимают флавоноиды – соединения фенольной природы – выполняющие множество функций, в том числе: защита корней от патогенных микроорганизмов и грибов, а также хемоаттракция и стимуляция роста аммонифицирующих бактерий [19, 23].
Молекулярный диалог между микро- и макропартнёрами наиболее детально изучен на модельной системе бобово-ризобиального симбиоза. Установлено, что экссудаты корней растений семейства Fabaceae активируют экспрессию бактериальных генов, вовлечённых в установление симбиотических отношений с ризобиями [17], а для бактерий рода Sinorhizobium показано, что культивирование в присутствии флавоноидов приводит к изменению состава гликополимеров поверхности бактериальной клетки: липополисахаридов (ЛПС), капсульных полисахаридов (КПС) и экзополисахаридов (ЭПС) – которые играют важную роль в формировании симбиоза [16].
Данные о влиянии флавоноидов злаковых растений на установление ассоциативных отношений с микроорганизмами немногочисленны [11]. В качестве модельного объекта исследования ассоциативных микроорганизмов в последние годы используются бактерии рода Azospirillum , для которых ранее было показано, что культивирование A. brasilense Cd в присутствии экссудатов корней пшеницы, содержащих в том числе и флавоноиды, приводит к изменению состава ЭПС [15], а под воздействием кверцетина (1,3 мМ) изменяется структура и состав ЛПС и КПС бактерий A. lipoferum Sp59b [2, 3].
Поскольку с практической точки зрения наиболее важным является изучение формирования ассоциации азоспирилл с хлебными злаками, то внимание исследователей привлекают содержащийся в экссудатах корней пшеницы флавонол кверцетин [9], а также широко распространённый гликозид кверцетина – рутин [10]. При этом, поскольку в состав рутина входит углеводная компонента, представленная дисахаридом рутинозой, он характеризуется меньшей гидрофобностью.
Учитывая важную роль флавоноидов и углеводных компонентов клеточной мембраны бактерий в образовании ассоциации, цель работы состояла в выявлении характера влияния флавоноидов на состав и структуру гликополимеров поверхности A. brasilense SR55.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Культура A. brasilense SR55 [6], изолированная с корней твёрдой пшеницы Triticum durum L. любезно предоставлена коллекцией микроорганизмов ИБФРМ РАН (г. Саратов). Исследуемый штамм культивировали в жидкой синтетической среде до окончания экспоненциальной фазы роста [20]. Растворы флавоноидов в диметилформамиде вносили в среду после стерилизации до внесения инокулята.
Измерения ориентационных спектров клеток проводили на электрооптическом анализаторе ELUS, разработанном в Государственном научном центре прикладной микробиологии (Обо-ленск, Россия) как описано в работе [1]. Условия измерений электрооптических параметров клеток были выбраны следующие: напряженность электрического поля 17 В/см при времени приложения 16 сек; проведение измерений на частотах 740, 1000, 1450, 2000 и 2800 кГц; количество клеток в измерительной ячейке 4.2 x 107 кл./мл.
Перед проведением электрооптического анализа клетки отмывали трехкратным центрифугированием при 2800×g в течение 5 мин дистиллированной водой, затем ресуспендировали в небольшом количестве дистиллированной воды (электропроводность 1.8 ц.8/см). Для устранения конгломератов клетки вновь центрифугировали при 110 x g в течение 1 мин. Оптическую плотность суспензии, оставшейся в надосадочной жидкости, доводили до 0.4 при λ=670 нм.
Ориентационные спектры (ОС) представлялись в виде частотной зависимости разности значений оптической плотности суспензий δ ОD, измеренных при распространении пучка неполяри-зованного света вдоль и поперек направления ориентирующего поля. Эта разность была нормирована на значение оптической плотности при хаотической ориентации клеток [5, 8].
Кривые на рисунках строились по средним значениям, полученным в результате не менее 5 экспериментов. Для статистической обработки экспериментальных данных также использовали пакет прикладных программ Microsoft Excel 2000.
Твердофазный иммуноферментный анализ (ТИФА) выполняли в полистироловых 96-луночных планшетах («Медполимер», Россия). По 50 мкл последовательных двукратных разведений растворов ЛПС (в 0,15 М фосфатносолевом буфере, рН 7.2) вносили в лунки планшетов. Иммунодетекцию проводили, с применением поликлональных кроличьих антител к препарату ЛПС A. brasilense SR55. В качестве вторых Ат использовали козьи антикроличьи антитела, конъюгированные с пероксидазой хрена («Sigma»). В качестве субстратного реагента использовали перекись водорода с 3,3’-диаминобензидином. Оптическое поглощение исследуемых проб измеряли на иммунофермент-ном анализаторе Multiscan Ascent при λ=492 нм («Thermo scientific», Финляндия).
Капсульный материал смывали с поверхности бактериальных клеток 0.15 М NaCl в течение 6 суток с ежедневной заменой отмывающего раствора. Бескапсульные клетки высушивали в ацетоне и использовали для экстракции ЛПС 45% водным раствором горячего фенола без разделения слоёв [4]. Экстракты концентрировали, обрабатывали CCl3COOH, затем отделяли от осадка белков и нуклеиновых кислот центрифугированием в течение 30 минут при 5000 об/мин. ЛПС освобождали от низкомолекулярных соединений на колонках с Sephadex G-50 (42×2.6 см, V0=30 мл, «GE Healthcare», США). Фракции, выходившие с нулевым объёмом колонки и содержавшие углеводы, объединяли, концентрировали и лиофилизировали. Наличие углеводных компонентов определяли по поглощению продуктов реакции элюата с фенолом и серной кислотой при λ=492 нм [14].
Электрофорез препаратов ЛПС в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ) выполняли в соответствии с методикой [18] с последующей визуализацией продуктов разделения углеводных компонентов визуализировали окрашиванием гелей красителем на основе азотнокислого серебра с предварительным перйодатным окислением [28].
Содержание в препаратах углеводов, фосфора и КДО определяли с помощью общепринятых спектрофотометрических методов в соответствии с [20]. Для исследования содержания примесей белка в образцах применяли метод Лоури [22].
Метилирование жирных кислот для исследования состава липида А выполняли согласно методике, описанной в работе [24]. Жирные кислоты идентифицировали методом ГЖХ по эталонным образцам фирмы «Sigma» (США) на хроматографе GC-2010 («Shimadzu», Япония).
Моносахаридный состав ЛПС исследовали методом ГЖХ ацетатов полиолов на хроматографе Hewlett Packard 5890. Образцы предварительно гидролизовали 2М CF 3 COOH (120°C, 2 ч) с последующим восстановлением NaBH 4 и ацетилированием [27].
О-специфический полисахарид (ОПС) выделяли мягким гидролизом ЛПС в 2% СН 3 СООН в течение 4 часов при 100°С. Центрифугированием (20 мин при 12000×g) осаждали липид А. Супернатант фракционировали на Sephadex G-50.
Исследование методом ЯМР спектроскопии выполняли на спектрометре DRX-500 («Brucker», Германия) в растворе 99.96% D 2 O при 27°С с ацетоном в качестве внутреннего стандарта (δ H 2.225, δC 31.45). Образцы предварительно дважды лиофилизировали из 99.9% D 2 O.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Интерес к флавоноидам обусловлен их широкой распространённостью среди вторичных метаболитов фенольной природы, экскретируемых в почву, и определяющей ролью в симбиотических отношениях [21].
Поскольку флавоноиды плохо растворимы в воде для достижения цели был использован диме- тилформамид, так как он обладает наименьшей собственной бактериостатической активностью по отношению к азоспириллам (Каневский и др., 2012).
-
А. brasilense SR55 выделен с поверхности корней Triticum durum L. ЛПС этой бактериальной культуры включает в свой состав О-специфический полисахарид (ОПС) с разветвлённым октасахаридным повторяющимся звеном, в состав которого входят рамноза, 3-О-метил-рамноза, галактоза и глюкуроновая кислота [7].
Для выявления влияния флавоноидов на макромолекулярную организацию ЛПС проводили культивирование бактерий в жидкой синтетической среде с малатом натрия и хлоридом аммония [20]. Концентрации флавоноидов – для кверцетина в среде от 31,3 мкМ до 2 мМ и для рутина от 125 мкМ до 2 мМ – были на несколько порядков ниже бактериостатической, установленной нами ранее [2]. ЛПС выделяли из биомассы ЭДТА-содержащим экстрагирующим буфером с последующим электрофоретическим разделением и визуализацией результатов. Как было показано ранее [7] и установлено нами в препарате ЛПС SR55 наряду с молекулами с длинной О-цепью в высокой концентрации присутствовали молекулы, О-цепь которых представлена несколькими повторяющимися звеньями или отсутствует (рис. 1. трек 1).
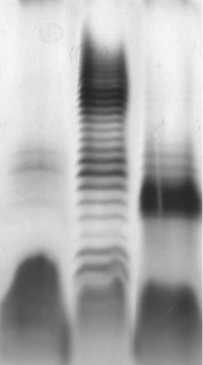
Рис. 1. Результат электрофоретического анализа в ДСН-ПААГ ЛПС клеток A. brasilense SR55, выращенных в присутствии флавоноидов: 1 – ЛПС; 2 – ЛПС Q ; 3 – ЛПС R

-
1 2 3
При добавлении в среду кверцетина в концентрации 62.5 мкМ в ЛПСQ наблюдали увеличение степени полимеризации О-цепи, о чём свидетельствует наличие полос в верхней части электрофоретического трека (Рис. 1. Трек 2). Выращивание бактерий в присутствии рутина в указанных концентрациях приводило к накоплению также фракции ЛПС с более высокой молекулярной массой, чем у контрольного образца (Рис. 1. Трек 3). Изменение степени полимеризации О-цепи ранее показано для Sinorhizobium fredii USDA205, у которых под воздействием флавоноида апиге-нина изменялсь молекулярная масса ОПС [26].
Для оценки влияния флавоноидов на микробные клетки использовали метод ЭО анализа клеточных суспензий. Цикл исследований по изучению электрофизических свойств микроорганизмов, выполненный ранее с различными бактериальными клетками и действующими агентами (агглютинином зародыша пшеницы, ксенобиотиками, антителами, бактериофагами, антибиотиками), позволил выявить одну общую закономерность: специфическое взаимодействие вещества с клетками приводит к выраженному изменению величины элеткрооптической экстинкции (ЭОЭ) клеточных суспензий [1, 8]. Исследование ЭО свойств клеток, выращенных в присутствии флавоноидов, может показать не только сам факт влияния флавоноидов на микроорганизмы, но и (по изменению величины ЭО параметров) оценить воздействие соединения на микробные клетки количественно.
Установлено, что в исследуемом диапазоне частот 740, 1000, 1450, 2000 и 2800 кГц регистрируются изменения величины ЭО сигнала суспензии клеток после культивирования с кверцетином и рутином, начиная с концентраций 62,5 и 125 мкМ, соответственно, по сравнению с контролем. Имеет место концентрационная зависимость эффекта для кверцетина: максимальное изменение величины ЭО сигнала фиксируется при концентрации кверцетина 500 мкМ. Для удобства представления экспериментальных данных была использована величина ЭО сигнала при частоте ориентирующего поля 1000 кГц. Как видно из полученных данных, линейная зависимость величины электрооптического эффекта от концентрации кверцетина для клеток азоспирилл наблюдалась в интервале концентрации 31,25 до 500 мкМ (рис. 2). В дальнейших исследованиях использовались кверцетин и рутин в концентрациях 62,5 и 125 мкМ соответственно.
Как видно из представленных данных добавление в среду выращивания кверцетина (62,5 мкМ) и рутина (125 мкМ), приводило к снижению, по сравнению с контролем, величины ЭО сигнала на 8% и на 10%, соответственно, что свидетельствует об изменении физико-химических характеристик поверхности бактерий.
Методом ТИФА препаратов ЛПС для концентрации 0,5 мкг/мл были обнаружены небольшие, но статистически достоверные изменения антигенного состава ЛПС контрольных и опытных образцов, что может свидетельствовать о появлении в структуре ЛПС дополнительных антигенных детерминант (рис. 3).
Методом солевой агрегации [12] было показано увеличение относительной гидрофобности поверхности бактериальных клеток, выращенных в присутствии кверцетина, на 30% по сравнению с контролем. В связи с этим, очевидно, уже на ранних стадиях роста наблюдалась агрегация бактериальных клеток. Гидрофобность поверхности играет важную роль в формировании симбиоза на стадии адсорбции микроорганизмов на корнях растений-ассоциантов [25]. Методом микроскопии в тёмном поле было выявлено, что присутствие флавоноидов в среде выращивания не влияло на подвижность бактерий. Для исследования химического состава ЛПС экстрагировали горячей водно-фенольной смесью из отмытых от капсульного материала бактериальных клеток.
CD 300000
О CD

О Кверцетин
□ Рутин
Контр оль 62.5 мкМ 125 мкМ 250 мкМ 500 мкМ 1000 мкМ 2000 мкМ
Концентрация флавоноидов, мкМ
Рис. 2. Зависимость показателя ЭОЭ суспензии клеток A. brasilense SR55, культивируемых в присутствии различных концентраций флавоноидов при частоте ориентирующего поля 1000 кГц.
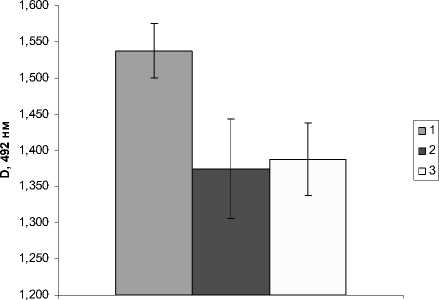
Рис. 3. Твердофазный иммуноферментный анализ образцов ЛПС (1), ЛПС Q (2) и – ЛПС R (3) с АТ на ЛПС бактерий A. brasilense SR55.
Примечание: все препараты флавоноидов были использованы в концентрирации 0.5 мкг/мл
Анализ липидных компонентов ЛПС методом ГЖХ метиловых эфиров обнаружил отличия липида А по соотношению жирных кислот в экспериментальных образцах (ЛПСQ и ЛПСR) от контрольного, выращенного в среде без добавления флавоноидов (Таблица). В образцах ЛПСR и ЛПСQ наблюдалось увеличение количества 3гидрокситетрадекановой и 3гидроксигексадекановой кислот, а также снижение количества трансоктадеценовой кислоты. Более выраженные изменения в составе жирных кислот происходили при выращивании бактерий в присутствии рутина. Следует отметить, что в экс- периментальных образцах возрастает доля гидроксикислот и снижается количество непредельных кислот.
В ходе сравнительного анализа химического состава установлено возрастание доли углеводной компоненты в препарате ЛПС Q (80,7%) и снижение её в препарате ЛПСR (50,4%) по сравнению с контрольным образцом ЛПС (67,8%) (Таблица). Полученные данные коррелируют с результатами электрофореза. Возрастание относительной доли углеводной компоненты ЛПС бактерий, выращенных в присутствии флавоноидов, ранее было описано в работе [29]. Культивирование бактерий в присутствии флавоноидов не приводило к незначительным изменениям относительного количества КДО, белка и фосфора (Таблица).
Таблица . Химический состав препаратов липополисахаридов A. brasilense SR55
|
Компоненты |
Препараты |
||||
|
ЛПС |
ЛПС Q |
ЛПС R |
|||
|
и s s I о О |
Углеводы |
67,8±4,31 |
80,7±4,63 |
50,4±2,24 |
|
|
Белки |
2,5±1,42 |
1,7±1,01 |
0,9±0,52 |
||
|
КДО |
1,31±0,07 |
1,11±0,03 |
1,45±0,13 |
||
|
Фосфор |
1,88±0,07 |
1,81±0,19 |
1,28±0,05 |
||
|
2 |
3ОН-14:0 |
25±1,43 |
36±0,93 |
39±2,34 |
|
|
3ОН-16:0 |
13±0,51 |
18±0,61 |
23±1,22 |
||
|
18:1 |
50±0,42 |
36±0,21 |
27±2,00 |
||
|
19:0 |
11±0,21 |
8±1,12 |
9±0.,3 |
||
Исследование методом ГЖХ показало наличие в составе ЛПС R и ЛПС Q моносахаридных остатков, ранее определённых в структуре ЛПС [7], однако сигнал глюкозы, который был в контрольном образце в 2 раза меньше сигнала галактозы, в опытных образцах одинаков по интенсивности для этих моносахаридов. Изменение соотношения входящих в состав ОПС моносахаридов может указывать на появление в структуре О-цепи нового звена иного состава. Подобный эффект воздействия кверцетина на ЛПС бактерий обнаружен нами ранее [3], однако у культуры A. brasilense SR55 наблюдается снижение степени представленности на поверхности исходного антигена, возможно, за счёт появление новых структурных компонентов в составе ОПС. Таким образом, показано, что влияние флавоноидов на бактерии реализуется в изменении макромолекулярной организации, химического состава и структуры ЛПС, а также физико-химических свойств поверхности бактерий в целом.
Список литературы Исследование влияния метаболитов растений фенольной природы на свойства поверхности и состав гликополимеров бактерий Azospirillum brasiense SR55
- Гулий О.И., Антонюк Л.П., Игнатов В.В., Игнатов О.В. Динамика изменений электрофизических свойств клеток Azospirillum brasilense Sр7 при их связывании с агглютинином зародыша пшеницы//Микробиология. 2008. Т.77, №6. С.782-787.
- Каневский М.В., Коннова С.А., Бойко А.С., Федоненко Ю.П., Игнатов В.В. Влияние кверцетина на структуру липополисахарида внешней мембраны бактерий Azospirillum lipoferum Sp59b//Изввестия Саратов. ун-та. 2012. Т.12. Сер. Химия. Биология. Экология, вып. 2. С.50-54.
- Каневский М.В., Коннова С.А., Бойко А.С., Федоненко Ю.П., Сигида Е.Н., Игнатов В.В. Влияние флавоноидов на состав гликополимеров поверхности Azospirillum lipoferum Sp59b//Микробиология. 2014. Т.83. № 1-2. С. 143-151.
- Кульшин В.А., Яковлев А.П., Аваева С.Н., Дмитриев Б.А. Улучшенный метод выделения полисахаридов из грамотрицательных бактерий//Мол. Генетика, микробиология, вирусология. 1987. № 5. С. 44-46.
- Мирошников А., Фомченков В.М., Иванов А.Ю. Электрофизический анализ и разделение клеток. М.: Наука, 1986. 185 с.
- Позднякова Л.И., Каневская С.В., Леванова Г.Ф., Барышева Н.Н., Пилипенко Т.Ю., Богатырёв В.А., Фёдорова Л.С. Таксономическое изучение азоспирилл, выделенных из злаков Саратовской области//Микробиология. 1988. Т.57, № 2. С.275-278.
- Boyko A.S., Konnova S.A., Fedonenko Yu.P., Zdorovenko E.L., Smol'kina O.N., Kachala V.V., Ignatov V.V. Structural and functional peculiarities of the lipopolysaccharide of Azospirillum brasilense SR55, isolated from the roots of Triticum durum//Microbiol. Res. 2011. V.166. P.585-593.
- Bunin V.D., Voloshin A.G. Determination of cell structures, electrophysical parameters, and cell population heterogeneity//J. Colloid Interf. Sci. 1996. Vol. 180. P. 122-126.
- Calzuola I., Marsili V., Gianfranceschi G.L. Synthesis of antioxidants in wheat sprouts//J. Agr. Food Chem. 2004. V.52, № 16. P.5201-5206.
- Cesco S., Mimmo T., Tonon G., Tomasi N., Pinton R., Terzano R., Neumann G., Weisskopf L., Renella G., Landi L., Nannipiery P. Plant-borne flavonoids released into the rhizosphere: impact on soil bio-activities related to plant nutrition. A review//Biol. Fert. Soils. 2012. V.48. P.123-149.
- Chamam A., Sanguin H., Bellvert F., Meiffren G., Comte G., Wisniewski-Dye F., Bertrand C., Prigent-Combaret C. Plant secondary metabolite profiling evidences strain-dependent effect in the Azospirillum-Oryza sativa association//Phytochemistry. 2013. V.87. P.65-77.
- Dillon J.K., Fuerst J.A., Hayward A.C., Davis G.H.G. A comparison of five methods for assaying bacterial hydrophobicity//J. Microbiol. Meth. 1986. V6. P.13-19.
- Dobereiner J., Day J.M. Associative symbiosis in tropical grasses: characterization of microorganisms and dinitrogen-fixing sites//Pros. I Intern. Symp. Nitrogen Fixat/Ed.by W.E. Newton, C.J. Nyman. Washington. 1976. P.518-537.
- Dubois M., Gilles K.A., Hamilton J.K., Rebers P.A., Smith F. Colorimetric method for determination of sugars and related substances//Anal. Chem. 1956. V.28., № 3. P.350-356.
- Fischer S.E., Miguel M.J., Morri G.B. Effect of root exudates on the polysaccharide composition and the lipopolysaccharide profile of Azospirillum brasilense Cd under saline stress//FEMS Microbiol. Lett. 2003. V.219. P.53-62.
- Fraysse N., Jabbouri S., Treilhou M., Couderc F., Poinsot V. Symbiotic conditions induce structural modifications of Sinorhizobium sp. NGR234 surface polysaccharides//Glycobiology. 2002. V.12, № 11. P.741-748.
- Hassan S., Mathesius U. The role of flavonoids in root-rhizosphere signalling: opportunities and challenges for improving plant-microbe interactions//J. Exp. Bot. 2012. V.63, № 9. P.3429-3444.
- Hitchcock P.J., Brown T.M. Morphological heterogeneity among Salmonells lipopolysaccharide chemotypes in silver-stained polyacrilamide gels//J. Bacteriol. 1983. V.154. P. 269-277.
- Kong C. H., Zhao H., Xu X. H., Wang P., and Gu Y. Activity and Allelopathy of Soil of Flavone O-Glycosides from Rice//J. Agric. Food Chem. 2007. V.55. P.6007-6012.
- Konnova S.A., Makarov O.E., Skvortsov I.M., Ignatov V.V. Isolation, fractionation and some properties of polysaccharides produced in a bound form by Azospirillum brasilense and their possible involvement in Azospirillum-wheat interactions//FEMS Microbiol. Lett. 1994. V. 118. P.93-99.
- Kumar R., Bhatia R., Kukreja K., Behl R.K., Dudeja S.S., Narula N. Establishment of Azotobacter on plant roots: chemotactic response, development and analysis of root exudates of cotton (Gossypium hirsutum L.) and wheat (Triticum aestivum L.)//J. Basic. Microb. 2007. V.47, № 5. P.436-439.
- Lowry O.H., Rosenbrough N.J., Farr A.L., Randall R.J. Protein measurement with Folin phenol reagent//J. Biol. Chem. 1951. V.193. № 1. P.265-275.
- Mandal S.M., Chakraborty D., Dey S. Phenolic acids act as signaling molecules in plant-microbe symbiose//Plant Signal. Behav. 2010. V.5. P.359-368.
- Mayer H., Tharanathan R.N., Weckesser J. Analysis of lipoplysaccharides of Gramnegative bacteria//Method. Microbiol. 1985. V.18. P.157-207.
- Michiels K.W., Crors C.L., Vanderleyden J. Two different modes of attachment of Azospirillum brasilense Sp7 to wheat roots//J. Gen. Appl. Microbiol. 1991. V.137. P.2241-2246.
- Reuhs B.L., Kim J.S., Badgett A. and Carlson R.W. Production of cell-associated polysaccharides of Rhizobium fredii USDA205 is modulated by apigenin and host root extract//Mol. Plant Microbe In. 1994. V.7. P.240-247.
- Sawadecker J.S., Sloneker J.H., Jeanes A. Quantative determination of monosaccharides as their alditol acetates by gas liquid chromatography//Anal. Chem. 1965. V.37. P.1602-1603.
- Tsai C.M., Frasch C.E. A sensitive silver stain detecting lipopolysaccharides in polyacrilamide gels//Anal. Biochem. 1982. V.119. P.115-119.
- Wasson A.P., Pellerone F.I., Mathesius U. Silencing the flavonoid pathway in Medicago truncatula inhibits root nodule formation and prevents auxin transport regulation by rhizobia//Plant Cell. 2006. V.18. P.1617-1629.


