Исследование влияния пестицидов на состояние механизмов естественной резистентности
Автор: Константинова Светлана Архиповна, Цыремпилов Петр Бадмаевич
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Статья в выпуске: 12, 2010 года.
Бесплатный доступ
Статья посвящена исследованию воздействия пестицидов как фактора экологического воздействия на организм животных и человека. Представлены результаты исследования действия пестицидов на состояние отдельных клеточных и гуморальных факторов естественной резистентности животных
Экология, пестициды, иммунная система, естественная резистентность
Короткий адрес: https://sciup.org/148179226
IDR: 148179226 | УДК: 616-001
Текст научной статьи Исследование влияния пестицидов на состояние механизмов естественной резистентности
Иммунная система в силу своей исключительной чувствительности может выступать в роли показателя воздействия на организм различных антропогенных факторов, то есть служить индикаторной системой в зоне экологического неблагополучия [2]. Среди веществ, загрязняющих окружающую среду, особую опасность для человека и животных представляют пестициды – единственный класс биологически высокоактивных химических веществ, сознательно вносимых человеком в биосферу и являющихся неотъемлемыми элементами современной сельскохозяйственной технологии. В системе иммунитета важное место принадлежит механизмам естественной резистентности, которые обеспечивают устойчивость к воздействию биологическими агентами. Эффективное поддержание целостности и биологической индивидуальности организма, не подвергавшегося специфической профилактике, всецело зависит от состояния отдельных механизмов, совместная деятельность которых препятствует проникновению инфекционных агентов во внутреннюю среду организма и обезвреживает их внутри организма в случае прохождения через наружные барьеры. В связи с этим представляет интерес изучение действия пестицидов на состояние отдельных клеточных и гуморальных факторов естественной резистентности животных.
Цель исследования: изучить состояние отдельных гуморальных и клеточных факторов иммунной защиты (бактерицидная активность сыворотки крови, уровень лизоцима и бета-лизинов в сыворотке, фагоцитарная активность лейкоцитов) в условиях воздействия пестицидов, оценить их роль в вероятном нарушении резистентности организма.
Материал и методы
В экспериментах были использованы:
-
- животные – половозрелые беспородные кролики, 28 разнополых особей;
-
- пестициды – 2,4-дихлорфеноксиуксусная кислота диметиламмониевая соль (2,4 – ДДМА) 40% водный раствор, гексахлорциклогексан (ГХЦГ) 25% порошок, хлорофос 80% смачивающийся порошок.
Бактерицидная активность сыворотки крови (БАС) определялась нефелометрическим методом (Смирнова О.В., Кузьмина Т.А., 1966). Содержание лизоцима в сыворотке крови – турбидиметрическим методом (Кисель С.С., 1972). Активность бета-лизинов в сыворотке крови – нефелометрическим методом (Бухарин О.В. и соавт., 1970). Фагоцитарная активность лейкоцитов – микрометодом по Кост и Стенко (1975).
Опытные животные были разделены на 7 равных групп. Пестициды вводили через рот 1 раз в сутки ежедневно на протяжении двух месяцев в следующих дозах: хлорофос – 32 и 3,2 мг/кг, 2,4-ДДМА – 40 и 4 мг/кг, ГХЦГ – 9,4 и 4,7 мг/кг. Исследования проводили дважды до начала введения препаратов (фон), а затем 1 раз в 2 недели. Чтобы обеспечить одинаковые условия испытания пестицидов, их введение животным осуществляли в эквивалентных по токсическому эффекту дозах (в равных частях ЛД50, сделав исключение только для ГХЦГ, который из-за выраженных кумулятивных свойств не может длительное время вводиться в дозе 1/10 ЛД50.
Результаты и обсуждения
В течение опыта состояние и поведение животных не изменялось. При введении кроликам хлорофоса в дозе 32 мг/кг БАС в первые 2 недели затравки не отличалась от активности сыворотки крови животных контрольной группы. Через 4 недели БАС резко снизилась и оставалась на низком уровне до конца опыта. При использовании хлорофоса в дозе 3,2 мг/кг падение БАС началось уже через 2 недели (50% контрольного уровня). В последующие сроки сохранялись низкие значения БАС, а через 8 недель после начала введения хлорофоса БАС вообще не определялась (рис. 1).
Под действием 2,4-ДДМА в дозе 40 мг/кг БАС снизилась через 4 недели до нулевых значений у всех подопытных кроликов. В дальнейшем наблюдалось некоторое восстановление активности, однако и к концу опыта величина БАС была в 11,2 раза ниже уровня контрольной группы. При введении 2,4-ДДМА в дозе 4 мг/кг максимальное падение БАС наступало позже (через 8 недель) и было менее выраженным, чем при использовании 2,4-ДДМА в дозе 40 мг/кг (рис. 2). У кроликов, получавших ГХЦГ в дозе 9,4 мг/кг, БАС снижалась в 4 раза через 4 недели после начала затравки, а затем вообще не определялась. ГХЦГ в дозе 4,7 мг/кг вызывал плавное снижение БАС, однако, как и у животных предыдущей группы, через 6 и 8 недель определить бактерицидную активность сывороток не удавалось (рис. 3).
Под действием хлорофоса в дозе 32 мг/кг концентрация лизоцима в сыворотке крови кроликов начала снижаться через 4 недели, упав до нулевых значений через 8 недель. При введении хлорофоса в дозе 3,2 мг/кг концентрация лизоцима также снижалась через 4 недели, однако это снижение было значительно менее выраженным, чем в предыдущей группе. Через 6 и 8 недель сыворотки крови вообще не лизировали тест-объект (рис. 4).
В течение первого месяца затравки кроликов 2,4-ДДМА в дозе 40 мг/кг существенных отличий концентрации лизоцима в сыворотках крови подопытных и контрольных животных не было. Через 6 недель концентрация лизоцима в сыворотке подопытных кроликов превышала контрольный уровень в 1,37 раза, а через 8 недель концентрация лизоцима упала в 6,5 раза по сравнению с контролем. У кроликов, получавших 2,4-ДДМА в дозе 4 мг/кг, наблюдалось стойкое повышение концентрации лизоцима, которое лишь через 8 недель сменилось снижением в 1,5 раза (рис. 5).
При введении кроликам ГХЦГ четко заметен двухфазный характер изменения концентрации лизоцима в сыворотке крови. Длительность и выраженность пика первой фазы повышения концентрации лизоцима находилась в обратной зависимости от примененной дозы ГХЦГ. Вторая фаза снижения концентрации независимо от дозы препарата завершалась полным отсутствием лизоцима в сыворотке крови. Хотя регрессионный анализ и не выявил существенных различий между линиями регрессии опыта и контроля (рис. 6), в отдельно взятые сроки исследования различия между группами оказались достоверными (Р ≤ 0,05 – 0,001).
Изменения активности бета-лизинов в сыворотке крови кроликов были однотипными и заключались в падении активности через 2 недели после начала введения препаратов с последующим восстановлением к 4 неделе до контрольного уровня (рис. 7 и 8). Исключение составляла группа кроликов, получавших ГХЦГ в дозе 4,7 мг/кг, у которых активность бета-лизинов в сыворотке крови в течение опыта не отличалась от значений контрольной группы (рис. 9). Приведенные результаты показывают, что поступление в организм кроликов относительно небольших доз пестицидов в течение двух месяцев приводит к серьезным нарушениям гуморальных факторов естественной резистентности. Так как независимо от химической структуры вводимых пестицидов направленность изменений исследованных показателей преимущественно одинакова, можно полагать, что в основе действия препаратов лежат общие механизмы.
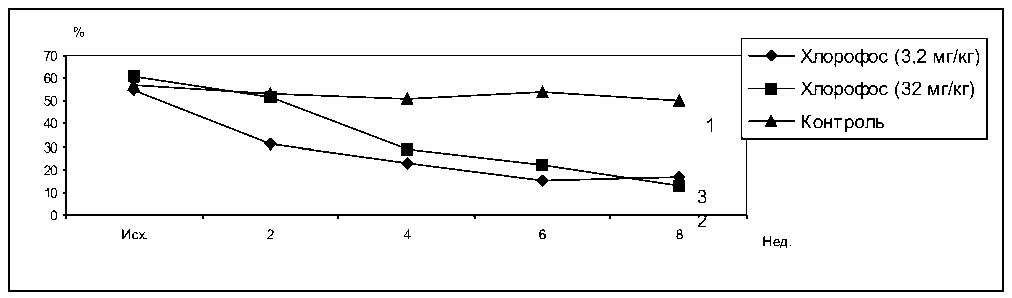
Рис. 1. Влияние хлорофоса на бактерицидную активность сыворотки крови кроликов. 1 – контроль, 2 – хлорофос 32 мг/кг, 3 – хлорофос 3,2 мг/кг
F1.2. = 2,4 F2.2. = 4,89 F3.2. = 1,52 F1.3. = 3,61 F2.3. = 17,25 F3.3. = 0,63
Данные, представленные на рис. 1-9, обработаны методом сравнения линий регрессии опыта и контроля. Вторая цифра при каждом критерии соответствует номеру линии на рисунках. Обозначение уровня достоверности критериев: ≤ 0,05; = ≤ 0,01; ≡ ≤ 0,001; ≥ 0,05.
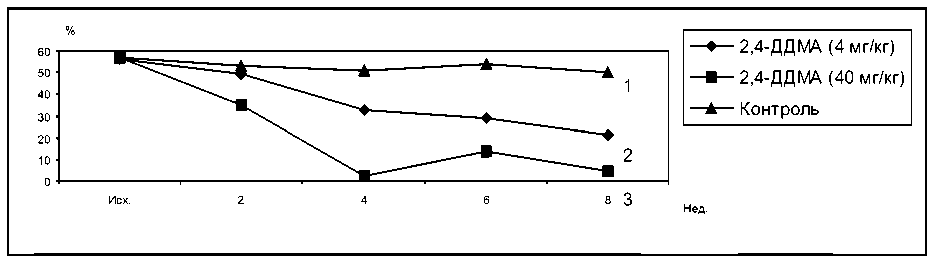
Рис. 2. Влияние 2,4-ДДМА на бактерицидную активность сыворотки крови кроликов. 1 – контроль, 2 – 2,4-ДДМА 4 мг/кг, 3 – 2,4-ДДМА 40 мг/кг
F1.2. = 1,68 F2.2. = 8,15 F3.2. = 0,29 F1.3. = 3,69 F2.3. = 13,27 F3.3. = 1,37
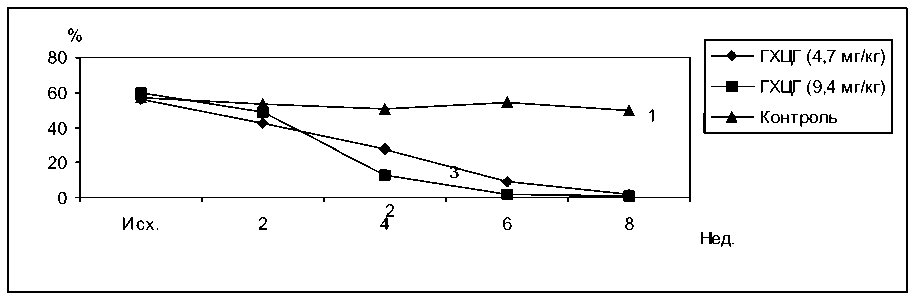
Рис. 3. Влияние ГХЦГ на бактерицидную активность сыворотки крови кроликов. 1 – контроль, 2 – ГХЦГ 9,4 мг/кг, 3 – ГХЦГ 4,7 мг/кг
F 1.2. = 2,33 F 2.2. = 4,87 F 3.2. = 1,5 F 1.3. = 1,48 F 2.3. = 3,88 F 3.3. = 0,82
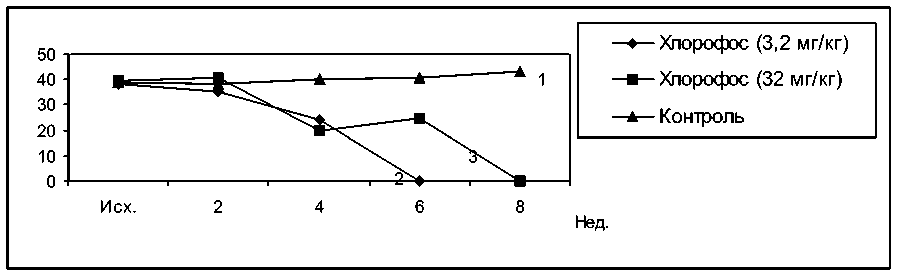
Рис. 4. Влияние хлорофоса на концентрацию лизоцима в сыворотке крови кроликов. 1 – контроль, 2 – хлорофос 3,2 мг/кг, 3 – хлорофос 32 мг/кг
F 1.2. = 5,64 F 2.2. = 11,34 F 3.2. = 2,7 F 1.3. = 3,64 F 2.3. = 3,24 F 3.3. = 2,8
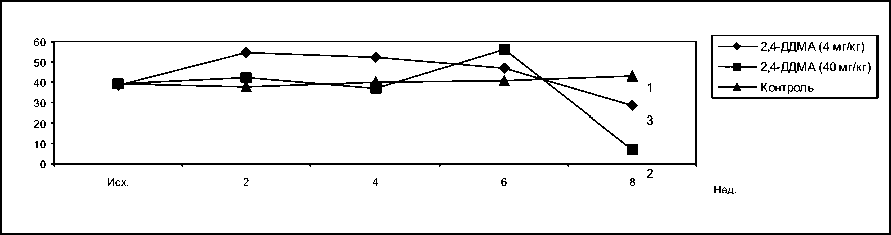
Рис. 5. Влияние 2,4-ДДМА на концентрацию лизоцима в сыворотке крови кроликов. 1 – контроль, 2 – 2,4-ДДМА 40 мг/кг, 3 – 2,4-ДДМА 4 мг/кг
F1.2. = 0,92 F2.2. = 0,02 F3.2. = 0,91 F1.3. = 3,94 F2.3. = 12,5 F3.3. = 1,22
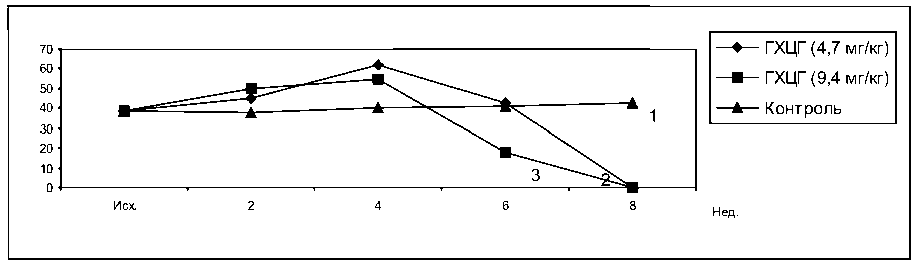
Рис. 6. Влияние ГХЦГ на концентрацию лизоцима в сыворотке крови кроликов. 1 – контроль, 2 – ГХЦГ 4,7 мг/кг, 3 – ГХЦГ 9,4 мг/кг
F1.2. = 0,89 F2.2. = 0,19 F3.2. = 0,85 F1.3. = 2,5 F2.3. = 0,17 F3.3. = 2,48
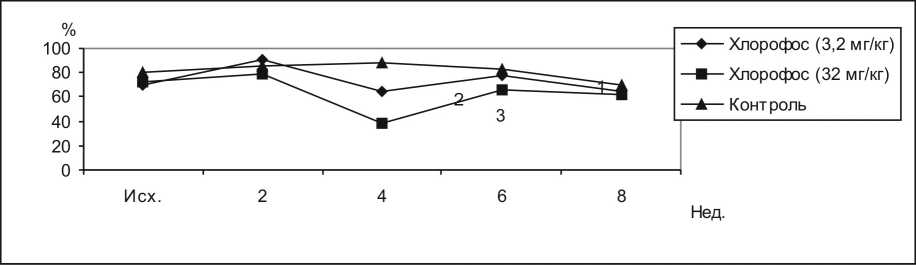
Рис. 7. Влияние хлорофоса на содержание бета-лизинов в сыворотке крови кроликов. 1 – контроль, 2 – хлорофос 3,2 мг/кг, 3 – хлорофос 32 мг/кг
F1.2. = 3,2 F2.2. = 7,98 F3.2. = 1,82 F1.3. = 4,23 F2.3. = 14,22 F3.3. = 1,81
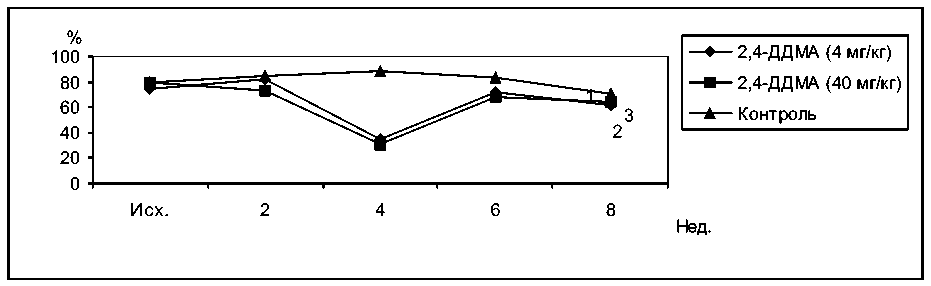
Рис. 8. Влияние 2,4-ДДМА на содержание бета-лизинов в сыворотке крови кроликов. 1 – контроль, 2 – 2,4-ДДМА 4 мг/кг, 3 – 2,4-ДДМА 40 мг/кг
F1.2. = 4,98 F2.2. = 9,84 F3.2. = 3,3 F1.3. = 5,77 F2.3. = 11,61 F3.3. = 3,76
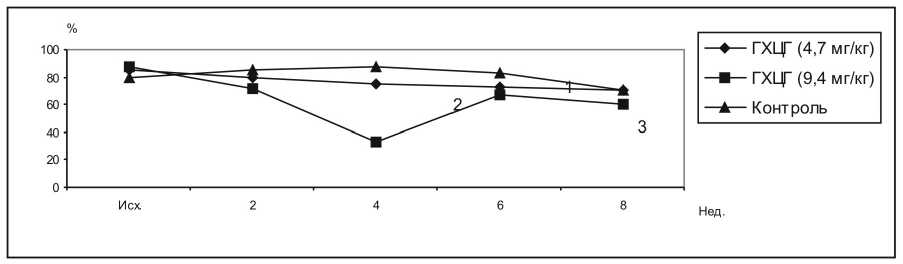
Рис. 9. Влияние ГХЦГ на содержание бета-лизинов в сыворотки крови кроликов. 1 – контроль, 2 – ГХЦГ 4,7 мг/кг, 3 – ГХЦГ 9,4 мг/кг
F1.2. = 0,37 F2.2. = 0,2 F3.2. = 0,33 F1.3. = 12,7 F2.3. = 24,73 F3.3. = 5,82
Угнетающий эффект любых химических веществ на гуморальные факторы естественной резистентности может быть реализован следующими путями:
-
1) угнетение синтеза факторов;
-
2) нарушение проницаемости плазматических мембран, вследствие чего затрудняется выход из клетки нормально синтезируемых молекул факторов;
-
3) прямое действие веществ на циркулирующие молекулы факторов, сопровождающееся блокадой активных центров молекул и снижением их функциональной активности.
Возможность реализации угнетающего эффекта по третьему пути проверена экспериментально на примере взаимодействия хлорофоса и 2,4-ДДМА с лизоцимом. Растворы кристаллического яичного лизоцима смешивали с радиоактивными препаратами так, чтобы соотношение лизоцима и -2,4-ДДМА-14С в инкубационной смеси составляло 72:52, 64:111,48:22, 18:55, 16:11, 12:222 мкг в 1 мл, лизоцима и хлорофоса –32Р 12:24, 16:12, 18:6, 48:24, 64:12, 72:6 мкг в 1 мл. После тщательного перемешивания полученную смесь ставили на диализ при 37 ° С против фосфатного буфера рН 6,2 в течение 24 часов с частой сменой буфера. Для контроля одновременно проводили диализ чистых растворов лизоцима и чистых растворов препаратов.
Измерения в газопроточном счетчике показали, что в пробах, содержавших только хлорофос или 2,4-ДДМА, радиоактивность отсутствовала, что свидетельствует о полноте диализа. Радиоактивность не установлена и в пробах, содержавших смесь лизоцима и 2,4-ДДМА, что указывает на отсутствие связывания 2,4-ДДМА с лизоцимом. Образцы, обработанные хлорофосом, сохраняли радиоактивность после диализа, что говорит о связывании хлорофоса с лизоцимом. Степень связывания зависела от концентрации хлорофоса и инкубационной смеси – с повышением ее увеличивалась и радиоактивность обработанного лизоцима. Эта связь не была прочной, так как при увеличении продолжительности диализа до 72 часов радиоактивность комплекса была в 9,6 раза ниже, чем через 24 часа. Функциональная активность комплекса лизоцим-хлорофоса и лизоцима, обработанного 2,4-ДДМА, не отличалась от активности контрольных образцов лизоцима, что было проверено по степени лизиса ацетонового горошка Micrococcus lysodaecticus.
Проведенные опыты дают основание считать, что прямое действие испытанных веществ на лизоцим не изменяет его литической активности, независимо от того, имеет ли место связывание вещества с лизоцимом. Отсутствие различий в литической активности чистого лизоцима и комплекса лизоцим-хлорофоса указывает, что присоединение хлорофоса к лизоциму не блокирует активных центров последнего.
Таким образом, можно полагать, что угнетающее действие пестицидов на гуморальные факторы естественной резистентности не реализуется по третьему пути. Осуществление угнетения по второму пути может признаваться вероятным лишь в том случае, если допустить, что разнообразные по химической структуре пестициды одинаково действуют на плазматические мембраны, вызывая снижение их проницаемости. Однако многочисленными биохимическими исследованиями установлено, что острая и хроническая интоксикация пестицидами приводит к увеличению в сыворотке крови активности ряда ферментов, которые в интактном организме располагаются преимущественно внутриклеточно. Эти факты совершенно справедливо связывают с увеличением проницаемости плазматических мембран под действием пестицидов [3, 4]. Отсюда следует, что вероятность реализации угнетающего действия пестицидов на гуморальные факторы естественной резистентности по второму пути чрезвычайно невелика. Поэтому наиболее реальным следует считать, что пестициды угнетают синтез гуморальных факторов естественной резистентности. Хотя прямые экспериментальные доказательства этого положения отсутствуют, в литературе имеется достаточно большое количество данных, указывающих на нарушение пестицидами различных биосинтетических процессов в организме человека и животных [5, 6].
В описанном выше опыте на кроликах наряду с гуморальными факторами естественной резистентности была изучена фагоцитарная активность лейкоцитов в отношении E.coli 055, результаты опытов, обработанные методом сравнения линий регрессии, представлены в табл. 1.
В течение опыта у контрольных животных фагоцитарное число и фагоцитарный индекс существенно не изменялись. У кроликов, получавших хлорофос в дозе 3,2 мг/кг, фагоцитарное число через 2 недели снизилось на 22,5%, а фагоцитарный индекс на 39% по отношению к контролю. Через 4 недели показатели фагоцитоза были снижены на 32-33%, через 6 недель – на 41 и 47% и через 8 недель – на 42 и 49%. Введение кроликам хлорофоса в дозе 32 мг/кг привело к более выраженному угнетению показателей фагоцитоза через 2 недели, по сравнению с животными, получавшими меньшую дозу препарата. Через 4 недели фагоцитарное число несколько увеличилось, но оставалось ниже контрольного уровня на 20%. В последующие сроки исследования этот показатель вновь снизился, и через 8 недель его величина составляла 57% контрольного значения. Фагоцитарный индекс через 2 недели снизился более чем в 2 раза. Через 4 недели степень снижения показателя оставалась на прежнем уровне, но через 6 недель значение индекса возросло до 70% контрольного уровня. Однако через 8 недель вновь произошло снижение показателя до 57% контрольного значения.
Введение кроликам 2,4-ДДМА в дозе 4 мг/кг снизило фагоцитарное число через 2 недели с 70 до 45,5. Через 4 недели значение показателя почти не изменилось, затем происходило его уменьшение, и к концу опыта фагоцитарное число было почти в 2 раза ниже, чем у кроликов контрольной группы. Фагоцитарный индекс снизился через 2 недели на 54%, а через 4 и 6 недель наблюдалась тенденция к его увеличению, хотя и сохранялось угнетение на 44-36%. Через 8 недель величина фагоцитарного индекса вновь уменьшилась до 43,6% контрольного уровня. Увеличение дозы 2,4-ДДМА с 4 до 40 мг/кг привело к более сильному снижению фагоцитарного числа в течение первого месяца опыта. Однако и при этой дозе 2,4-ДДМА сохранялась та же закономерность изменений показателя, характеризующаяся выраженным падением величины фагоцитарного числа через 2 недели с последующим нарастанием, сменившимся снижением через 8 недель до 50% контрольного уровня. Сходный характер имели изменения и другого показателя – фагоцитарного индекса, который в различные сроки опыта был ниже соответствующих контрольных значений в 1,7-2,2 раза.
Через 2 недели после начала введения кроликам ГХЦГ в дозе 4,7 мг/кг фагоцитарное число снижалось в 1,5 раза, а через 6 и 8 недель – в 1,8–1,9 раза. Фагоцитарный индекс у животных этой группы снизился через 2 недели почти в 2,5 раза. Через 8 недель сохранялась примерно такая же степень снижения показателя, несмотря на некоторую тенденцию к увеличению индекса через 4 и 6 недель. ГХЦГ в дозе 9,4 мг/кг вызывал стойкое уменьшение фагоцитарного числа, выраженное в большей степени, чем у кроликов предыдущей группы.
Таблица 1
Влияние пестицидов на фагоцитарную активность лейкоцитов у кроликов
|
Препарат |
Доза, мг/ кг |
Сроки иссл. (нед.) |
F1 |
F2 |
F3 |
||||||||
|
2 |
4 |
6 |
8 |
||||||||||
|
Фагоцитарное число |
|||||||||||||
|
Контроль |
70 |
69,3 |
73,3 |
71,5 |
|||||||||
|
Хлорофос |
3,2 |
55 |
47,5 |
43,3 |
42 |
19,6* |
147,5* |
17,6* |
|||||
|
Хлорофос |
32 |
42 |
55,7 |
48,3 |
41,2 |
15,7* |
58,7* |
0,9 |
|||||
|
2,4-ДДМА |
4 |
45,5 |
47,3 |
41,5 |
37 |
29,6* |
86,1* |
3,7* |
|||||
|
2,4-ДДМА |
40 |
34 |
71 |
43,5 |
35,8 |
32,7* |
129,5* |
0,4 |
|
ГХЦГ |
4,7 |
46,8 |
47,7 |
38 |
38 |
18,4* |
68,5* |
0,8 |
|
ГХЦГ |
9,4 |
35,5 |
35,8 |
42,5 |
35,3 |
38,8* |
154,7* |
0,1 |
|
Фагоцитарный индекс |
||||||||
|
Контроль |
10,9 |
11,2 |
10,3 |
11,0 |
||||
|
Хлорофос |
3,2 |
6,7 |
7,6 |
6,5 |
5,6 |
21,4* |
83,4* |
0,6 |
|
Хлорофос |
32 |
4,8 |
5,7 |
7,3 |
6,3 |
16,7* |
62,9* |
0,9 |
|
2,4-ДДМА |
4 |
4,9 |
6,3 |
6,6 |
4,8 |
34,7* |
133,7* |
1,2 |
|
2,4-ДДМА |
40 |
5,1 |
6,5 |
6,1 |
4,9 |
30,1* |
117,8* |
0,7 |
|
ГХЦГ |
4,7 |
4,4 |
5,8 |
6,6 |
4,5 |
21,7* |
81,6* |
0,8 |
|
ГХЦГ |
9,4 |
4,2 |
4,9 |
6,2 |
4,4 |
45,7* |
175,5* |
1,8 |
* – достоверность показателя ≤ 0,001
Фагоцитарный индекс у кроликов, получавших ГХЦГ в дозе 9,4 мг/кг, через 2 недели от начала опыта был более низким по сравнению с его величинами у животных, подвергавшихся воздействию других препаратов, и составлял лишь 38,5% контрольного значения. Через 4 и 6 недель степень угнетения несколько уменьшалась, однако через 8 недель фагоцитарный индекс вновь снизился почти до уровня, зарегистрированного через 2 недели.
Суммируя приведенные данные, следует отметить, что качественные изменения фагоцитарной активности лейкоцитов у кроликов опытных групп однотипны – все использованные дозы пестицидов достоверно снижают показатели фагоцитоза. Через 2 недели после начала введения препаратов фагоцитарное число было наиболее низким у кроликов, получавших 2,4-ДДМА в дозе 40 мг/кг и ГХЦГ в дозе 9,4 мг/кг – около 50% контрольного уровня. Такая закономерность сохранилась и в последующие сроки исследования. Плавное понижение процента фагоцитирующих лейкоцитов в течение затравочного периода отмечено только у кроликов, получавших меньшую дозу хлорофоса. У животных остальных групп фагоцитарное число несколько повышалась на 4–6 неделе затравки и вновь снижалось к 8 неделе. Сходный характер имели и изменения второго показателя фагоцитарной активности лейкоцитов – фагоцитарного индекса. У животных всех подопытных групп фагоцитарный индекс резко снижался через 2 недели, затем несколько повышался и вновь снижался к концу опыта.
Регрессионный анализ полученных данных показал высокую степень достоверности угнетения фагоцитарной активности лейкоцитов под действием пестицидов. Недостоверность показателя F3, указывающая на параллельность сравниваемых рядов, может рассматриваться как свидетельство стойкости угнетения фагоцитоза.
Заключение: Возможность возникновения инфекционного заболевания зависит от исхода взаимодействия микро- и макроорганизма. Чтобы вызвать заболевание, инфекционный агент, обладающий достаточно сильной вирулентностью, должен проникнуть во внутреннюю среду организма и преодолеть гуморальные и клеточные факторы естественной резистентности, сохранив свою патогенность.
Опыты на кроликах убедительно свидетельствуют о снижении под действием пестицидов бактерицидной активности сыворотки крови, концентрации лизоцима, бета-лизинов, фагоцитарной активности лейкоцитов и поглотительной функции системы мононуклеарных фагоцитов. Угнетение активности литических сывороточных факторов, безусловно, ослабляет бактерицидное действие сыворотки на микробы и снижает долю микробов, которые могут быть нейтрализованы непосредственно в кровяном русле. Обращает на себя внимание обнаруженное у кроликов резкое угнетение БАС вплоть до нулевых значений. В результате воздействия пестицидов резко ослабляется или почти полностью теряется контроль со стороны сывороточных факторов естественной резистентности за микробами, проникшими во внутреннюю среду. Одновременная регистрация показателей гуморальных факторов естественной резистентности и фагоцитарной активности лейкоцитов у одних и тех же кроликов убедительно свидетельствует о том, что угнетение фагоцитоза наступает
Г.Х. Дамдинова, В.В. Халудорова. Анализ факторов инициации и прогрессирования диабетической нефропатии раньше снижения уровней бактерицидной активности сыворотки, лизоцима и бета-лизина. Уже через 2 недели после начала введения пестицидов кроликам процент фагоцитирующих лейкоцитов уменьшается в 1,27-1,97 раза, а фагоцитарный индекс – в 1,63-2,59 раза, хотя у большинства животных в этот период еще не выявляется резкого угнетения сывороточных факторов. Такое положение должно расцениваться как свидетельство прямого угнетающего действия пестицидов на фагоцитарную функцию лейкоцитов, не опосредуемого через гуморальные факторы. Снижение к концу опытного периода уровней бактерицидной активности сыворотки, лизоцима и бета-лизинов совпадает у животных почти всех групп с максимальным падением показателей фагоцитоза, что указывает на вклад гуморальных факторов в угнетение пестицидами фагоцитарной активности лейкоцитов.


